Помимо атеросклеротического поражения сосудов, в последние годы все чаще внимание привлекает поражение сосудов в результате аутоиммунных или инфекционных васкулитов, токсических или наследственных артериопатий, сенильной амилоидной ангиопатии, что приводит к генерализованному сужению мелких сосудов и к диффузному ишемическому поражению белого вещества полушарий. Поражение мелких церебральных артерий может вызвать образование небольших (лакунарных) инфарктов мозга, которые часто протекают бессимптомно [1]. В настоящее время у подавляющего большинства населения герпесвирусы уклоняются от иммунного распознавания в структурах спинного или головного мозга, в ганглионарных тканях, легко преодолевают гематоэнцефалический барьер, что делает их малодоступными для специфических противовирусных препаратов [2]. В дополнение к липидно-инфильтративной теории атерогенеза добавилась воспалительная теория, описывающая активацию Т-лимфоцитов после их контакта с антиген-презентирующими клетками, несущими антигены, ассоциированные с комплексами гистосовместимости [3]. Атерогенная способность вирусов возрастает при наличии факторов риска развития атеросклероза (дислипопротеидемия, гиперхолестеринемия, ожирение, высокие гемодинамические нагрузки, гиподинамия, курение и др.). Атеросклероз вызывают вирусы семейства Herpesviridae (у птиц – вирусы болезни Марека; у человека – вирус Эпштейна – Барр, вирусы простого герпеса (ВГЧ-1-2т.т.), цитомегаловирусы) [4, 5].
Наиболее изученными в человеческой популяции являются ВГЧ 1-го и 2-го типов, а также цитомегаловирус (ЦМВ). Герпесвирусы могут инфицировать эндотелиальные и гладкомышечные клетки, играющие ключевую роль в развитии атеросклероза. В работе J. DuRose и соавт. впервые в экспериментальной модели кровотока было показано, что малейшее снижение его способствует инфицированию эндотелиальных клеток ЦМВ и развитию атеросклероза [6]. Многие исследователи пытались установить связь атеросклероза с герпесвирусной инфекцией, сравнивая частоту встречаемости вирусной ДНК в атеросклеротических измененных и нормальных стенках артерий. Однако полученные результаты слишком противоречивы и требуют дальнейшего изучения [7, 8]. К ранним признакам ЦВБ относят: быструю утомляемость, умеренно выраженные головные боли, раздражительность и частую смену настроения, головокружение. Далее появляется снижение работоспособности, шум в голове, проблемы со сном. Такие симптомы не являются специфическими и могут быть характерны и для хронической интоксикации, вызванной латентно протекающей герпетической инфекцией.
Цель исследования: изучить распространенность симптомов ЦВБ в ассоциации с ГИ у лиц работоспособного возраста, особенности клинического течения и изменений в цитокиновом статусе при их коморбидности.
Материалы и методы исследования
Клинико-инструментальное исследование распространенности и течения ЦВБ среди пациентов трудоспособного возраста – 35–60 лет, считавших себя практически здоровыми, изучение особенностей их цитокинового статуса иммуно-серологическим и молекулярно-биологическим методами.
Верификация диагноза ЦВБ проводилась на базе Больницы ПНЦ РАН. Пациенты при обращении подписывали информированное согласие. Исследование одобрено локальным этическим комитетом Б ПНЦ РАН, протокол № 11 от 15.06.2017 г., и проводилось в два этапа. На первом этапе осуществлялся скрининг с целью выявления ранних признаков ЦВБ.
Признаки ЦВБ по результатам осмотра и анкетирования были выявлены у 168 (36,4 %) обследованных из 485 ранее обратившихся.
Критерии включения:
лица в возрасте 35–60 лет, считавшие себя практически здоровыми, не предъявлявшие активно жалоб и обратившиеся в кабинет медицинской профилактики для очередного диспансерного осмотра.
В группу наблюдения не включались пациенты, имеющие выраженные клинические проявления ЦВБ, тяжелые заболевания сердечно-сосудистой системы (ОНМК, ОИМ, ХСН, нарушения сердечного ритма), декомпенсированный сахарный диабет 2 т., туберкулез легких, ВИЧ, гепатиты, острые и другие тяжелые хронические заболевания, женщины фертильного возраста, имеющие беременность, нарушения менструального цикла и другую тяжелую гинекологическую патологию.
Для верификации ЦВБ было продолжено клинико-лабораторное обследование (клинический анализ крови, биохимия: АЛТ/АСТ, ЩФ, общий белок, СРБ (кол.), холестерин, липидный профиль. глюкоза, мочевина, креатинин) по стандартным методикам, утвержденным МЗ РФ. Доплерография сосудов головы и шеи (УЗДГ) проводилась на аппарате SIEMENS ACUSON X300, производитель «Siemens Medical Solution Inc (USA)».
МРТ исследование головного мозга проводили в Центре магнито-ядерной диагностки г. Серпухова, имеющего все необходимые разрешительные документы МЗРФ.
Иммуно-серологическое и молекулярно-биологическое исследование для подтверждения диагноза ГИ у пациентов с верифицированным диагнозом ЦВБ, изучение цитокинового статуса проводилось методом ИФА и ПЦР согласно стандартным инструкциям к тест-системам на иммуноферментном анализаторе STAT FAX 3200 (США), на полуавтоматическом планшетном фотометре Stat Fax 2100 и шейкер-инкубаторе Stat Fax 2200 (Awareness Technology Inc) США и амплификаторе нуклеиновых кислот в реальном времени АНК-32,
С.-Петербург, Россия.
В динамике, в парных сыворотках определялись уровни специфических IgM и IgG к вирусу простого герпеса 1–2 типа (ВПГ-1-2т.) и вирусу герпеса человека – 6т. (ВГЧ-6), которые имели наиболее выраженную тропность к нервным клеткам ЦНС.
Исследование уровня провоспалительных цитокинов: IFN-γ , TNF-α, и противовоспалительных цитокинов: IL-4 и IL-10 проводилось в сыворотке крови до и после активации липополисахаридом (ЛПС) из E. coli методом ИФА по инструкции производителя тест-систем ОО «Цитокин» С.-Петербурга.
Уровень трансформирующего ростового фактора бета (TGFβ) в сыворотке крови определяли методом твердофазного ИФА с использованием коммерческих тест-систем фирмы DRG (США). ДНК к ВПГ- 1-2 т. и ВГЧ-6 типа определяли в слизи зева методом ПЦР Статистическая обработка проводилась с использованием компьютерной программы Statistica 6. Значимость различий между количественными признаками определялась при помощи t-критерия Стьюдента, между малыми выборками и качественными признаками определялась при помощи непараметрических методов (критерий Манна – Уитни, р < 0,05).
Результаты исследования и их обсуждение
На первом этапе было проведено обследование 485 пациентов, обратившихся в кабинет профилактических медицинских осмотров Больницы ПНЦ РАН. Пациенты в возрасте от 35 до 60 лет считали себя условно здоровыми, самостоятельно жалоб не предъявляли, подписывали информированное согласие, заполняли анкету по выявлению ранних клинических признаков ЦВБ; им также проводилось исследование клинического и биохимического анализа крови.
На втором этапе из 485 обследованных пациентов было отобрано 168 (м. – 77, ж. – 91), у которых выявлены начальные признаки ЦВБ (табл. 1).
Таблица 1
Начальные признаки ЦВБ
|
Начальные признаки цереброваскулярной болезни |
Количество пациентов, у которых присутствовали признаки |
|
Головные боли |
158 |
|
Нарушение сна, бессонница |
168 |
|
Снижение работоспособности, повышенная утомляемость |
106 |
|
Раздражительность, плохое настроение, эмоциональная неустойчивость |
122 |
|
Избыточная суетливость |
98 |
|
Сухость слизистых полости рта |
73 |
|
Приступы учащенного сердцебиения |
144 |
Выявлялись также факторы, провоцирующие развитие ЦВБ: Сахарный диабет 2 т. – 18; Гиперхолестеринемия, дислипидемия – 64; Ожирение – 72; Гипертония – 166; ИБС – 22; Стрессы – 76; Черепно-мозговые травмы – 11; Длительный прием оральных контрацептивов – 36; Курение – 98; Малоподвижный образ жизни – 121; Наследственность – 55.
Далее всем пациентам проводилось иммуно-серологическое и молекулярно-биологическое исследование для выявления хронической персистирующей ГИ.
По результатам проведенного иммуно-серологического и молекулярно-биологического обследования на наличие сопутствующей ГИ пациенты (п = 168) были распределены на две группы.
В 1 группу исследования (п = 79) включили пациентов с ЦВБ ассоциированной с ГИ (47 %); во 2 гр. – 89 пациентов с ЦВБ, у которых при иммуно-серологическом и молекулярно-биологическом обследовании не была выявлена ГИ (53 %).
Контрольную группу для иммуно-серологических и молекулярно-биологических исследований составили условно здоровые пациенты (п = 22) без признаков ЦВБ и ГИ. Группы наблюдения были сравнимы по полу, возрасту, медико-социальным условиям. Частота и интенсивность клинических проявлений (головных болей, нарушения сна, бессонницы, снижения работоспособности, повышенной утомляемости, раздражительности, плохого настроения, эмоциональной неустойчивости, приступов учащенного сердцебиения) у пациентов 1 группы наблюдалась в 2,3 раза чаще по сравнению с пациентами 2-й группы.
У 26 пациентов 1 гр. отмечалась также субфебрильная температура и симптомы хронической усталости, у 16 в слизи из зева методом ПЦР определили ДНК ВГЧ-6. По данным МРТ-исследования у всех пациентов 1 и 2 гр. наблюдения, в той или иной степени определялись очаги деструкции в веществе головного мозга, повреждение стенок сосудов, холестериновые отложения, аневризмы. Частота патологических проявлений по данным МРТ-исследования была в 1,4 раза выше у пациентов 1гр. по сравнению с пациентами 2гр. наблюдения. При анализе результатов клинического и биохимического анализа крови у пациентов 1гр. чаще отмечались изменения в виде лейкопении, повышения значений АЛТ и СРБ, что можно связать с хронической рецидивирующей герпетической инфекцией при коморбидности ЦВБ и ГИ. Существенной разницы в уровнях холестерина атерогенных и антиатерогенных фракций липопротеидов выявлено не было (р < 0,01):
Так, в 1 гр. – уровень ХС ЛПНП был 6,03 ± 0,51 ммоль/л и ХС ЛПВП 0,90 ± 0,21 ммоль/л;
во 2 гр. соответственно, ХС ЛПНП 5,93 ± 0,21 ммоль/л и ХС ЛПВП – 1,15 ± 0,22 ммоль/л.
Иммуно-серологическое исследование уровня антител класса IgM в диагностических титрах не выявило ни у одного пациента в период ремиссии ГИ, а 4-кратный прирост в парных сыворотках титра антител класса IgG к ВПГ 1–2 типа и ВГЧ-6 типа выявлялся у всех пациентов 1 гр. после очередного обострения ГИ. Нарастание титров специфических антител к ВПГ-1-2 т. отмечено у 53 пациентов и к вирусу герпеса 6 типа у 26, что указывало на наличие персистирующей герпетической инфекции у пациентов ЦВБ.
ДНК ВПГ-1-2 типа определялась у 41 из 79 пациентов ЦВБ ассоциированной с ГИ (51,9 %) и ВГ 6 типа у 21 из 79 (26,6 %). Отсутствие ДНК вируса ГИ у 17 пациентов (21,5 %) при повышенных значениях специфических IgG к ВПГ 1-2 типа и ВГЧ-6 типа означало наличие вирусоносительства и не требовало активных лечебных вмешательств в период ремиссии ГИ. Дополнительно в анамнезе и по данным амбулаторных карт у всех пациентов имелись указания на ранее перенесенную с клиническими проявления герпетическую инфекцию (лихорадка, везикулярные высыпания на губах, носу и/или половых органах, наличие синдрома хронической усталости). Частые обострения ГИ, более 4-х раз в году, разной степени выраженности клинических симптомов, наблюдались у 32 пациентов (40,5 %), у которых методом ПЦР определялась ДНК к ВПГ 1–2 типа (у 21) и ВГ 6 типа (у 11), регистрировались повышенные титры специфических антител и более выраженные клинические проявления ЦВБ.
На всех этапах иммунного ответа при ГИ принимают активное участие цитокины, к которым принадлежат лимфокины, интерлейкины, монокины. Выраженный дисбаланс в цитокиновом статусе был выявлен при их изучении в динамике через 12 и 24 месяца (табл. 2).
Таблица 2
Показатели цитокинового статуса в динамике через 12 и 24 месяца у пациентов с коморбидностью ЦВБ и ГИ. Содержание цитокинов (пкг/мл) в сыворотке крови
|
Показатель |
Контроль |
Через 12 мес. 1 гр. (п = 32) |
Через 24 мес. 1 гр. (п = 31) |
Через 12 мес. 2 гр. (п = 12) |
Через 24 мес. 2 гр. (п = 12) |
|
IL-4 |
23,9 ± 0,7 |
78,8 ± 33,1* |
74,5 ± 1,6 |
56,2 ± 1,7 |
52,5 ± 1,9** |
|
IL-10 |
1,87 ± 1,1 |
27,8 ± 8,4* |
25,8 ± 8,4 |
21,8 ± 0,4 |
19,6 ± 0,7** |
|
IFN-γ |
0,11 ± 0,01 |
21,3 ± 4,1* |
18,9 ± 0,7 |
41,1 ± 0,7 ** |
39,9 ± 5,1** |
|
TNF-α |
44,4 ± 2,9 |
121,9 ± 40,9* |
101,1 ± 21,9 |
166,4 ± 29,9** |
158,3 ± 20,6 |
Примечание. p < 0,01*, p < 0,05**.
Как видно из представленных данных, при ЦВБ в ассоциации с ГИ наблюдается повышение уровня всех цитокинов по сравнению с контролем, но их значения оказались значительно ниже по сравнению с пациентами ЦВБ, у которых нет ассоциации с ГИ.
Уровень противовоспалительного цитокина IL-4 у пациентов 1 группы регистрировался в 1,3 выше, чем во 2 группе, а уровень провоспалительного цитокина IFN-γ в 1 группе был в 1,9 раз ниже, чем у пациентов 2 гр., что указывало на степень выраженности воспалительной реакции.
Интерлейкин-4 является фактором, стимулирущим В-клетки, синтезируется Т-хелперами 2-го типа, ингибирует цитотоксичность Т-клеток и макрофагов, переключает синтез иммуноглобулинов класса G1 на синтез иммуноглобулинов G4 и иммуноглобулинов Е, способствует росту тканевых базофилов [9]. Особую роль играет интерферон, функция которого не только угнетение репродукции вируса, но характеризуется в первую очередь иммунорегуляцией защитных реакций организма. Интерферон влияет на фагоцитарную активность макрофагов и естественных киллеров, на прямую цитотоксичность Т-лимфоцитов и NК-клеток, на лизис инфицированных клеток Т-лимфоцитами, макрофагами, полиморфноядерными лейкоцитами [9]. Ряд авторов рассматривает дисбаланс между провоспалительными (интерферон-гамма – INF-γ) и противовоспалительными (интерлейкин 4 – IL-4) цитокинами в сторону последних, как основу развития и поддержания хронического воспаления [10, 11].
В наших исследованиях определена отрицательная корреляционная связь между ними (рисунок).
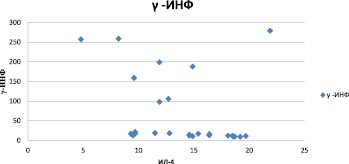
Корреляционная зависимость между IL-4 и INF-γ. Коэффициент корреляции = –0,29328
Из представленных данных видно, что при повышении уровня INF-γ наблюдается снижение IL4 и при снижении INF-γ возрастал уровень IL4.
Анализ показателей цитокинового статуса выявил у пациентов с частыми обострениями ГИ три варианта иммунного ответа при стимуляции культуры моноцитов ЛПС из E. coli.: 1 вариант – Сниженные показатели INF-γ (51,3 ±
± 4,1 пкг/мл) отмечены были у 16 пациентов из 32; 2 вариант – повышенные значения (716 ± 48,1 пкг/мл) у 6-ти и 3 вариант – неизмененные (105,3 ± 54,1 пкг/мл) у 10 пациентов.
Эти результаты дают основание с осторожностью подходить к назначению индукторов интерферона при выборе метода иммунокоррекции у пациентов с ЦВБ, ассоциированной с ГИ, так как назначение индукторов интерферона у пациентов, с низкими показателями INF-γ приводило к еще более глубокому угнетению его продукции, что в свою очередь определяло более тяжелое течение ЦВБ. Более тяжелое течение отмечено было также и в группе пациентов с повышенными значениями INF-γ.
В настоящее время активно изучается роль TGF-β1в атерогенезе. Предполагают, что TGF-β1 способствует развитию атеросклеротических повреждений стенки сосудов на фоне усиления воспаления [12, 13]. Результаты наших исследований показали более высокий уровень TGF-β1 у пациентов 1 группы (39,39 ± 2,24 нг/мл) в сравнении с 2 группой (26,82 ± 4,09 нг/мл), что свидетельствовало об активности фиброзирующих процессов и персистенции герпетической инфекции.
Таким образом отмечено значительное распространение начальных симптомов ЦВБ у лиц работоспособного возраста, которые при диспансерном и профилактическом осмотрах активно жалоб не предъявляли. Это дает основание считать анкетирование простым и доступным методом ранней диагностики и формирования групп риска этой патологии.
Установлено более тяжелое течение клинических проявлений ЦВБ у пациентов при ассоциации её с ГИ.
Наличие дисбаланса в цитокиновом статусе определяет тактику иммунотерапии при лечении ЦВБ, ассоциированной с ГИ.

