Род Hydra входит в состав отряда Cnidaria, класса Hydrozoa, порядка Hydroida, семейства Hydridae. Пресноводные представители Cnidaria населяют практически все зоогеографические области, за исключением островов Тихого океана и Антарктиды [1]. Большинство Cnidaria, включая Hydridae, обитают в стоячих и текучих водах: прудах, озерах, реках и предпочитают мезо,- эвтрофные условия. В настоящее время в составе мировой фауны Cnidaria насчитывается более 7000 видов и разновидностей, однако разнообразие фауны Cnidaria внутренних континентальных водоемов невысоко – менее 40 видов, при этом около 15 видов принадлежит роду Hydra [1], из них пять видов обитает в Европе: H. viridissima Pallas, 1766, H. circumcincta Schulze, 1914, H. oligactis Pallas, 1766, H. vulgaris Pallas, 1766 и H. oxycnida Schulze, 1914 [2].
Из пяти видов пресноводных гидроидов рода Hydra, распространенных в Европе, четыре были отмечены в озере Байкал: H. circumcincta, H. oligactis, редко, H. vulgaris и H. oxycnida (=H. oxycnidoides sensu Shultze, 1927) [3–5].
H. oxycnida является одной из самых крупных пресноводных гидр, предпочитает селиться в малоподвижных водах и ведет одиночный образ жизни, не образуя массовых скоплениий [2]. Возможно, поэтому, несмотря на размеры, ее так редко находят.
В Байкалe H. oxycnida была зарегистрирована в последний раз около ста лет назад и с тех пор больше ни разу не встречалась, что заставило исследователей усомниться в ее присутствии в озере [4]. То есть, несмотря на то, что H. oxycnida упоминается среди представителей байкальской фауны книдарий, ее присутствие в озере требует подтверждения.
Цель исследования: выявить наличие в составе фауны книдарий озера Байкал H. oxycnida с использованием морфологических и молекулярно-генетических методов исследования.
Материалы и методы исследования
Гидры были собраны на юго-восточном побережье озера Байкал – в Посольском соре, с глубины 1–2 м, вместе с высшей водной растительностью рода Potamogeton во время летних экспедиций в 2015 и 2018 гг. Часть гидр была привезена в лабораторию живыми, некоторые образцы были зафиксированы в 80 % этаноле. Видовую идентификацию проводили по ключу Шухерта [2].
Нематоцисты H. oxycnida (стенотели, десмонемы, голотрихи и атрихи изориз) исследовали и фотографировали с помощью светооптического микроскопа Olympus CX22 при 1000-кратном увеличении под иммерсионным маслом.
ДНК изолировали из одиночной живой или фиксированной гидры 2 % раствором CTAB, содержащим 0,15 мкг/мкл протеиназы К, с последующей экстракцией хлороформом и осаждением изопропиловым спиртом. Фрагменты генов мтДНК, кодирующих первую субъединицу цитохром С оксидазы (COI) и большую субъединицу рибосомы (16S), а также гены яДНК, кодирующие внутренние транскрибируемые спейсеры и 5,8S рибосомальную ДНК (ITS1–5,8S–ITS2), были амплифицированы с использованием универсальных праймеров: COI (LCO1490 5’– GGT CAA CAA ATC ATA AAG ATA TTG G–3’, HCO2198 (r) 5’– TAA ACT TCA GGG TGA CCA AAA AAT CA–3’), 16S (ARL 5’–CGC CTG TTT ATC AAA AAC AT–3’, BRH 5’– CCG GTC TGA ACT CAG ATC ACG T–3’), ITS1–5,8S–ITS2 (ITS1 (f) 5’–TCC GTA GGT GAA CCT GCG G-3’, ITS4 (r): 5’– TCC TCC GCT TAT TGA TAT GC–3).
Условия ПЦР при 30 циклах амплификации были следующими: денатурация при 94 °C – 30 с (5 минут перед первым циклом), отжиг праймера при 50 °C (или 55 °C) – 45 с, элонгация цепи ДНК при 72 °C – 90 с (10 минут после последнего цикла). Продукты реакции анализировали электрофоретически в 1 %-ном агарозном геле.
Прямое секвенирование проводили на автоматическом секвенаторе ABI 3130 (ABI PRISM®) в ЗАО «Синтол». Редактирование полученных нуклеотидных последовательностей проводили с помощью BioEdit v.7.2.5. Выравнивание последовательностей проводили с помощью программ MAFFT v.6.240 и BioEdit v.7.2.5. Выравненные и отредактированные последовательности транслировали, для того чтобы проверить отсутствие стоп-кодонов. Для молекулярной идентификации байкальских гидр, нуклеотидные последовательности, полученные в ходе нашего исследования, сравнивали с опубликованными в GenBank последовательностями для разных видов рода Hydra. Поскольку H. viridissima никогда не встречалась в озере Байкал, то для последующего молекулярно-филогенетического анализа дополнительно из базы данных GenBank были привлечены нуклеотидные последовательности только для четырех видов, распространенных на территории Европы: H. circumcincta, H. oligactis, H. vulgaris и H. oxycnida (табл. 1, 2).
Таблица 1
Попарные генетические p-дистанции между последовательностями для представителей H. oxycnida по COI (ниже диагонали) и по ITS1–5,8S–ITS2 (выше диагонили)
|
1 |
2 |
3 |
4 |
|
|
1. H. oxycnida 1054c |
– |
0,006 |
0,011 |
0,009 |
|
2. H. oxycnida 1784b |
0,059 |
– |
0,005 |
0,003 |
|
3. H. oxycnida |
0,050 |
0,009 |
– |
0,008 |
|
4. H. oxycnida из озера Байкал |
0,050 |
0,037 |
0,033 |
– |
Таблица 2
Попарные генетические p-дистанции между последовательностями COI (ниже диагонали) и ITS1– 5,8S–ITS2 (выше диагонали) для разных видов рода Hydra. Внутривидовые попарные генетические p-дистанции выделены жирным шрифтом
|
H. oxycnida |
H. oligactis |
H. vulgaris |
H. circumcincta |
|
|
H. oxycnida |
0,037 (0,004) |
0,064 |
0,205 |
0,317 |
|
H. oligactis |
0,098 |
0,018 (0,007) |
0,214 |
0,321 |
|
H. vulgaris |
0,123 |
0,122 |
0,052 (0,026) |
0,251 |
|
H. circumcincta |
0.161 |
0,158 |
0,132 |
0,046 (0,027) |
Попарные генетические p-дистанции между нуклеотидными последовательностями вычисляли с помощью Mega v.6. Анализ генетических дистанций проводили по фрагменту гена COI мтДНК и генам ITS1–5,8S–ITS2 яДНК. 16S рДНК не использовали в данном виде анализа из-за консерватизма этого маркера на внутривидовом уровне. Для сравнения внутривидовых и межвидовых генетических дистанций использовали по возможности популяционные выборки видов рода Hydra. Номера доступа в GenBank: ITS1–5,8S–ITS2 – JX448864–JX448925, GU722750–GU722732, GU722678–GU722691, KP895134; COI – GU722866–GU722875, GU722865–GU722875, GU722924–GU722885, AB565089–AB565108, GU722850–GU722853, GU722855–GU722860, MF000492, EF059938.
Комбинированное филогенетическое древо по молекулярно-генетическим маркерам COI, 16S и ITS1–5,8S–ITS2 строили байесовским методом с помощью программы MrBayes v.3.2.2. Расчетные параметры были следующими: два независимых запуска программы по 25000000 генераций для четырех марковских цепей Монте-Карло с частотой отбора параметров каждой 1000-й генерации, исключая как шум первые 25 % генераций. Остальные параметры были использованы без изменений. Модель нуклеотидных замен для всех трех молекулярно-генетических маркеров выбирали отдельно с помощью программы jModelTest v.2.1. В каждом случае наиболее подходящей моделью была GTR+I+G. Сходимость результатов байесовского анализа оценивали по значениям эффективного размера выборки (ESS) в программе Tracer v.1.6. Номера использованных последовательностей: COI – GU722918, GU722876, GU722877, KP895120, GU72286, GU722860; 16S – GU722773, GU722789, GU722790, GU722833, KP895109; ITS1–5,8S–ITS2 – GU722844, GU722673, GU722680, GU722689, GU722690, KP895134.
Результаты исследования и их обсуждение
Во время экспедиционных работ в Посольском соре нам удалось найти среди массово развивающихся H. oligactis малочисленных представителей H. oxycnida (30 экземпляров), прикрепленных к рдестам. Собранные гидры были идентифицированы как H. oxycnida по морфологическим признакам строения полипа, а также с помощью микроскопического исследования их нематоцист (рис. 1). Длина тела полипа в прижизненном состоянии варьировала от 1,5 до 2,5 см. У большинства гидр присутствовало 8 щупалец, у единичных особей встречалось 9–10 щупалец. Щупальца в расслабленном состоянии составляли не более 1/3 длины тела. Стенотели крупные (до 19 мк), яйцевидные, отношение ширины к длине равно 0,6, верхняя часть характерно заужена. Ширина капсул голотрих изориз не превышала половины их длины. Все перечисленные морфологические признаки полностью согласуются с описанием Шухерта [2]. Зафиксированные образцы H. oxycnida хранятся в коллекции Лимнологического института СО РАН.
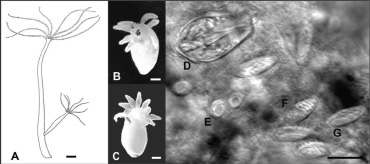
Рис. 1. A – внешний вид H. oxycnida, рисунок адаптирован из Schuchert (2010) [2]; B и С – фото H. oxycnida, зафиксированный материал; D–G – Нематоцисты H. oxycnida: D – стенотела, E – десмонема, F – голотриха изоризы, G – атриха изоризы. A–C – масштаб 1000 мк, D–G – масштаб 10 мк
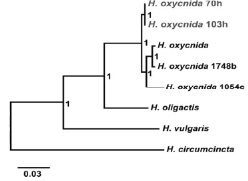
Рис. 2. Комбинированное байесовское древо, построенное на основе COI, 16S и ITS1–5,8S–ITS2 молекулярно-генетических маркеров. В узлах приведены апостериорные вероятности. Серым шрифтом выделены байкальские представители H. oxycnida
В ходе исследования было расшифровано 3 нуклеотидных последовательности для фрагмента гена СOI (603 п.н.), 3 последовательности фрагмента гена 16S (508 п.н.) и 3 последовательности ITS1–5,8S–ITS2 (702 п.н.). Нуклеотидные последовательности от разных организмов по всем трем маркерам не отличались между собой, то есть собранные гидры, скорее всего, являются представителями одной колонии.
Генетические дистанции между разными представителями внутри вида H. oxycnida по маркеру COI колеблются от 0,009 до 0,059, по ITS1–5,8S–ITS2 – от 0,003 до 0,011, при этом генетические дистанции между байкальскими представителями и европейскими составляют 0,033–0,050 и 0,003–0,009 соответственно (табл. 1). Средняя генетическая дистанция для всех представителей H. oxycnida, включая байкальских, составила по COI – 0,037, ITS1–5,8S–ITS2 – 0,004, что сопоставимо с внутривидовыми генетическими дистанциями для других представителей Hydra (табл. 2).
Межвидовые дистанции по маркеру COI как минимум в два раза превышают внутривидовые и колеблются от 0,098 до 0,161 (табл. 2). По маркеру ITS1–5,8S–ITS2 межвидовые дистанции варьируют от 0,064 до 0,321.
На филогенетическом древе видно, что исследуемые гидры из озера Байкал кластеризуются вместе с европейскими представителями H. oxycnida и формируют с ними единую кладу (рис. 2).
Озеро Байкал – глубочайший (более 1600 м) пресноводный водоем олиготрофного типа, представляющий собой древнюю и уникальную по видовому разнообразию экосистему с высоким уровнем эндемизма [6]. Температура верхних слоев воды вдоль открытых побережий Байкала не превышает 12–14 °C, и глубже 200–250 м она постоянна круглый год и составляет 3,6–3,3 °C. Однако в летний период в заливах и сорах температура достигает 22–24 °C [3] и условия обитания в таких бухтах близки к мезо,- эвтрофным. Посольский сор – один из самых прогреваемых мелководных заливов, расположен на юго-восточном побережье Байкала. Залив отделен от Байкала песчаными косами, между которыми есть пролив Прорва шириной 700 м. Через пролив осуществляется выход вод из залива. Воды глубоководной части Байкала проникают в сор только во время сильных штормов и бурь, благодаря этому в заливе присутствует особый микроклимат, по всей видимости, благоприятный для развития H. oxycnida. В других исследованных нами районах оз. Байкал представители H. oxycnida не были найдены, хотя были обнаружены массовые скопления H. oligactis. Следует отметить, что недавно H. oxycnida была обнаружена на Британских островах [7], что свидетельствует о более широком географическом ареале этих гидр, чем предполагалось ранее.
Небольшие, по сравнению с другими видами Hydra, генетические дистанции между H. oxycnida и H. oligactis, объясняются тем, что эти виды принадлежат группе «oligactis» и свидетельствуют о более молодом их происхождении [8, 9].
Нередко близкородственные виды в пределах рода [10], живущие в одном местообитании, сходны по морфологии, физиологии, экологии, поэтому зачастую у них возникают конкурентные отношения. О наличии конкуренции между двумя симпатрическими видами H. oligactis и H. oxycnida из озера Байкал свидетельствует подавляющая численность первого (более 100000 экз/м2) и крайне низкая второго (всего лишь несколько десятков – до 30 экз./ м2) в фитоценозе рдеста в Посольском соре. В настоящее время в других районах Байкала H. oxycnida, в отличие от H. oligactis, не найдена. Оба вида, хотя и являются r-стратегами, тем не менее в ходе эволюции приобрели различия в морфологии, в стратегии питания и размножения. H. oligactis много ресурсов вкладывает, по всей видимости, в размножение и поэтому мельче (около 1 см), а H. oxycnida, наоборот, в увеличение своих размеров (2–3 см), хотя и размножается почкованием, но большой плотности не образует. Вероятно, интенсивность конкуренции между видами в какой-то мере ослабевает за счет использования микроместообитаний – разных ярусов фитоценозов. В частности, H. oxycnida населяет заросли рдеста ближе к донным отложениям (нижний ярус), прикрепляясь с обратной поверхности листьев, а H. oligactis в массе концентрируется в верхнем ярусе, ближе к свету с обеих сторон листьев, на стеблях. Обитатели верхнего яруса фитоценоза питаются преимущественно представителями зоопланктона, а нижнего яруса – как зоопланктоном, так и представителями зообентоса.
Ареал H. oligactis намного шире, чем у H. oxycnida, тем не менее внутривидовой полиморфизм у первого вида значительно меньше, чем у последнего (табл. 2). Возможно, такой низкий генетический полиморфизм этого массового вида связан с постоянным перемешиванием его популяций в результате трансконтинентального переноса, которому способствуют как животные, птицы, так и человек [11].
По сравнению с представителями H. oligactis, способными к интенсивному (до 20 полипов на одной особи) почкованию [4], представители видов H. oxycnida демонстрируют низкую скорость почкования и низкую устойчивость к стрессу [12]. В связи с этим представители H. oxycnida не образуют массовых скоплений, возможно, поэтому популяции (или колонии) этого вида редко обмениваются генетическим материалом и их внутривидовой полиморфизм выше по сравнению с H. oligactis.
Заключение
Согласно морфологическому анализу и молекулярно-генетическим исследованиям найденные образцы гидр однозначно принадлежат виду H. oxycnida. На сегодняшний день неясно, ограничен ли ареал H. oxycnida в озере Байкал или он шире, чем представлено в данном исследовании. Тем не менее с уверенностью можно сказать, что этот вид гидр обитает в соровой зоне озера и при тщательном исследовании его можно обнаружить.
Исследование выполнено в рамках бюджетной темы № 0345–2016–0004 (АААА-А16-116122110060-9).

