Для восстановления утраченных структуры и функций органов и тканей современная регенеративная медицина, трансплантология и тканевая инженерия предполагает применение тканеинженерных препаратов, состоящих из матрицы, заселенной стволовыми или соматическими клетками, либо использование матриц из биологически активных материалов без предварительного заселения их клетками. Насыщение таких препаратов клетками реципиента происходит из окружающих тканей уже после их имплантации в живой организм. В качестве основы для получения матриц, как правило, используются биосовместимые, биорезорбируемые полимеры, такие как полилактид, поликапролактон, полигликолид, полигидроксиалканоаты, хитозан, коллаген, альгинат. Матрица может иметь различную структуру: в виде пористой или непористой пленки, губки, нетканого материала, а также в виде трубки или волокна [1–3]. Разнообразие полимеров и получаемых на их основе матриц, широта их применения в различных органах и тканях при различных патологиях ставит перед исследователями вопрос о степени биосовместимости, функциональности интегрируемых в организм биоинженерных препаратов, скорости и механизме их биорезорбции. Заболевания трубчатых органов, таких как кровеносные сосуды, трахея, бронхи, пищевод, различные отделы кишечника, мочеточник и мочеиспускательный канал, встречаются достаточно часто. В связи с этим получение трубчатых тканеинженерных препаратов для протезирования трубчатых органов приобретает особую актуальность.
Одним из наиболее перспективных способов получения матриц для последующего создания тканеинженерных препаратов является метод электроформования нано- и микроволокон [4, 5]. Метод заключается в подаче раствора полимера через подающий электрод-фильеру в электрическое поле, где струя раствора распадается на микро- и наноструи, которые с высокой скоростью оседают на приемном электроде в виде микро- или нановолокон в зависимости от свойств раствора и растворенного в нем полимера. В результате получаются нетканые волоконные 3D структуры с системой открытых пор [6]. Такое строение не препятствует миграции клеток из окружающих тканей во весь объем матрицы и способствует достаточно интенсивному обмену питательными веществами и газами между заселяемой клетками матрицей и окружающими ее нативными тканями. При использовании приемного электрода в виде вращающегося металлического стержня, на его поверхности формируется трубчатая нетканая волоконная структура, которая в дальнейшем может быть использована в качестве матрицы при разработке тканеинженерного препарата для трубчатых органов.
В свою очередь, одним из наиболее перспективных полимеров для получения матриц является полилактид – алифатический полиэфир, мономером которого является молочная кислота, сырьем для производства молочной кислоты являются возобновляемые растительные источники. Полилактиды и сополимеры на их основе применяются для производства биодеградируемой пищевой упаковки и одноразовой посуды, медицинских шовных нитей, стентов, штифтов и винтов для травматологии [7, 8]. В организме полилактид разрушается до молочной кислоты, которая является естественным метаболитом и усваивается окружающими клетками [9].
Целью работы являлось исследование взаимодействия биорезорбируемой трубчатой матрицы на основе поли(L-лактида) или (L-ПЛА), полученной методом электроформования, со скелетной мышечной тканью крысы для оценки перспективности дальнейшего ее использования в составе тканеинженерных препаратов в регенеративной медицине и тканевой инженерии при протезировании трубчатых органов.
Материалы и методы исследования
Для получения матриц использовался L-ПЛА «Purasorb PL-10» производства фирмы Corbion Purac (Нидерланды). L-ПЛА растворяли в хлороформе, раствор полимера концентрацией 15 % (мас.) на лабораторной установке Nanon-01A (Япония) с помощью инжекторного насоса подавали через электрод-фильеру в электрическое поле (напряженностью 16 кВ), расстояние между электродами составляло 150 мм, осаждение волокон происходило на вращающийся со скоростью 1500 об/мин цилиндрический электрод диаметром 1,1 мм. Полученные трубчатые образцы имели внутренний диаметр 1,1 мм и толщину стенки 320 мкм.
Электронно-микроскопические исследования образцов проводили на сканирующем электронном микроскопе Supra 55VP (Carl Zeiss, Германия) в режиме регистрации вторичных электронов, с предварительным нанесением тонкого слоя платины. Образцы после экспозиции в животных предварительно фиксировались в 10 % нейтральном формалине.
Исследование структуры полимера матрицы производилось методом рентгеноструктурного анализа на установке WAXD, Bruker D8 DISCOVER (Германия).
Температуры стеклования, плавления и кристаллизации ПЛА определялись с помощью дифференциальной сканирующей калориметрии (ДСК) DSC 204 F1 Phoenix, Netzsch (Германия), в атмосфере аргона.
Эксперименты in vivo проводили на самцах белых крыс Wistar в соответствии с правилами проведения работ с использованием экспериментальных животных (принципы Европейской конвенции, Страсбург, 1986 г., и Хельсинкская декларация Всемирной медицинской ассоциации о гуманном обращении с животными 1996 г.). Вес подопытных животных составлял 180–200 г, возраст – 3 мес, количество – 10 шт. Животных оперировали под общей анестезией (растворы Zoletil 100 – 0,1 мл и Rometarum 20 мг/мл – 0,0125 мл на 0,1 кг массы животного, интраперитонеально). Матрицы длиной 4 мм помещали в широчайшую мышцу спины (musculus latissimus dorsi) крысы с обеих сторон: с одной стороны исходная матрица, а с другой термообработанная. Было использовано по 5 животных на каждый срок эксперимента. После имплантации раны послойно ушивали атравматическими иглами с нитью Prolen 4-0. После наложения наружных швов крыс содержали в индивидуальных клетках, животные получали свободный доступ к воде и стандартную диету. Все животные были активны, негативного влияния имплантации материалов не выявлено, о чем свидетельствовали общее состояние и отсутствие воспалительных процессов в зоне имплантации.
Для морфологического исследования через 6 и 15 месяцев фрагменты мышечной ткани с матрицами фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 ч. Используя стандартную гистологическую методику со спиртами возрастающей концентрации, материал заливали в парафиновые блоки. Срезы толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония) и окрашивали гематоксилином Майера и эозином (Bio-Optica, Италия). Визуализацию соединительной ткани проводили по методу Маллори (БиоВитрум). Препараты изучали в поле светового микроскопа DM-750 (Leica, Германия) с использованием окуляра 10×, объективов 4, 10, 40, 100×. Запись цифровых изображений выполняли с помощью фотокамеры ICC50 (Leica, Германия).
Результаты исследования и их обсуждение
На рис. 1 приведены микрофотографии трубчатых матриц, полученных из раствора L-ПЛА методом электроформования, из которых видно, что матрицы имеют пористую структуру с открытой системой пор, соединенных друг с другом и внешней средой каналами. Такая структура позволяет питательным веществам, продуктам жизнедеятельности клеток, растворенным газам свободно циркулировать в объеме матрицы, а размер пор 10–50 мкм способствует свободной миграции клеток. Внутренний диаметр полученных матриц составляет 1,1 мм, толщина стенки 320 мкм, волокна не имеют преимущественной ориентации, между ними располагаются поры (рис. 1, а, б). Данные рентгеноструктурного анализа и ДСК показали, что полимер в микроволокнах матрицы обладает аморфной структурой. При имплантации таких матриц в живой организм в ряде случаев может наблюдаться их деформация под давлением окружающих тканей, нарушение целостности стенки, ее расслоение в местах контакта с шовной нитью. Это связано в первую очередь с механическими характеристиками матриц, что было показано нами ранее [10]. Для улучшения механических характеристик часть матриц подвергалась термообработке в фиксированном на приемном электроде состоянии при T = 70 °C в течение 1 часа, при этом происходила частичная кристаллизация полимера – около 44 %, по данным ДСК и рентгеноструктурного анализа. При этом наблюдалась усадка волокон с уменьшением толщины стенки матрицы до 250 мкм и уплотнением волоконной структуры, внутренний диаметр при этом оставался неизменным (рис. 1, в, г).

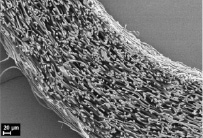
а) б)
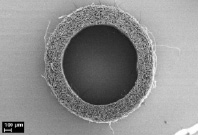
в) г)
Рис. 1. Электронные микрофотографии исходной (а, б) и термообработанной матрицы (в, г)
В экспериментах на животных использовались исходные и термообработанные матрицы. Через 6 месяцев экспозиции в мышечной ткани макроскопически вокруг обеих матриц определяются умеренно выраженные соединительнотканные капсулы, равномерно их покрывающие, рубцовые процессы в месте имплантации не выражены.
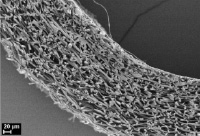
Морфологический анализ исходной матрицы показал, что её внутренний просвет не определяется ввиду смыкания стенок (рис. 2, а), соединительнотканная капсула вокруг матрицы без признаков воспалительной реакции. Стенка матрицы заселена клетками соединительной ткани, между волокнами выявляются в основном фибробласты, макрофаги, единичные лейкоциты, по периферии матрицы встречаются немногочисленные гигантские многоядерные клетки инородных тел. Сформированные зрелые коллагеновые волокна располагаются между волокнами L-ПЛА во всей стенке матрицы. Оформленные пучки коллагеновых волокон разделяют матрицу на пласты, во внешних слоях матрицы пучков коллагеновых волокон больше и они расслаивают матрицу на большее количество пластов. Наблюдаются первые признаки начала биорезорбции: поперечные трещины микроволокон и слабовыраженная их пористая структура на срезе (рис. 1, б).

а) б)
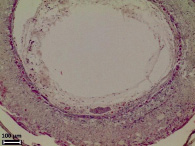
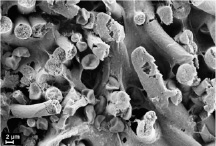
в) г)
Рис. 2. Гистологические срезы и электронные микрофотографии матриц через 6 мес после имплантации в мышечную ткань крысы, исходной (а, б) и термообработанной (в, г), а, в – окраска гематоксилином и эозином, об. ×10
Морфологический анализ термообработанной матрицы выявил, что через 6 месяцев пребывания в мышечной ткани матрица сохраняет свой внутренний просвет (рис. 2, в), в 2 случаях из 5 выявлено некоторое уплощение, в результате чего просвет приобрел овальную форму, в соединительнотканной капсуле вокруг матрицы не определяется воспалительной реакции. Стенка заселена фибробластами, макрофагами, по периферии с наружной стороны матрицы выявляются единичные гигантские многоядерные клетки инородных тел. Зрелые коллагеновые волокна пронизывают всю толщу стенки матрицы, пучков коллагеновых волокон не формируется, разделение стенки матрицы на пласты отсутствует. Также наблюдаются признаки начала биорезорбции в виде поперечных трещин микроволокон, их пористая структура, выраженность этих признаков выше, чем у исходных матриц (рис. 2, г).
При эксплантации через 15 месяцев исходной и термообработанной матриц вокруг обеих макроскопически определяются умеренно выраженные соединительнотканные капсулы, равномерно покрывающие матрицы, рубцовые процессы в месте имплантации не выражены, Морфологическая картина на данном сроке эксперимента в целом схожа с таковой через 6 месяцев экспозиции.
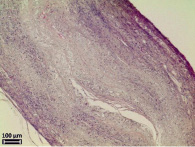
Морфологический анализ исходной матрицы показал отсутствие воспалительной реакции в соединительнотканной капсуле вокруг матрицы. Внутренний просвет не определяется, значимых изменений формы и размеров не произошло (рис. 3, а). Стенка матрицы полностью заселена фибробластами, макрофагами и единичными гигантскими многоядерными клетками инородных тел, располагающимися по периферии. Волокна коллагена пронизывают всю стенку матрицы, преобладая с наружной и внутренней стороны. Пучки коллагеновых волокон более толстые по сравнению с таковыми на предыдущем сроке эксперимента и располагаются неупорядоченно друг относительно друга, разделяя стенку матрицы на пласты. Признаки биорезорбции выражены значительнее, чем через 6 месяцев экспозиции, микроволокна более фрагментированные и более пористые (рис. 3, б).
Морфологический анализ термообработанной матрицы выявил отсутствие воспалительной реакции в окружающей ее соединительнотканной капсуле. Во всех случаях наблюдается уплощение матриц с полным закрытием просвета (рис. 3, в). Визуально соединительнотканных клеток в стенке матрицы больше, по сравнению с исходной матрицей на аналогичном сроке эксперимента. Выявляются в основном фибробласты, фиброциты, макрофаги и единичные гигантские многоядерные клетки инородных тел. Стенка матрицы полностью пронизана коллагеновыми волокнами, но по периферии стенки, как с внешней, так и с внутренней стороны коллагеновых волокон больше. Однако разделения стенки матрицы на пласты не происходит. Наблюдаются выраженные признаки биорезорбции матрицы, большая часть микроволокон резорбирована, оставшиеся волокна определяются в виде импрегнированных в соединительную ткань отдельных высокопористых фрагментов (рис. 3, г). Большая скорость биорезорбции термообработанных матриц, возможно, вызвана неоднородностью полимерной структуры микроволокон, а именно наличием кристаллических и аморфных областей.
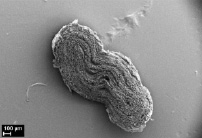

а) б)
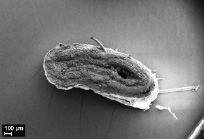

в) г)
Рис. 3. Электронные микрофотографии матриц через 15 мес после имплантации в мышечную ткань крысы, исходной (а, б) и термообработанной (в, г)
Заключение
Показано, что трубчатые матрицы на основе (L-ПЛА) как исходные, так и термообработанные имеют высокую степень биосовместимости с мышечной тканью крысы, не вызывают выраженной воспалительной реакции, полностью прорастают соединительной тканью. Матрицы имеют длительные сроки биорезорбции, что позволяет клеткам из окружающих тканей полностью заполнить весь свободный объем матрицы и сформировать структуру, морфологически и функционально приближенную к нативной. Однако исходные матрицы обладают слабо выраженными каркасными свойствами, что приводит к сдавливанию их окружающими тканями и закрытию функционально значимого внутреннего просвета. Термообработанные матрицы, напротив, обладают выраженными каркасными свойствами, не склонны к расслаиванию стенки и могут быть рекомендованы для использования в составе тканеинженерных препаратов в регенеративной медицине и тканевой инженерии для протезировании трубчатых органов.
Работа выполнена при поддержке Российского научного фонда, проект № 14-33-00003.

