В настоящее время наиболее частым хроническим заболеванием опорно-двигательного аппарата и главной причиной инвалидности у пожилых людей является остеоартроз (деформирующий артроз различных суставов), около 15 % мирового населения подвержены заболеванию [1, 2]. Данная проблема увеличивает свои масштабы и представляет серьёзную социально-экономическую проблему и рост числа личных трагедий. При остеоартрозе заболеванию подвержен весь сустав, включая синовиальную оболочку, кость, сухожилия, связки, мышцы. Коксартроз – дегенеративно-дистрофическое хроническое, прогрессирующее заболевание тазобедренного сустава мультифакторной этиологии, при котором нарушаются структура и метаболизм суставного хряща, что приводит к его деструкции. На более поздних стадиях развития данной патологии разрушаются суставные поверхности, появляются остео- фиты, определяются нарушения в организации субхондральной кости, вовлекаются в процесс параартикулярные ткани, в том числе мышечная [3]. Заболевание сопровождается болями, ограничениями движений в суставе, атрофией прилежащих мышц.
Первичный коксартроз возникает без видимых причин, поражая одновременно суставные хрящи обоих суставов. Вторичный коксартроз обуславливается наличием других заболеваний, которые выступают в качестве почвы для его развития, таких как дисплазия тазобедренного сустава, асептический некроз, различные воспалительные процессы, травмы, перегрузка сустава, гормональные изменения, остеопороз [3, 4].
Здоровый тазобедренный сустав покрыт достаточно массивным слоем мышц, таких как малая, средняя, большая ягодичные мышцы. При этом главными мышечными элементами непосредственно тазобедренного сустава считаются ягодичные и бедренные, которые помимо двигательной функции выполняют и роль фиксатора, не давая головке бедренной кости покидать вертлужную впадину. Слабость этих мускулов может стать косвенной причиной нестабильности тазобедренного сустава. Часть нагрузок при беге и ходьбе также возлагается на мышцы, которые выступают в качестве амортизатора и своеобразной помпы, качающей кровь, от чего зависит уровень циркуляции и доставка питательных веществ. Так, известно, что люди с остеоартритом занимаются ходьбой с более низкими пиковыми силами мышц бедра, чем здоровые лица [5]. Хотя патогенез и морфология коксартроза достаточно хорошо изучены и описаны в литературе, многие аспекты патологии мышц при этом заболевании освещены недостаточно. Также остаётся малоизученной связь между клиническими проявлениями коксартроза, длительностью заболевания и особенностями морфологии околосуставных мышц. Всё это обусловило проведение данного исследования.
Цель работы: выявить гистологические особенности мышечной ткани, прилежащей к области тазобедренных суставов пациентов с деформирующим коксартрозом.
Материалы и методы исследования
Материалом для исследования послужили клинические данные и операционный материал 20 пациентов, оперированных по поводу коксартроза, которым производили эндопротезирование тазобедренных суставов. Средний возраст больных составил 47,5 ± 7,7 лет, из них 11 мужчин и 9 женщин, давность заболевания в среднем 11,2 ± 3,6 лет; 4 пациента имели данную патологию более 30 лет. У 10 пациентов определяли левосторонний коксартроз, у 7 – правосторонний, двустороннее поражение суставов имели 3 пациента. У всех больных наблюдалось ограничение подвижности пораженного тазобедренного сустава, а также гипотрофия мышц бедра и голени на стороне патологии. Пациенты, у которых осуществляли взятие операционного материала в ходе хирургического вмешательства, были информированы о необходимости проведения гистологического исследования и дали согласие на его выполнение.
Во время операций применялась стандартная техника эндопротезирования тазобедренного сустава, для гистологического исследования иссекались околосуставные ткани: участки капсул тазобедренных суставов и фрагменты прилежащих средней и малой ягодичных мышц. Материал фиксировали в 10 % растворе нейтрального формалина, после гистологической проводки заливали в парафин. Срезы окрашивали гематоксилином и эозином, по Ван-Гизону, трихромным методом по Массону. Препараты исследовали посредством стереомикроскопа «AxioScope.A1» со встроенной цифровой фотокамерой «AxioCam» (Carl Zeiss MicroImaging GmbH, Германия).
Результаты исследования и их обсуждение
При клиническом анализе пациентов диагноз коксартроз 2 степени установлен в двух случаях, коксартроз 2–3 степени также в двух случаях, в остальных 16 – коксартроз 3 степени. Три пациента имели врождённую аномалию развития тазобедренных суставов. Большинство больных передвигались, используя дополнительное средство опоры – трость, испытывая постоянную ноющую боль.
В исследованном операционном материале преобладала плотная оформленная и неоформленная соединительная ткань в сочетании с фрагментами мышечной ткани с различной степенью дегенерации – 14 случаев. У 6 больных в препаратах преобладала мышечная ткань с признаками выраженной жировой дистрофии и фиброза. Каких-либо существенных гистологических различий у пациентов со 2, 2–3 или 3 степенью коксартроза выявить не удалось.
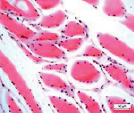
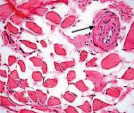
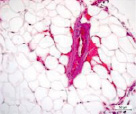
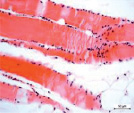
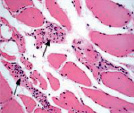
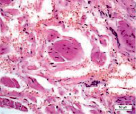
Мышечная ткань содержала небольшое количество микрососудов в эндомизии, наблюдались стадии жирового перерождения мышечных волокон: от ореола до полного замещения волокон адипоцитами (рис. 1, а, б), а также обширные поля жировой дегенерации с погружёнными в них сосудами (рис. 1, в). Отмечены волокна с обратимыми и необратимыми контрактурами (рис. 1, г), в состоянии миофагии и с центрально локализованными ядрами (рис. 1, д), с внутренними ядрами, картины обширных геморрагий в интерстициальном пространстве (рис. 1, е). В случаях с врождённой патологией тазобедренного сустава сосуды артериального звена в перимизии отличались особенно фиброзированными оболочками (рис. 1, б).
а) б) в)
г) д) е)
Рис. 1. Фрагменты мышечной ткани. Случай с врождённой аномалией развития тазобедренного сустава представлен под буквами: б, в. а) ранняя стадия жирового перерождения мышечных волокон (ореол); б) выраженный фиброз сосуда артериального типа (стрелка) хаотично ориентированные ГМК, мелкие атрофичные мышечные волокна, различные стадии жировой дегенерации волокон; в) перимизиальный сосуд с узким просветом погружён в конгломерат адипоцитов; г) контрактурно изменённые мышечные волокна; д) мышечные волокна в состоянии миофагии (стрелки); е) внутренние ядра в волокнах (в центре), геморрагии в интерстиции. Парафиновые срезы, окрашенные гематоксилином и эозином, увеличение: 400х, в – 200х
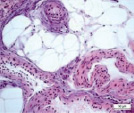
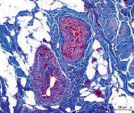
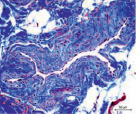
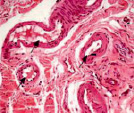
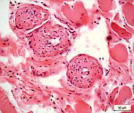
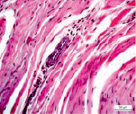
Сосуды перимизия были нередко погружены в фиброзно-жировые разрастания, большинство имели узкие либо облитерированные просветы (рис. 2). Стенки сосудов артериального русла, как правило фиброзированы, гладкомышечные клетки в t. media ориентировались хаотично и лишь изредка циркулярно (рис. 2, а, б, в). Контуры крупных сосудов извиты (рис. 2, а, в), эндотелиоциты, выбухающие в просвет, иногда полностью замещались жировыми клетками (рис. 2, г), как в случае с врождённой аномалией развития сустава; наблюдались сосуды с полной облитерацией просветов (рис. 2, д). Для фиброзной основы суставной капсулы были характерны дистрофические изменения, фрагменты плотной волокнистой оформленной либо неоформленной соединительной ткани, сосуды с суженными просветами (рис. 2, е).
а) б) в)
г) д) е)
Рис. 2. Перимизиальные сосуды в мышечной ткани. Случай с врождённой аномалией развития сустава под буквами г, д: а) сохранена нормальная толщина t. media, относительно открытые просветы; б) средняя оболочка сильно утолщена, просвет спазмирован, хаотичная ориентация ГМК, t. adventicia с признаками фиброза; в) крупная артерия с извитым контуром фиброзирована, просвет почти полностью облитерирован; г) выбухающие в просвет клетки интимы сосудов замещены адипоцитами (стрелки); д) сильный фиброз сосудов, полная облитерация просвета (верхний); е) плотная оформленная волокнистая соединительная ткань, сосуд с узким просветом (в центре). Парафиновые срезы, окрашенные: а, б, в – трихромным методом по Массону, г, д, е – гематоксилином и эозином, увеличение: 400х, б, е – 200х
В результате проведенного анализа связей между клиническими данными и морфологическими характеристиками было установлено, что существует прямая зависимость между давностью заболевания и степенью фиброзирования внутримышечных перимизиальных сосудов. Однако между такими клиническими показателями, как степень коксартроза и возраст больных, с одной стороны, и выраженность патоморфологических изменений мышечной ткани, с другой стороны, определённой зависимости не выявлено.
Несмотря на множество проводимых исследований, в настоящее время нет единого мнения в понимании природы возникновения и развития коксартроза. Триггерными факторами могут являться метаболические расстройства, наследственность, травмы, вредные привычки, условия труда, изменения биомеханики сустава [2, 5]. Патология возникает, прежде всего, в костной ткани, что приводит к ухудшению питания хрящевой ткани сустава и запуску механизма развития болезни. В дальнейшем в результате болевого синдрома и, как следствие, увеличивающейся гиподинамии развиваются патологические картины в прилежащих параоссальных тканях, в частности мышечной.
В развитии коксартроза существенную роль играет сосудистый фактор. Известно, что сосуды являются не только транспортно-питающей, но и центральной генерирующей структурой соединительной ткани, обеспечивающей физиологическую и репаративную регенерацию [6]. Стенка микрососуда содержит полипотентные мезенхимальные клетки, которые могут дифференцироваться в различных направлениях, в частности эндотелиоциты и перициты могут трансформироваться в адипоциты; мелкие капли жира, появляясь в перицитах, могут в итоге заблокировать кровеносные сосуды [7]. В представленном исследовании в случаях с врождённой патологией тазобедренных суставов, где тяжесть заболевания, безусловно, выше, в операционном материале околосуставных мышц были наиболее выражены гистологические признаки дегенерации сосудов: выбухающие в просвет адипоциты, заместившие эндотелиальные клетки. Именно изменения микро- и макрососудов, так называемая периваскулярная ниша, могут являться одним из пусковых механизмов, развивающихся артритов и артрозов [8]. Так, показано, что улучшение микроциркуляции в области тазобедренного сустава при лечении остеохондропатии методом симпактэктомии приводит к стабилизации сустава, исчезновению болевого синдрома, улучшению функционального состояния конечности [9].
Наблюдаемые контрактуры различной степени в мышечных волокнах возможно объяснить мышечными крампи (судорога, спазм) – термин, определяющий синдром внезапных непроизвольных болезненных сокращений отдельных мышц или их групп продолжительностью от нескольких секунд до нескольких минут [10, 11]. Распространенность крампи колеблется от 16 до 95 %, процент встречаемости синдрома выше в странах, где меньше людей занято физическим трудом. Крампи могут иметь место в любом возрасте, но чаще отмечаются у людей старше 65 лет [11]. У больных артрозом снижена физическая активность, повреждения мышц, вызванные спазмами, могут приводить к появлению узлов пересокращения-перерастяжения отдельных мышечных волокон или их групп, что было выявлено в настоящем исследовании.
После замены тазобедренного сустава у части пациентов наблюдаются атрофические изменения в мышцах. Предполагают, что статус локальной восприимчивости к воспалению мышц, оценённый во время операции, может быть полезным прогностическим показателем потенциала восстановления мышц и может послужить основой для индивидуального подхода к реабилитации после операции, что позволит создать оптимальные условия для лучшей регенерации мышечной ткани [12]. Считают, что ухудшение регенерации мышечной ткани из-за уменьшения числа миосателлитов приводит к замене волокон эктопическими тканями – жировой и фиброзной и, как следствие – к утрате функциональной активности мышц [13]. Мышечные фиброадипогенные клетки могут дифференцироваться в адипоциты у пациентов с частым травмированием или воспалением мышц [14]. В данном проведённом исследовании в подавляющем большинстве случаев наблюдались мышечные волокна в различных стадиях жирового перерождения и картины воспаления (мио- фагии). Так же для понимания механизма деформирующего остеоартрита необходимо установить морфологический фон синовиоцитов, их функцию в нормальных и патологических условиях [15].
Значительным фактором для инициирования и прогрессирования остеоартроза является изменение биомеханики суставных элементов. Иллюстрируется влияние биомеханики на патогенез и прогрессирование артрозов, а именно патологическая биореактивность мягких тканей и субхондральной кости [2, 3]. В представленной работе практически у всех пациентов отмечались: ограничение подвижности суставов, вынужденное положение конечности на фоне выраженных болевых ощущений, что могло являться одним из факторов развития гипотрофии ягодичных мышц, мышц бедра и голени. Консервативные или хирургические процедуры, которые активно изменяют биомеханику нижней конечности, снижая скорость прогрессирования остеоартроза, могут являться перспективными стратегиями лечения симптомов этого заболевания [2].
Выводы
Получены данные о морфологических особенностях мышечной ткани, прилежащей к тазобедренному суставу, а также суставных соединительнотканных капсул, касающиеся сферы патогенеза деформирующего коксартроза. Для мышц характерны картины миофагий, обратимых и необратимых контрактур, вызванные, возможно, крампи, жировой дегенерацией волокон, в том числе массовой, существенного фиброза интерстициального пространства, многочисленных геморрагий. Сосуды в перимизии извитые, фиброзированные, с суженными либо облитерированными просветами. Установлено, что важнейшую роль в патогенезе заболевания играет степень фиброза сосудов артериального звена мышц, более выраженная при врождённой патологии тазобедренного сустава.

