В последнее время все больший интерес для биокоординационной химии представляет синтез, физико-химические исследования и оценка биоактивности комплексов гетероциклических лигандов с солями «биогенных» металлов. Во многих случаях лиганды, находясь в составе комплексов, проявляют биоактивность, не свойственную лигандам в свободном состоянии. Например, потенциально биоактивный N,-N-содержащий лиганд – имидазол и его производные – в комплексе с биометаллами в силу синергетического эффекта может проявить ещё большую биоактивность, чем исходные компоненты, что в дальнейшем приведет к получению новых лекарственных препаратов широкого спектра действия.
К тому же имидазолы известны своей фармакоактивностью и представляет собой важный класс биоактивных соединений основных исходных реагентов для синтеза многих препаратов биомедицинского назначения и обладают антимикробными [1], антигрибковыми [2], антигельминтными [3, 4], а также противоопухолевыми [5] и противотуберкулезными [6] свойствами. Вместе с тем многие имидазолы обладают рядом побочных эффектов и являются крайне токсичными [7, 8].
Поэтому в последние годы ведется интенсивная работа по синтезу координационных соединений имидазола с солями «биогенных» металлов (Cu, Co, Zn и др.). Комплексообразование солей металлов позволяет снизить токсичность, повысить селективность и биодоступность координационных соединений.
Цель исследования: синтез и исследование физико-химических свойств и строения комплексных соединений имидазола с сульфатами кобальта и никеля.
Материалы и методы исследования
Изучение фазовых равновесий в системах неорганическая соль – имидазол – вода проводилось методом изотермической растворимости при 25 °С. Выбор данного метода продиктован следующими его преимуществами: в системах устанавливается устойчивое равновесие, метод позволяет наиболее полно исследовать процессы комплексообразования и изучать взаимодействие между компонентами без разделения на отдельные вещества, выявить тип растворимости образующихся соединений, установить точный молекулярный состав и концентрационные пределы их выделения. При выполнении исследований применялись соли металлов и имидазола марки «ч.д.а.». Азот имидазола определили по методу Кьельдаля, содержание ионов кобальта, никеля – трилонометрическим методом в присутствии индикатора мурексида.
Термогравиграммы соединений получали на Q-дериватографе системы Паулик-Паулик-Эрдей в статической воздушной атмосфере, скорость нагревания 10 град/мин, держатель образца керамический тигель без крышки, эталон – оксид алюминия.
ИК-спектры поглощения регистрировали на ИК-Фурье – спектрометре Frontier Perkin – Elmer (4000–350 см-1): образцы готовили в виде таблеток с KBr.
Фазовый состав комплексов изучали с помощью дифрактометра «ДРОН−3М (CuKα-излучение), 2θ = 2 град/мин.
Результаты исследования и их обсуждение
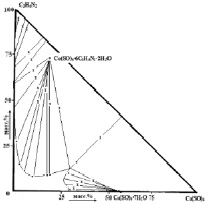
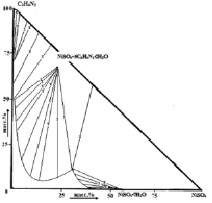
В результате взаимодействия имидазола и сульфата Со (II) и Ni (II) в трехкомпонентной воднонасыщенной среде при 25 °С были синтезированы соединения состава [Со(Im)6]SO4·(H2O)2 (I) и [Ni(Im)6]SO4·(H2O)2 (II), где Im–молекула имидазола (рис. 1, а, б). Их индивидуальность идентифицирована методами элементного, термического, рентгенофазового анализов и ИК-спектроскопией.
а) б)
Рис. 1. Диаграмма растворимости в системах: а) СоSO4−C3H4N2−H2O; б) NiSO4∙C3H4N2∙H2O при 25 °С
Оба комплекса конгруэнтнорастворимы в воде и выделены в кристаллическом виде.
Элементный состав соединений:
1. [Со(Im)6]SO4·(H2O)2
а) найдено: Сo = 8,9 %; C = 32,7 %; N = 25,1 %; H = 3,4 %;
б) вычислено: Сo = 9 %; C = 33 %; N = 25,7 %; H = 3,6 %;
2. [Ni(Im)6]SO4·(H2O)2
а) найдено: Ni = 9,67 %; C = 35,9 %; N = 27,7 %; H = 3,8 %;
б) вычислено: Ni = 9,77 %; C = 36 %; N = 28 %; H = 4 %.
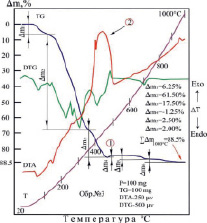
На термограмме комплекса [Со(Im)6]SO4·(H2O)2 интенсивно разлагается в интервале температур от 55 до 400 °С с одним эндоэффектом с максимумом при 249 °С и одним большим экзоэффектом с максимумом при 413 °С: последний термоэффект, по-видимому, соответствуют образованию оксидов, металлопродуктов разложения соединения (рис. 2, а).
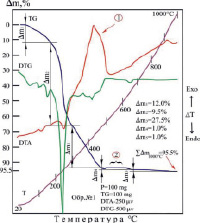
Термограмма комплекса [Ni(Im)6]SO4·(H2O)2 отличается сложным характером термической деструкции (рис. 2, б). Потеря массы происходит в две стадии, от 40 до 390 °С и от 400 до 680 °С, что проявляется в появлении эндо- и экзотермических эффектов. Процесс разложения полностью заканчивается при 680 °С. Главными стадиями процесса термического разложения комплекса Ni (II) является отщепление молекулы имидазола: кристаллизационная вода выделяется отдельно при 120 °С.
а) б)
Рис. 2. Термограммы комплексов: а) [Со(Im)6]SO4·(H2O)2; б) [Ni(Im)6]SO4·(H2O)2
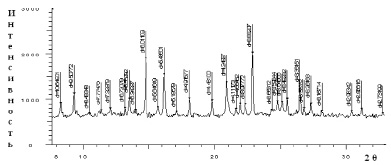
а)
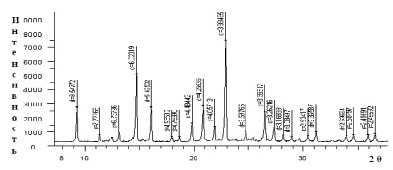
б)
Рис. 3. Дифрактограммы соединений: а) [Со(Im)6]SO4·2H2O; б) [Ni(Im)6]SO4·2H2O
На основе рентгенофазового анализа комплексов [Со(Im)6]SO4·(H2O)2, [Ni(Im)6]SO4·2H2O определены межплоскостные расстояния, относительные интенсивности дифракционных линий, пространственные группы и число формульных единиц (рис. 3, а, б).
Рассчитаны параметры элементарной ячейки кристаллов: для комплекса [Со(Im)6]SO4·(H2O)2 – a = 8,4025 Å; b = 9,1270 Å; с = 9,9231 Å; β = 105,791 °, пр.гр. = Р2/n1, Z = 2, а для комплекса [Ni(Im)6]SO4·(H2O)2– a = 9,6591 Å; b = 7,7666 Å; с = 6,8397Å; β = 100,118 °, пр.гр. = Р2/n1, Z = 2.
С целью определения строения координационного узла сульфатных комплексов использован метод ИК-спектроскопии.
При исследовании методом ИКС установлено, что в спектрах сульфатных металлокомплексов наблюдаются сдвиг в высокочастотную область колебательных поглощений валентных циклических С=N, C=C, C-N – связей на 10–35 и 20–35 и на 15 см-1, а также внеплоскостных колебаний имидазольного цикла на 15–20 см-1, что подтверждают координацию имидазола с металлами посредством пиридинового N-азота.
В комплексных соединениях Co (II) и Ni (II) состава 1:6:2 вода находится в виде кристаллогидратов, на что указывает присутствие в их спектрах полос поглощений кристаллизационной воды: νOH – при 3150 см-1, δHOH при 1750 см-1 и ρН2О при 540–510 см-1 (рис. 4, а, б).
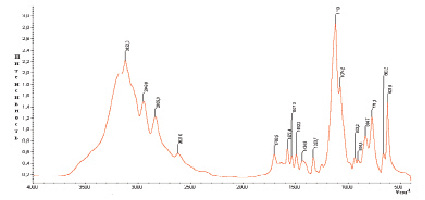
а)
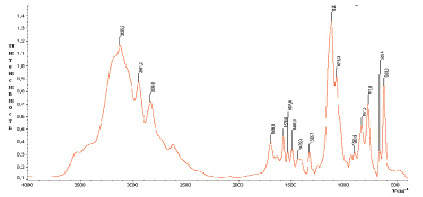
б)
Рис. 4. ИК-спектры поглощения комплексов: а) [Со(Im)6]SO4·(H2O)2; б) [Ni(Im)6]SO4·(H2O)2.
А также в ИК-спектрах комплексов найдены широкие полосы в области 1020–1145 см-1, обусловленные валентными, а при 545–622 см-1 деформационными колебаниями сульфатогруппы. Форма и характер этих полос поглощения дает возможность предполагать, что сульфат-ион в комплексах сохраняет свою ионную форму, находясь во внешней сфере комплексов.
Таким образом, на основании данных элементного термического рентгенофазового анализов, а также ИК-спектроскопией установлено, что в комплексах, состава 1:6:2 катионы.
Co (II), Ni (II) находятся в центре и координированы шестью атомами пиридинового азота от шести молекул имидазола, координационный полиэдр имеют октаэдрическую конфигурацию, а аква-, ацидо- лиганды расположены во внешней координационной сфере.
Выводы
Методом фазовых равновесий изучены взаимодействие сульфатов Co (II), Ni (II) c имидазолом в воднонасыщенной среде при 25 °С и найдены оптимальные условия выделения конгруэнтнорастворимых комплексов состава [Со(Im)6]SO4·(H2O)2(I) и [Ni(Im)6]SO4·(H2O)2(II).
Методами элементного, ДТА, РФА и ИК-спектроскопии установлены состав и строение полученных комплексов.
По данным порошковой рентгеновской дифракции определены кристаллические структуры комплексов (I) и (II). Полученные фазы соединений характеризуется моноклинной сингонией с параметрами элементарной ячейки, с пространственной группой – Р2/n1.
Термогравиметрическим методом установлено, что процесс термической деструкции является многостадийным и включает процесс дегидратация комплексов, термолизу катионной и анионной части с окислением металлов до окислов.
Изучением ИК-спектров показано, что комплексы являются молекулярными соединениями с донорно-акцепторной связью, образованными при участии sp2 гибридизированного атома азота гетерокольца, кристаллический тип – октаэдрический.

