Всемирная организация здравоохранения и международное медико-биологическое общество рекомендует использовать альтернативные методы и модели, такие как, например, применение перевиваемых клеточных культур, взамен общепринятых тестов на лабораторных животных [1]. Это связано прежде всего с вопросами этического, экономического и разумного использования лабораторных животных в исследовательских целях, а также потому, что эксперименты с использованием животных трудоемки, длительны и не всегда воспроизводимы. При изучении оценки потенциально токсичных биополимеров важную роль отводят коллекционным клеткам-мишеням. С 1999 г. в нашей стране действует Государственный стандарт Российской Федерации ГОСТ Р ИСО 10993.5-99, один из разделов которого (часть 5 «Исследования на цитотоксичность: методы in vitro») посвящен чрезвычайно важным вопросам, в частности апробации в эксперименте компонентов потенциальных химических вакцин, обязательно проверяемых на наличие в их составе биополимеров, повреждающих клетки тканей макроорганизма [2–4].
Использование стандартных клеточных линий с известными свойствами обеспечивает возможность их применения для качественной и количественной оценки в относительно короткий промежуток времени, а также возможность прижизненного наблюдения и оценки результатов взаимодействия компонентов сложных комплексов с клетками-мишенями по изменению морфофункциональных параметров клеток под действием потенциально токсических биополимеров. В связи с вышеизложенным, коллектив авторов посчитал целесообразным определить воспроизводимую и чувствительную клеточную модель для изучения патогенности возбудителя мелиоидоза взамен общепринятых тестов на лабораторных животных [5, 6].
Цель исследования: установить эффективную клеточную модель для оценки цитотоксичности антигенов возбудителя мелиоидоза.
Материалы и методы исследования
Для достижения поставленной цели были использованы перевиваемые клеточные линии животного и человеческого происхождения, полученные из Российской коллекции клеточных культур позвоночных института цитологии РАН (г. С.-Петербург): CHO-K1 – овариальные клетки китайского хомячка, клон линии СНО, L929 – клетки подкожной соединительной ткани мыши С3Н/Аn, Hela S3 – клетки эпителиоидной карциномы шейки матки человека, сублинии Hela.
Культуры клеток постоянно сохраняли в криоконсервированном состоянии в биохранилище с жидким азотом при –196 °С. После вывода клеточной линии из криоконсервированного состояния жизнеспособность клеток составила не менее 96 %.
Клеточные линии культивировали в полусинтетической питательной среде DMEM (ГУП по производству бактерийных и вирусных препаратов института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН, Россия). Для тиражирования популяции клеток готовили полную среду: основная среда DMEM с 10 % эмбриональной телячьей сыворотки (ф. HyClon, Германия), 2 mM L-глутамина, 4 mM пирувата натрия, комплекса аминокислот, HEPES 5 mM, c pH 7,1–7,2 среды. Для снятия клеточных линий с поверхности пластика применяли стандартные растворы 0,25 %-ный р-р трипсина и 0,02 %-ный р-р версена (вышеназванного производителя) в соотношении 1:2. Пересев монослойных клеточных линий CHO-K1, L929 осуществляли 2 раза в неделю. Во избежание контаминации все процедуры проводили в стерильных условиях.
Культивирование популяции осуществляли в пластиковой посуде фирмы Costar (Multiple well plates) в СО2-инкубаторе при температуре +37 °С, в атмосфере 5–7 % СО2 и 70 % влажности. В 24-л пластины с площадью лунок 1,9 см2 высевали перевиваемые клеточные линии животного происхождения (CHO-K1, L929) в концентрации 1,6×105 клеток в каждую лунку в объеме 0,5 мл среды. Посевная концентрация была выбрана с целью формирования сплошного монослоя, во избежание ошибочной интерпретации результатов при воздействия токсического эффекта биополимеров на клетки-мишени. Для культуры клеток HeLa S3 использовали 48-луночные пластины, концентрация клеток в каждую лунку составила 0,5∙105 клеток в объеме 0,25 мл среды.
Для сравнительной характеристики перевиваемых клеточных линий различного происхождения в тесте микроцитотоксичности были использованы восемь образцов водорастворимых антигенов, приготовленных из ультразвуковых дезинтегратов различных штаммов возбудителя мелиоидоза из обеззараженных ацетоном клеток возбудителя микроорганизма II группы патогенности возбудителя мелиоидоза (B. pseudomallei, штаммы 57576, 56770, 51274, 59361, 110, 100, 60913, 56738). Антигенные препараты отличаются друг от друга по углеводному и белковому составу, а также по LD50 для лабораторных животных.
В опытные лунки с культурами клеток L929, CHO-K1 и HeLa S3 через сутки, добавляли образцы ВСЭ B. pseudomallei штаммы 57576, 56770, 51274, 59361, 110, 100, 60913, 56738 в дозировке 40 мкл в каждую лунку, что соответствовало по полисахаридной нагрузке 0,3 мг (день внесения антигенов в лунки считали 0). В качестве контроля на каждой пластине присутствовали лунки с интактной культурой. Срок наблюдения составлял трое суток. В течение всего срока эксперимента ежедневно производили качественную и количественную оценку результатов, оценивая морфологию и функциональное состояние индикаторных культур. Количественную оценку и жизнеспособность клеток-мишеней оценивали с помощью теста прижизненной окраски трипановым синим (0,4 %). В соответствии с ГОСТ Р ИСО 10993.5–99 все серии экспериментов проводили с шестью повторами для каждой серии опыта [1].
Результаты исследования и их обсуждение
Период адаптации индикаторных культур к подобранным условиям культивирования после выведения из криоконсервированного состояния составил две недели. Клетки-мишени восстанавливали пролиферативную активность на уровне паспортных данных, что позволило проводить масштабирование популяций в объемах, необходимых для выполнения дальнейших экспериментов. Установлено, что монослой клеточных линий формировался через сутки после высева клеток в пластину для культивирования.
Скрининг ВСЭ антигенов возбудителя мелиоидоза показал, что образцы ВСЭ B. pseudomallei штаммов 100, 57576, 51274, 59361 оказали максимально выраженный цитотоксический эффект при контакте с индикаторными культурами CHO-K1и L929, в то время как ВСЭ B. pseudomallei штаммов 56770, 110, 56738, 60913 проявили различную степень цитотоксичности и цитопатогенности в отношении монослойных клеточных линий. Выраженной токсичностью обладали образцы антигенов B. pseudomallei штаммов 100, 57576, 51274, 59361 в отношении клеточных линий CHO-K1и L929, ниже приведены графические изображения относительных показателей числа жизнеспособных клеток в монослое клеточных культур при контакте с антигеном B. pseudomallei 57576 в течение всего срока эксперимента (рис. 1, 2). Через сутки у клеток отмечали изменения цитоплазмы в виде вакуолизации, зернистости, изменения ядра в форме лизиса, изменения формы клетки в виде набухания, округления, утончения или полного разрушения клетки, выявляемые при 100х увеличении.
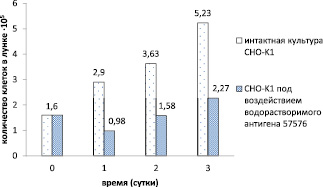
Рис. 1. Относительные показатели числа жизнеспособных клеток в монослое клеточной культуры CHO-K1 при контакте с водорастворимым антигеном B. pseudomallei 57576 в течение всего срока эксперимента
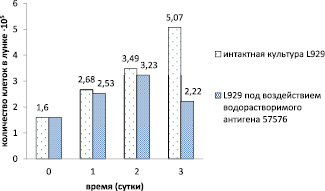
Рис. 2. Относительные показатели числа жизнеспособных клеток в монослое клеточной культуры L929 при контакте с водорастворимым антигеном B. pseudomallei 57576 в течение всего срока эксперимента
Рис. 3. Относительные показатели числа жизнеспособных клеток эпителиоидной карциномы шейки матки человека HeLa S3 с водорастворимым антигеном B. pseudomallei 57576 в течение всего срока эксперимента
Множественный скрининг антигенов возбудителя мелиоидоза в тесте микроцитотоксичности на перевиваемой клеточной линии HeLa S3 показал, что водорастворимые антигены B. pseudomallei 100, 57576, 51274, 59361 обладали пролонгированным цитопатогенным эффектом, результаты регистрировали через трое суток контакта клеток-мишеней с этими антигенами. В качестве примера ниже приведены относительные показатели числа жизнеспособных клеток эпителиоидной карциномы шейки матки человека HeLa S3 с антигеном B. pseudomallei 57576 в течение всего срока эксперимента (рис. 3). В то же время каких-либо изменений в индикаторной культуре в присутствии водорастворимых антигенов B. pseudomallei 56770, 110, 60913, 56738 не было выявлено.
Заключение
Таким образом, установлено, что чувствительность трех апробированных клеточных линий в отношении восьми вариантов антигенов B. pseudomallei колебалась в диапазоне от резко выраженного токсического воздействия до минимальных цитопатогенных изменений, проявляющихся в виде морфологических изменений на клетках-мишенях.
Использование клеточной линии эпителиоидной карциномы шейки матки человека HeLa S3 в качестве индикаторной культуры в тесте микроцитотоксичности возможно при изучении цитотоксических и цитопатогенных свойств возбудителя мелиоидоза в первые сутки эксперимента, это связано прежде всего с высокими темпами пролиферации клеток культуры сублинии HeLa.
Сравнительное исследование эффектов цитотоксичности и цитопатогенности в отношении индикаторных линий свидетельствовало о том, что клетки линии CHO-K1 обладали относительно высокой чувствительностью в отношении антигенов возбудителя мелиоидоза, что делает ее эффективной клеточной моделью для оценки цитотоксичности антигенных комплексов возбудителя мелиоидоза.

