Глиальные опухоли представляют собой важную проблему в современной нейроонкологии. Данный вопрос актуален не только в практической плоскости – эффективных средств таргетной терапии как для диффузных, так и для отграниченных глиальных опухолей не разработано, но и в фундаментальной – вопросы патогенеза различных видов глиом остаются не до конца изученными. Конечно, логично предположить, что между двумя этими посылами существует непосредственная взаимосвязь – пробелы в понимании фундаментальных механизмов канцерогенеза определяют неполноценность теоретической базы для создания эффективных, высокотехнологичных средств терапии. Именно поэтому дальнейшее, более глубокое изучение ключевых принципов канцерогенеза является важнейшей задачей, имеющей как фундаментальное, так и прикладное значение.
Большую часть глиом согласно классификации опухолей центральной нервной системы (ЦНС) Всемирной организации здравоохранения (ВОЗ) 2016 г. можно разделить на две условные группы, одна из них включает в себя диффузные глиальные опухоли, другая составлена из опухолей с относительно отграниченным ростом [1]. Среди диффузных глиом наименьшим злокачественным потенциалом обладают диффузные астроцитомы, Grade II по классификации ВОЗ, несущие в себе мутацию генов IDH1 или IDH2. Данные мутации являются важнейшим генетическим событием в патогенезе глиом, определяющим ряд молекулярно-биологических изменений в диффузных астроцитомах и имеющим непосредственное влияние на прогноз: пациенты с диффузными астроцитомами с мутацией в генах IDH1 или IDH2 отличаются лучшим прогнозом по сравнению с пациентами с диффузными астроцитомами без мутаций данных генов [2–4]. При этом мутация в гене IDH1 встречается в подавляющем большинстве случаев [2, 3].
Самыми распространенными среди отграниченных глиальных опухолей ЦНС являются пилоидные астроцитомы. Данные опухоли возникают преимущественно у детей и молодых взрослых [5]. Гистологически они характеризуются преимущественно отграниченным от окружающей мозговой ткани ростом. При этом основным драйверным событием в канцерогенезе данных опухолей является активация сигнального каскада рецепторов тирозинкиназы, мишенью мутационных изменений при этом наиболее часто является белок BRAF [6]. Данные опухоли относительно доброкачественные, им присвоен Grade I по ВОЗ, тем не менее они могут рецидивировать и подвергаться малигнизации [6].
Целый ряд вопросов, связанных с патогенезом как диффузных, так и отграниченных глиальных опухолей остается неизученным. В частности, важным представляется характеристика не только драйверных событий канцерогенеза, но и других звеньев патогенеза, обеспечивающих рост и прогрессирование опухоли. Большую роль в этом вопросе играют эффекторные белки, такие как протеинкиназы. Среди всех представителей данного класса белков серьезный интерес представляют особые формы протеинкиназ – так называемые атипические изоформы протеинкиназы С.
Протеинкиназы класса C (ПК C) играют важнейшую роль в реализации целого ряда клеточных функций, связанных с пластическим обменом, энергетическим метаболизмом, пролиферацией клеток и регуляцией клеточного цикла. Все ферменты класса протеинкиназ C делятся на несколько семейств, отличающихся своими биохимическими и молекулярно-биологическими свойствами. Это традиционные или классические протеинкиназы, новые или нестандартные протеинкиназы и атипические изоформы протеинкиназы C. Традиционные протеинкиназы С взаимодействуют с Ca2+, диацилглицеролом или фосфатидилхолином для своей активации. Новые протеинкиназы С активируются молекулами диацилглицерола и не требуют Ca2+. Атипические изоформы протеинкиназы C не требуют для своей активации ни Ca2+, ни диацилглицерола. К членам данного семейства относятся такие протеинкиназы, как протеинкиназа С ζ (ПКС ζ), протеинкиназа Mζ (ПК Mζ) и протеинкиназы С iota (ПК Ci) и протеинкиназа C λ [7].
Данные ферменты обладают необычными свойствами, в частности более высокой, чем у других представителей их класса, каталитической активностью [7]. Поскольку атипические изоформы протеинкиназы C не требуют для своей активации никаких дополнительных кофакторов, они, в отличие от большинства других протеинкиназ, могут выступать не только в качестве вторичных посредников в реализации различных функций, но и в роли независимых и самостоятельных регуляторов этих функций, в том числе метаболических и пролиферативных процессов [7].
Наиболее уникальными свойствами среди всех представителей данного класса белков обладает ПК Mζ, которая является автономно активирующимся фрагментом ПКС ζ, имеющим самостоятельное значение. ПК Mζ не содержит регулирующего аутоингибиторного домена [8], поэтому после своего синтеза она остается активной до тех пор, пока не подвергнется процессу деградации. Активация клетки, требующая её длительных пластических перестроек, приводит к освобождению мРНК ПК Mζ от трансляционного блока посредством активации вторичных посредников. Последующее фосфорилирование ПК Mζ PDK1 ферментом затем превращает её в конформацию с высокой конститутивной активностью [9]. Таким образом, трансляция мРНК ПК Mζ приводит к синтезу белка, идентичного каталитической части молекулы ПКС ζ, но с отсутствием каких-либо регуляторных доменов. Поэтому, будучи синтезированной, ПК Mζ является конститутивно активной, не требуя повторного связывания с какими-либо посредниками. Считается, что эта постоянная активность позволяет ПК Mζ играть ключевую роль в поддержании длительно существующих пластических перестроек в клетках головного мозга [10, 11].
Целью данного исследования явилось проведение сравнительного анализа наличия и активности экспрессии ПК Mζ в наиболее близких с гистогенетической точки зрения видах глиальных опухолей, представляющих разные опухолевые классы: диффузных астроцитомах с мутацией в гене IDH1, имеющих диффузный характер роста, и пилоидных астроцитомах, растущих преимущественно отграниченно в окружающей мозговой ткани.
Материалы и методы исследования
Группы исследования и их характеристика
В ретроспективном, слепом, рандомизированном исследовании были изучены 30 образцов опухолей от пациентов с установленным диагнозом диффузной астроцитомы с мутацией в гене IDH1 (Grade II по ВОЗ) (ДА), а также 30 образцов опухолей пациентов с установленным диагнозом пилоидной астроцитомы (Grade I по ВОЗ) (ПА), проходивших хирургическое лечение в ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко в 2018 г. Определение мутационного статуса гена IDH1 проводилось с помощью прямого секвенирования по методу Сенгера.
Проведение иммуногистохимического исследования
Из парафиновых блоков с фиксированными в них образцами опухолей изготавливали срезы толщиной 3 мкм, депарафинировали с использованием ксилола и повторно гидратировали с помощью различных концентраций этанола, срезы высушивали в термостате при 45 °C. Затем срезы последовательно инкубировали с кроличьими моноклональными антителами против антигена ПК Mζ человека (Abcam, Великобритания) и после этого конъюгировали с антикроличьими мышиными IgG антителом против пероксидазы хрена (Cell Marque, «Sigma-Aldrich», США). Сайты связывания антител визуализировали с использованием тетрагидрохлорида 3,3’-диаминобензидина («Ventana Medical Systems», США), ядра клеток окрашивали гематоксилином.
Обработка результатов иммуногистохимического исследования
Образцы изучались под световым микроскопом на увеличении ×400 тремя опытными патологами, не знакомыми с исходными данными пациентов. Активность экспрессии ПК Mζ подсчитывали количественным методом, определяя процент клеток, экспрессирующих данный маркер (ПКЭ Mζ), а также полуколичественным методом histoscore. При подсчете ПКЭ Mζ три опытных патолога высчитывали соотношение клеток с наличием экспрессии ПК Mζ и общего числа клеток, выраженное в процентах. Результаты подсчета усредняли.
Для определения histoscore ПК Mζ процент клеток со слабоположительным окрашиванием (низкая интенсивность экспрессии) умножался на один, процент клеток с умеренно положительным окрашиванием (средняя интенсивность экспрессии) умножался на два и, наконец, процент клеток с сильно положительным окрашиванием (высокая интенсивность экспрессии) умножался на три, после чего результат суммировался [12]. При этом для оценки степени выраженности экспрессии маркеров применялось колориметрическое исследование с помощью эталонной модели CIE XYZ. Для этого с помощью микроскопа Carl Zeiss Scope.A1, камеры Axiocam 105 color (Zeiss AG, Германия) и программ для формирования и анализа изображений ZEN 2 (Zeiss AG, Германия), ImageJ (NIH, США) и Adobe Photoshop (Adobe Systems, США) определялись суммарные средние значения по красной кривой (X), зеленой кривой (Y) и синей кривой (Z). После этого, программным способом вычислялись средние колориметрические показатели (СКП) для каждой метки в отдельности. В случае, если СКП составлял 170 и более, интенсивность экспрессии считалась низкой, при значении СКП 85 и более средней и при показателе СКП менее 85 активность экспрессии считалась высокой. Данные, полученные при подсчете тремя патологами, усреднялись.
Статистическая обработка результатов исследования
Статистическая обработка проводилась с помощью программного обеспечения Statistica 10 (StatSoft, США). Для определения достоверности различий показателей активности экспрессии ПК Mζ в двух группах применялся U-критерий Манна – Уитни. Различия считали достоверными при значении p < 0,05.
Результаты исследования и их обсуждение
Характеристика групп исследования
Средний возраст пациентов в ДА группе на момент операции составлял 38,15 ± 3,12 года, при этом мужчины составили 60 % исследуемых (n = 18), женщины 40 % (n = 12). Также в группе ПА средний возраст на момент операции составлял 16,87 ± 2,14 года. Мужчины в данной группе составляли 53,33 % (n = 16), женщины 46,67 % (n = 14).
Определение процента клеток с положительной экспрессией ПК Mζ
При определении процента клеток с положительной экспрессией ПК Mζ было выявлено, что ПКЭ Mζ в ДА группе составляет в среднем 40.84 ± 0.64 %. В то же время в группе ПА средний показатель ПКЭ Mζ был меньше и составил 29,35 ± 0,76 % (рис. 1). При этом выявленные различия носили статистически достоверный характер (p < 0,0001, z = 6,43).
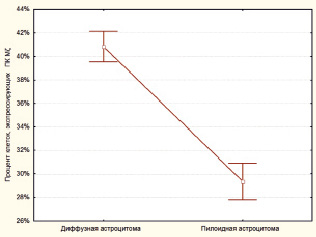
Рис. 1. Значения процента клеток, экспрессирующих ПК Mζ в диффузных и пилоидных астроцитомах. Уровень экспрессии данного маркера статистически достоверно выше в диффузных астроцитомах (p < 0,0001, z = 6,43)
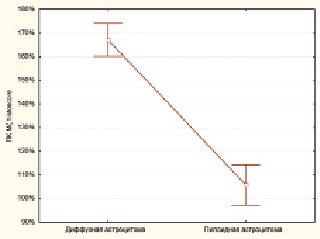
Рис. 2. Значения histiscore ПК Mζ в диффузных и пилоидных астроцитомах. Степень активности экспрессии ПК Mζ в диффузных астроцитомах выше, чем в пилоидных астроцитомах (p < 0,0001, z = 6,56)
Выявление различий в histiscore ПК Mζ в диффузных и пилоидных астроцитомах
В группе ДА среднее значение histiscore ПК Mζ составило 167,12 ± 3,4 %. Средний показатель histiscore ПК Mζ в группе ПА был меньше и составил 105,7 ± 4,19 % (рис. 2). Указанные различия носили статистически достоверный характер (p < 0,0001, z = 6,56).
Роль ПК Mζ в развитии опухолевых заболеваний изучена крайне мало. В одном из немногих исследований было выявлено участие ПК Mζ-подобной формы в развитии острого лимфобластного лейкоза [11]. Необходимо отметить, что в данном случае ПК Mζ синтезируется как результат редкой мутации и встречается крайне нечасто и только в патологических условиях, несколько отличаясь своим молекулярным строением и свойствами.
Что касается опухолей головного мозга, то исследований роли ПК Mζ в развитии опухолей данной локализации не проводилось. Тем не менее было обнаружено, что ПК Mζ вовлекается в процессы пролиферации нейронов при нейрогенезе и может быть вовлечен в пролиферативные каскады в клетках астроцитарной глии. Это подчеркивает возможную ключевую эффекторную роль ПК Mζ в поддержании стволовых свойств клеток, что немаловажно в вопросах канцерогенеза.
В рамках данного исследования нам впервые удалось показать наличие экспрессии ПК Mζ как в астроцитомах с отграниченным характером роста на примере пилоидных астроцитом, так и в астроцитомах с диффузным ростом на примере диффузных астроцитом с наличием мутации в гене IDH1. При этом сравнительный анализ позволил выявить статистически значимые различия в активности экспрессии между ДА и ПА: экспрессия ПК Mζ была более активной в ДА, нежели в ПА. Интересно заметить, что данные различия наблюдались не только в количественном аспекте – обнаружено различие процента клеток, экспрессирующего ПК Mζ, но и в полуколичественном – в исследуемых группах различались также показатели histoscore.
В целом можно отметить, что ПК Mζ экспрессируется достаточно активно и в ПА, и в ДА, поэтому данный молекулярный фактор может играть существенную роль в развитии обоих онкологических процессов. Тем не менее, по-видимому, именно в патогенезе диффузных глиом в целом и ДА в частности ПК Mζ играет наибольшую роль. Однако участие ПК Mζ в канцерогенезе как диффузных, так и отграниченных глиальных опухолей требует дополнительного изучения.
Полученные результаты свидетельствуют о существенной роли факторов, играющих роль эффекторов, но в данном случае важно отметить, что ПК Mζ является специ- фическим эффектором, характерным исключительно для мозговой ткани. Именно поэтому фактически ПК Mζ представляет собой специфический фактор канцерогенеза глиальных опухолей. То есть роль данной протеинкиназы сходна с ролью мутаций в генах IDH1 и IDH2, только проявление этой роли происходит не на генетическом, а непосредственно на протеомическом, функциональном уровне. В этом аспекте ПК Mζ представляет огромный интерес не только с точки зрения понимания фундаментальных механизмов канцерогенеза глиальных опухолей, но и в отношении практического применения как диагностического маркера и потенциальной мишени для таргетной терапии.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01034 мк.

