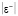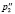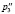В последнее время в различных биохимических и других исследованиях всё чаще стали использоваться топологические представления.
Главным образом это химические графы. Описание молекулы в этом случае не учитывает длин связей и валентные углы, а только расположение атомов, характер их связывания.
Цель исследования: установление взаимосвязи между энтальпией образования и строением алкилсиланов и их хлорпроизводных.
Для этого в работе проведены: отбор численных данных по энтальпии образования алкилсиланов и их производных; подбор топологических индексов и построение расчётных схем; проведение численных расчетов; построение и анализ графических зависимостей.
По теме исследования есть литература обзорного и/или справочного характера [1–3], учебники [4–6], учебные пособия [7, 8], статьи [9, 10] и др.
В топологическом подходе, при рассмотрении молекул, атомы записываются в виде точек (вершин), а связи – в виде отрезков – молекулярный граф (МГ). Атомы водорода не учитываются [8].
Гетероатомы привносят свои нюансы при описании органических молекул. Графы таких молекул имеют разнотипные вершины и связи (рис. 1).

а) б)
Рис. 1. Триметилсилан: а) молекула, б) химический граф
В топологическом подходе используются матрица смежности и матрица расстояний [8].
А = [aij] – матрица смежности, где элементы aij имеют только два значения – единица (если атомы непосредственно связаны между собой) и ноль, когда такой связи нет [8].
D = [dij] – матрица расстояний, где элементы dij – число связей между атомами i и j [8].
Матрицы расстояний гетеросистем рассматривают с учётом заряда ядра атома и кратности связи [5].
Так, для триметилсилана матрица расстояний запишется как

Существует много топологических индексов. В работе рассматриваются некоторые из них [8, 9]:
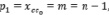 (1)
(1)
где (n) число атомов углерода и гетероатомов, (m) число связей.
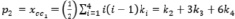 , (2)
, (2)
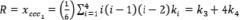 , (3)
, (3)
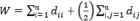 , (4)
, (4)
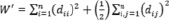 , (5)
, (5)
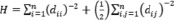 , (6)
, (6)
и т.д.
Топологические индексы могут применяться в построении аддитивных схем расчета и прогнозирования. Для алкилсиланов в третьем приближении получаем
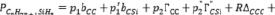
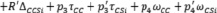 . (7)
. (7)
Для Х-замещённых алкилсиланов во втором приближении схема (7) примет вид
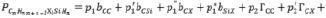
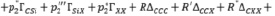
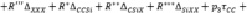
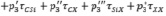 (8)
(8)
и т.д.
При изучении корреляционных зависимостей вида Р = f(ТИ), обычно используются следующие зависимости [8]:
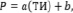 (9)
(9)
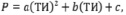 (10)
(10)
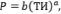 (11)
(11)
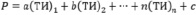 (12)
(12)
и т.п.
Здесь а, b, с – некоторые параметры подлежащие определению [8].
Неизвестные параметры в теоретико-графовом подходе находятся через экспериментальные данные. В этом случае составляется рабочее уравнение для каждого соединения данного гомологического ряда с известными экспериментальными значениями исследуемого свойства. В итоге получаем систему линейных алгебраических уравнений Ax = b. Для решения данной системы используется метод наименьших квадратов (МНК), а для оценки результатов расчёта – средняя абсолютная ошибка расчета (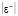 ), максимальное отклонение (emax) и др. [8].
), максимальное отклонение (emax) и др. [8].
Графические зависимости вида «Свойство – ТИ» и др., используемые в теоретико-графовом подходе, показывают нам, как индекс взаимодействуют со свойством. Это позволяет выбрать необходимый топологический индекс для аналитического исследования взаимосвязи между структурой и свойством вещества [8; 10].
Из приведённых выше зависимостей (9)–(12) наибольшей взаимосвязью между энтальпией образования (в кДж/моль) алкилсиланов и индексами (1)–(6) обладает уравнение

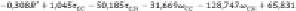 . (13)
. (13)
Среднее квадратическое и максимальное отклонения соответственно имеют значения 3,9 кДж/моль и 14,4 кДж/моль.
Рассчитанные величины по уравнению (13) хорошо согласуются с экспериментальными данными.
В табл. 1 показан расчет энтальпий образования хлорзамещённых алкилсиланов.
Некоторые параметры
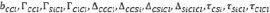
из схемы (8) из-за отсутствия ряда экспериментальных данных были пропущены или заменены на параметры:
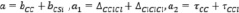 .
.
Таблица 1
Значения параметров и результаты расчета энтальпий образования хлорзамещённых алкилсиланов (кДж/моль) в разных приближениях
|
Параметр |
Значения параметров оценки DfН0 (г, 298 К) |
|||
|
2 |
3 |
5 |
6 |
|
|
а |
–77,845 |
–105,962 |
–148,362 |
–151,022 |
|
bSiCl |
–83,790 |
–70,512 |
100,538 |
96,953 |
|
ГCSi |
80,056 |
135,662 |
153,122 |
|
|
DCCC |
270,287 |
272,716 |
||
|
а1 |
–92,263 |
–88,909 |
||
|
а2 |
–5,550 |
|||
|
|
71,0 |
61,2 |
2,1 |
1,5 |
|
εmax |
137,8 |
108,2 |
±3,6 |
±2,7 |
В табл. 1 показано, как по мере учёта валентных и невалентных взаимодействий атомов согласие между полученными и экспериментальными значениями DfН0 (г, 298 К) улучшается.
Так как рассчитанные величины согласуются с экспериментом, то мы можем вычислить энтальпии образования для остальных членов исследуемого гомологического ряда.
В табл. 2 и 3 даны некоторые ТИ, необходимые для построения уравнений (7)–(13) и графических зависимостей.
Таблица 2
Топологические индексы ряда алкилсиланов
|
Молекула |
R |
R' |
p3 |
p'3 |
p4 |
p'4 |
H |
W |
W' |
|
CH3SiН3 |
0 |
0 |
0 |
0 |
0 |
0 |
8,501 |
1,000 |
0,510 |
|
CH3CH2SiH3 |
0 |
0 |
0 |
0 |
0 |
0 |
9,991 |
3,429 |
3,552 |
|
CH3SiH2CH3 |
0 |
0 |
0 |
0 |
0 |
0 |
15,293 |
2,287 |
1,430 |
|
CH3CH2SiН2CH3 |
0 |
0 |
1 |
0 |
0 |
0 |
17,073 |
6,574 |
7,924 |
|
(CH3)2CHSiН3 |
0 |
1 |
0 |
0 |
0 |
0 |
11,731 |
7,858 |
10,594 |
|
(CH3)3SiН |
1 |
0 |
0 |
0 |
0 |
0 |
23,443 |
4,432 |
3,086 |
|
CH3CH2CH2CH2SiН3 |
0 |
0 |
1 |
1 |
0 |
1 |
12,856 |
18,287 |
40,210 |
|
CH3CH2CH2SiН2CH3 |
1 |
0 |
1 |
1 |
1 |
0 |
18,614 |
14,861 |
26,992 |
|
CH3CH2SiН2CH2CH3 |
0 |
0 |
2 |
0 |
1 |
0 |
18,975 |
13,719 |
22,586 |
|
(CH3)2SiНCH2CH3 |
1 |
0 |
2 |
0 |
0 |
0 |
25,513 |
10,577 |
13,032 |
|
(CH3)4Si |
4 |
0 |
0 |
0 |
0 |
0 |
32,951 |
7,435 |
5,478 |
|
(CH3CH2)2SiНCH3 |
1 |
0 |
4 |
0 |
1 |
0 |
27,705 |
19,580 |
31,146 |
|
(CH3CH2CH2)2Si(CH3)2 |
4 |
0 |
6 |
2 |
7 |
0 |
41,539 |
66,879 |
164,618 |
|
(CH3CH2)4Si |
4 |
0 |
12 |
0 |
6 |
0 |
43,123 |
56,595 |
108,078 |
Таблица 3
Топологические индексы ряда хлорзамещённых алкилсиланов
|
Молекула |
|
R |
R' " |
p3 |
|
W |
W' |
H |
|
CH3SiCl3 |
0 |
0 |
1 |
0 |
0 |
6,04 |
3,12 |
189,05 |
|
(CH3)2SiCl2 |
0 |
0 |
0 |
0 |
0 |
6,51 |
3,75 |
130,64 |
|
(CH3)3SiCl |
0 |
1 |
0 |
0 |
0 |
6,97 |
4,54 |
78,61 |
|
CH3CH2(CH3)SiHCl |
1 |
0 |
0 |
1 |
1 |
10,11 |
11,54 |
69,67 |
|
(CH3CH2)2SiHCl |
2 |
0 |
0 |
2 |
2 |
18,84 |
28,69 |
71,97 |
|
CH3CH2SiCl2(CH3) |
1 |
0 |
0 |
1 |
2 |
13,95 |
15,24 |
133,22 |
|
CH3CH2(CH3)2SiCl |
1 |
1 |
0 |
2 |
1 |
14,70 |
16,98 |
66,25 |
Рассмотрим диаграммы «энтальпия образования – топологический индекс», «энтальпия образования – номер изомера» и «Топологический индекс – номер изомера» для алкилсиланов и их хлорпроизводных.
На рис. 2 приведены диаграммы «Энтальпия образования – ТИ» для хлорзамещённых алкилсиланов. Видно, что лучше всего DfH0298(г) соответствуют индексы Винера и W' [8, 9].
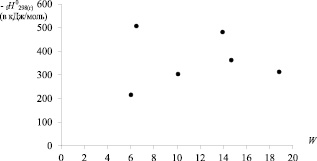
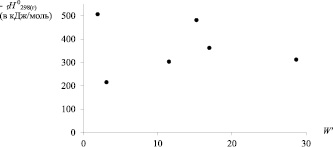
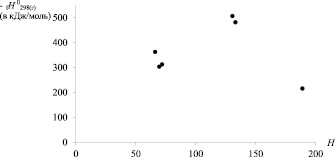
Рис. 2. Зависимости энтальпии образования хлорпроизводных алкилсиланов (С1 до С4) от числа Винера (W); индекса W’ и числа Харари (Н)
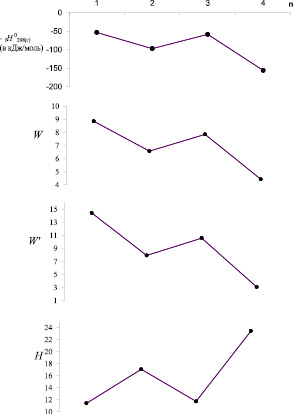
Рис. 3. Ход изменения энтальпии образования и ряда ТИ изомеров SiC3H10 при переходе от одного изомера к другому (1 – н-SiН3C3H7; 2 – SiН2(СН3)C2H5; 3 – SiН3(изо-C3H7); 4 – SiН(СН3)3)
На рис. 3 показаны зависимости вида «Энтальпия образования – номер изомера» и «ТИ – номер изомера» для SiC3H10. Из диаграммы видно, что симбатное изменение энтальпии образования и индексов W, W' говорит об их хорошей корреляции со свойством [8, 9].
Выводы
В работе показана возможность использования топологического подхода для описания энтальпии образования алкилсиланов и их хлорпроизводных, а также использования топологических индексов в построении аддитивных схем расчёта.
В работе проведено расчётно-теоретическое исследование, получена новая числовая информация согласующееся с экспериментом.
Построены и проанализированы графические зависимости энтальпии образования алкилсиланов и их хлорпроизводных от структуры молекулы.
Показано, что симбатное изменение энтальпии образования и индексов W, W' говорит о том, что между Р и ТИ имеется тесная взаимосвязь. А в случае с индексом Н и DfH0298(г) взаимосвязи нет. С повышением числа изомеров взаимосвязь между энтальпией образования и ТИ усложняется, поэтому это нужно учитывать при математическом рассмотрении зависимостей «Свойство вещества Р – ТИ графа молекулы».