Среди важнейших задач современного акушерства все еще остается очень актуальным поиск возможных причин и диагностических маркеров невынашивания беременности. Огромная значимость проблемы невынашивания беременности заключается в высоком уровне частоты встречаемости внутриутробной гибели плода и/или аномалии развития и, к сожалению, отсутствия снижения данной патологии [1].
Важную и неоспоримую значимость имеет выявление носительства полиморфных и мутационных вариантов генов, а профилактика и своевременная коррекция патологических проявлений мутантных генов обеспечивает нормальное течение беременности. Кроме того при оценке рисков по данным зарубежных авторов огромное значение имеет не только анализ влияния отдельных аллелей полиморфных генов, но и необходимо детально подходить к изучению их комбинаций, так как именно комбинация в свою очередь формирует генетическую предрасположенность организма женщины к невынашиванию беременности [2].
Научная литература последних лет накопила опыт многочисленных исследований и данных клинических исследований, позволяющих выделить дефицит фолиевой кислоты, повышенный уровень гомоцистеина и полиморфизмы аллелей генов фолатного цикла, отдельной группой причин, которые потенцируют развитие разнообразной акушерской патологии. Именно поэтому остаются интересными научные исследования, посвященные выявлению носительства полиморфных вариантов генов, у женщин с неблагоприятным исходом беременности [3].
Мультифакторные заболевания отличаются тем, что одномоментно воздействие на организм происходит группой патологических и нормальных аллелей генов и вмешательство неблагоприятных условий окружающей среды, что и приводит к развитию различной патологии. Поэтому такие гены и были названы генами «предрасположенности». Однако до настоящего времени все еще изучение и анализ мультифакторных заболеваний с позиции рассмотрения влияния полиморфизма генов на возникающую патологию остается трудной задачей [4].
При этом в литературных данных последних лет акцент уделяется тому, что гены «предрасположенности», конечно же, определяют высокую вероятность развития различной акушерской патологии, но не всегда они передаются потомству [5].
Из этого следует, что исследования, посвященные изучению взаимосвязи различных функций организма с полиморфизмом аллелей различных генов, имеют огромное медико-социальное значение, а полученные авторами результаты лягут в основу прогнозирования различных клинических осложнений для каждого отдельно взятого полиморфизма генов [6].
Фолатный цикл – это сложный каскадный процесс, в котором задействовано множество различных ферментов. Основные ферменты, обеспечивающие превращение фолиевой кислоты на различных этапах всего цикла – MTHFR, MTRR, MTR, литературные данные подчеркивают важную роль этих ферментов в поддержании нормального уровня гомоцистеина, а при снижении их активности происходит накопление и избыток гомоцистеина в организме [7].
Подчеркивая огромную роль и важность фолиевой кислоты в метаболизме нуклеиновых кислот, в процессах пролиферации и дифференциации быстро делящихся клеток эмбриона, следует отметить, что нарушения в фолатном цикле крайне опасны [8].
Поэтому исследования, посвященные ранней досимптоматической диагностике нарушений гестации, позволят разработать профилактически направленную терапию и не дать болезни проявиться. Особенно это актуально для женщин с генетической предрасположенностью [5].
Учитывая полную неизученность данного вопроса в Кыргызской Республике, изучение роли полиморфизма генов фолатного цикла у женщин с невынашиванием беременности в анамнезе с позиций предиктового акушерства представляет огромный научный интерес.
Цель исследования: изучить носительство различных полиморфизмов генов фолатного цикла у женщин с невынашиванием беременности.
Материалы и методы исследования
Проведено проспективное когортное исследование на базе Национального центра охраны материнства и детства (НЦОМиД) МЗ КР в 2015–2017 гг.
В исследование включены 127 беременных женщин, которые были разделены на 2 группы: 1-я группа (основная) – 74 женщины с невынашиванием беременности в анамнезе и 2-я группа (контрольная) – 53 условно здоровых женщин.
Средний возраст беременных женщин в основной группе составил 29,9 ± 2,5 на 100 обследованных, в группе контроля – 29,1 ± 2,5 соответственно, статистически значимой разницы в группах не выявлено, р > 0,005, т.е. группы сопоставимы.
В целях выявления генетической предрасположенности к невынашиванию беременности отобраны 4 полиморфных варианта генов метаболизма фоливой кислоты и витамина В12 – MTHFR, MTR и MTRR, ассоциированные с гипергомоцистеинемией и фолиево-дефицитными состояниями (табл. 1).
Таблица 1
Изучаемые гены фолатного цикла
|
Аббревиатура |
Локус |
Белковый продукт |
Полиморфизм |
|
MTHFR |
1р36.3 |
Метилентетрагидрофолатредуктаза |
С677Т (А222V) |
|
А1298С (Е429А) |
|||
|
MTR |
1q43 |
Метионинсинтетаза |
А2756G (D919G) |
|
MTRR |
5р15.3-15.2 |
Метионинсинтетазаредуктаза |
А66G (I22M) |
Определение генетических полиморфизмов проведено методом ПЦР диагностики (аллель-специфической полимеразной цепной реакции) с детекцией результатов в режиме реального времени.
Интерпретация результатов анализов представлена в табл. 2, в которой описаны: функции генов; ко-факторы, необходимые для превращения гомоцистеина; комбинация возможных генотипов; частота встречаемости данных генотипов в общей популяции; аллели/нуклеоиды, выступающие заменой основания, приводящие к замене аминокислоты в ферменте и снижению ее биохимических свойств; ассоциированные проявления, которые возникают при замене нуклеоидов.
Таблица 2
Интерпретации генетического тестирования полиморфизма генотипов фолатного цикла
|
Ген |
Функция |
Ко-фактор |
Генотипы |
Частота |
Аллель |
Ассоциированные проявления |
|
MTHFR |
Кодирует белок MTHFR (внутриклеточный фермент), участвующий в превращении гомоцистеина в метионин |
В6, В12, фолиевая кислота |
С/С |
50 % |
Т |
Снижение активности фермента до 30 % от исходного, является фактором риска гепергомоцистеинемии |
|
С/Т |
38 % |
|||||
|
Т/Т |
12 % |
|||||
|
А/А |
56 % |
С |
||||
|
А/С |
28 % |
|||||
|
С/С |
4 % |
|||||
|
MTR |
Кодирует цитоплазматический фермент метионинсинтазу. Катализирует повторное метилирование гомоцистеина с образованием метионина |
Кобаламин (предшественник В12), фолиевая кислота |
А/А |
77 % |
G |
|
|
А/ G |
21 % |
|||||
|
G /G |
2 % |
|||||
|
MTRR |
Кодирует цитоплазматический фермент метионинсинтазаредуктазу (МСР), участвующую в синтезе белка и большом количестве биохимических реакций, связанных с переносом метильной группы, обратном превращение гомоцистеина в метионин |
В12, фолиевая кислота |
А/А |
58 % |
G |
|
|
А/ G |
36 % |
|||||
|
G /G |
6 % |
Необходимый объем выборки был рассчитан по Е.Н. Шигану (1987) (t = 3,2, Р < 0,001, 99,9 %) [9].
Произведены расчеты относительных величин (Р) и их ошибки (mр). Для оценки достоверности разности числовых значений относительных показателей произведено вычисление критерия достоверности (доверительного коэффициента t-критерий Стьюдента и χ²), рекомендуемого Н.Е. Черновой (2006) при проведении медико-социальных исследований по формуле 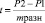 , при t = 3,2 вероятность различий равна 99,9 % или достоверность различий равна < 0,001 [9]. В качестве значений вероятности безошибочного прогноза были выбраны критерии статической значимости ошибки – менее 5 % двусторонняя (p < 0,05), при 95 % доверительном интервале, и статистической мощности – 80 %-я мощность. Ранговая значимость вычислялась коэффициентом ранговой корреляции Спирмена по формуле
, при t = 3,2 вероятность различий равна 99,9 % или достоверность различий равна < 0,001 [9]. В качестве значений вероятности безошибочного прогноза были выбраны критерии статической значимости ошибки – менее 5 % двусторонняя (p < 0,05), при 95 % доверительном интервале, и статистической мощности – 80 %-я мощность. Ранговая значимость вычислялась коэффициентом ранговой корреляции Спирмена по формуле
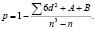
Для проведения статистической обработки полученных данных использован доступный в он-лайн-режиме свободный программный пакет Центра по контролю заболеваемости США OpenEpi 3.03.
Результаты исследования и их обсуждение
В ходе проведенного исследования выявлено 13 модификаций генотипов с различной частотой встречаемости аллелей в генах фолатного цикла (табл. 3). При этом в обеих группах зарегистрировано только пять совместных модификаций, кроме того в основной группе было выявлено пять модификаций, которые не были выявлены в контрольной группе и три модификации, выявленные в группе контроля, но не зарегистрированые в основной группе. Гомозиготные генотипы в генах MTHFR/MTR/MTRR (С/С+А/А+A/A+A/A), которые обеспечивают нормальный процесс реметилирования гомоцистеина, были выявлены статистически значимо чаще в контрольной группе – 73,6 ± 6,1 на 100 обследованных женщин, чем в основной группе – 12,2 ± 3,8 соответственно, χ² = 21,8, р < 0,001. У здоровых женщин четыре альтернативных ферментативных путей реметилирования гомоцистеина в метионин в 73,6 % случаев происходит благодаря гомозиготному набору генотипов, который обеспечивает нормальное протекание беременности и развитие плода. Однако в 26,4 % случаев в контрольной группе выявлен полиморфизм генотипов, т.е. у каждой 4-й женщины, который в зависимости от сочетания аллельных транзиций может выступать предиктором невынашивания беременности. При этом в основной группе только у 12,2 % женщин выявлен нормальный набор генов фолатного цикла, т.е. у каждой 10-й обследованной, а у 87,8 % женщин выявлены различные сочетания полиморфных вариантов генов. Кроме того, наиболее патологические транзиции, представленные гомозиготными генотипами в исследуемых генах с содержанием аллелей Т/Т+С/С+G/G+G/G, приводящие к значительному снижению функциональной активности ферментов и повышению уровня гомоцистеина в плазме, также были выявлены в обеих группах. Однако достоверно статистически значимо чаще они выявлены в основной группе – 28,4 ± 5,2 на 100 обследованных в сравнении с контрольной группой – 3,8 ± 2,6 соответственно, χ² = 15,6, р < 0,001. Из полученных данных следует, что у 28,4 % женщин основной группы предиктором невынашивания беременности выступает генетический гомозиготный фактор нарушения обмена в фолатном цикле. Данный фактор в свою очередь выступает не только предиктором невынашивания беременности, но и негативно воздействует на целостность ДНК в виде появления ломких сайтов и разрывов хромосом, что приводит к развитию различных врожденных аномалий плода. Следует отметить, что данная патология встречается и в контрольной группе, но лишь у 3,8 % женщин.
Таблица 3
Частота моделей различной комбинации полиморфных генов фолатного цикла
|
№ п/п |
Генотип |
Основная группа (n = 74) |
Контрольная группа (n = 53) |
χ² |
р |
||
|
Абс. |
Р ± mр |
Абс. |
Р ± mр |
||||
|
1 |
С/С+А/А+A/A+A/A |
9 |
12,2 ± 3,8 |
39 |
73,6 ± 6,1 |
21,8 |
< 0,001 |
|
2 |
С/С+А/А+A/A+A/G |
6 |
8,1 ± 3,2 |
– |
– |
||
|
3 |
С/С+A/C+А/А+A/G |
5 |
6,8 ± 2,9 |
– |
– |
||
|
4 |
С/С+A/C+A/G+A/G |
4 |
5,4 ± 2,6 |
– |
– |
||
|
5 |
С/Т+А/А+A/A+A/A |
– |
– |
1 |
1,9 ± 1,9 |
||
|
6 |
С/Т+А/С+A/A+A/A |
– |
– |
2 |
3,8 ± 2,6 |
||
|
7 |
С/Т+А/С+A/ G+A/A |
– |
– |
2 |
3,8 ± 2,6 |
||
|
8 |
C/T+A/С+A/G +A/G |
11 |
14,9 ± 4,1 |
– |
– |
||
|
9 |
C/T+A/С+A/G+A/G |
1 |
1,4 ± 1,3 |
5 |
9,4 ± 4,0 |
45,7 |
< 0,001 |
|
10 |
C/T+A/С+A/G+G/G |
7 |
9,5 ± 3,4 |
– |
– |
||
|
11 |
С/Т+С/С+А/G+G/G |
3 |
4,1 ± 2,3 |
1 |
1,9 ± 1,9 |
43,9 |
< 0,001 |
|
12 |
C/T+С/С+G/G+G/G |
7 |
9,5 ± 3,4 |
1 |
1,9 ± 1,9 |
35,3 |
< 0,001 |
|
13 |
Т/Т+С/С+G/G+G/G |
21 |
28,4 ± 5,2 |
2 |
3,8 ± 2,6 |
15,6 |
< 0,001 |
Следующей моделью генов, которая была выявлена в обеих обследуемых группах стала модель C/T+С/С+G/G+G/G, гетерозиготная транзиция цитозина (С) на тимин (Т) выявлена в позиции 677 гена MTHFR, нуклеоиды в остальных генах фолатного цикла остаются гомозиготными. Данный полиморфизм был достоверно статистически значимо чаще выявлен в основной группе (9,5 ± 3,4 на 100 женщин) в сравнении с группой контроля (1,9 ± 1,9 соответственно), χ² = 35,3, р < 0,001.
Модель полиморфизма генов MTHFR/MTR/MTRR – С/Т+С/С+А/G+G/G также выявлена в обеих группах, при данной модели кроме гетерогенной замены в позиции 677 гена MTHFR, представлена гетерогенная мутация, в результате которой произошла замена нуклеотида аденина (А) на гуанин (G) в позиции 2756 в последовательности ДНК гена MTR. Статистически значимо чаще данная модель была выявлена в основной группе (4,1 ± 2,3 на 100 обследованных женщин) по сравнению с группой контроля (1,9 ± 1,9 соответственно), χ² = 35,3, р < 0,001. Данная модель полиморфизма наблюдалась редко и составила менее 5,0 % в основной группе и 1,9 % в группе контроля.
В обеих группах также выявлен полиморфизм генов фолатного цикла, представленный гетерозиготной комбинацией аллелей C/T+A/С+A/G+A/G, где кроме гетерозиготной замены в генах MTHFR на позиции 677 и MTR в позиции 2756, произошла транзиция аденина (А) на цистозин (С) в позиции 1298 ДНК гена MTHFR и замена аденина (А) на гуанин (G) в позиции 66 участка ДНК в гене MTRR. Таких женщин было статистически значимо больше в группе контроля (9,4 ± 4,0 на 100 женщин) в сравнении с основной группой (1,4 ± 1,3), χ² = 45,7, р < 0,001. В контрольной группе данный полиморфизм встречался около 10,0 % женщин, а в основной группе составил 1,4 %.
Далее в основной группе выявлена комбинация полиморфизмов в пяти различных модификациях, которые не были зарегистрированы в контрольной группе. Модель аллелей – С/С+А/А+A/A+A/G, где представлен гомозиготный набор нуклеоидов в генах MTHFR/MTR и гетерозиготная транзиция нуклеотида аденина (А) на гуанин (G) в позиции 66 в ДНК гена MTRR, выявленная у 8,1 ± 3,2 на 100 обследованных женщин, и модель – С/С+A/C+А/А+A/G с гомозиготным набором нуклеоидов генов MTHFR в позиции 677 и MTR и гетерозиготной мутацией генов MTHFR в позиции 1298 и MTRR, зарегистрированная у 6,8 ± 2,9 на 100 женщин. Следующая модель представлена комбинацией – С/С+A/C+A/G+A/G, где гомозиготный набор установлен только в гене MTHFR, остальные транзиции представлены гетерозиготными заменами, данная патология была у 5,4 ± 2,6 женщин. Полностью гетерогенная мутация C/T+A/С+A/G +A/G в генах фолатного цикла выявлена у 14,9 ± 4,1 на 100 обследованных женщин основной группы. Кроме того, выявлена модель – C/T+A/С+A/G+G/G, где гомозиготная транзиция определялась в гене MTRR, заменой аденина (А) на гуанин (G), остальные генотипы были представлены гетерогенными мутациями.
В контрольной группе выявлено 3 модификации полиморфизма аллелей генов фолатного цикла, не встречающихся в основной группе. Таковыми были сочетание полиморфизма С/Т+А/А+A/A+A/A, где транзиция по гетерозиготному типу была выявлена только в гене MTHFR на участке ДНК позиции 677, при этом данная модель представлена у 1,9 ± 1,9 на 100 обследованных женщин. Модель полиморфизма – С/Т+А/С+A/A+A/A, где к гетерозиготному типу участка на позиции 677 гена MTHFR добавляется транзиция на позиции 1298 ДНК этого же гена, выявленная у 3,8 ± 2,6 женщин соответственно. Модель – С/Т+А/С+A/G+A/A, представлена гомозиготным набором нуклеоидов в гене MTRR, а в остальных генах выявлена гетерозиготная транзиция, в группе контроля их было 3,8 ± 2,6 на 100 обследованных женщин.
В ходе исследования установлено, что в основной группе ранговые места в структуре моделей полиморфизма генов фолатного цикла представлены по убыванию следующим образом: Т/Т+С/С+G/G+G/G – 28,4 %, C/T+A/С+A/G+A/G – 14,9 %, С/С+А/А+A/A+A/A – 12,2 %, C/T+A/С+A/G+G/G – 9,9 %, C/T+С/С+G/G+G/G – 9,5 %, С/С+А/А+A/A+A/G – 8,1 %, С/С+A/C+А/А+A/G – 6,8 %, С/С+A/C+A/G+A/G – 5,4 %, С/Т+С/С+А/G+G/G – 4,1 % и C/T+A/С+A/G+A/G – 1,4 %. В основной группе благоприятный набор генотипа был выявлен только у 12,2 % женщин. В 87,8 % случаев зарегистрированы транзиции нуклеоидов, приводящие к невынашиванию беременности, что доказывает важную роль генетической предрасположенности, как предиктора не только невынашивания, но и различных аномалий развития плода приводящих к плодовым потерям.
Группа контроля представлена другой структурой ранговых мест моделей, по убывающей: С/С+А/А+A/A+A/A – 73,6 %, C/T+A/С+A/G+A/G – 9,4 %, С/Т+А/С+A/A+A/A – 3,8 %, С/Т+А/С+A/G+A/A – 3,8 %, Т/Т+С/С+G/G+G/G – 3,8 %, С/Т+А/А+A/A+A/A – 1,9 %, С/Т+С/С+А/G+G/G – 1,9 %, C/T+С/С+G/G+G/G – 1,9 %. Для женщин контрольной группы характерен благоприятный набор генотипа, выявленный у 73,6 % обследованных.
Учитывая важную роль фолиевой кислоты и витаминов группы В для благоприятного течения беременности и нормального развития плода, необходимо на этапах планирования семьи, прегравидарной подготовки и в первом триместре беременности проводить беседы/консультации с женщинами о необходимости своевременного и регулярного приема данных препаратов с целью нивелирования генетических предикторов, особенно для женщин с невынашиванием беременности в анамнезе и полиморфизмом генов фолатного цикла.
В табл. 4 представлены данные о выявленном сочетании различных генотипов полиморфных генов фолатного цикла у обследованных женщин. В участке, кодирующем последовательности ДНК гена MTHFR, в позиции 677 выявлена комбинация С/С, что является нормальным строением генотипа, статистически достоверно больше в контрольной группе (73,6 ± 6,1 на 100 женщин) в сравнении с основной группой (32,4 ± 5,4 соответственно), χ² = 6,9, р = 0,009. Генотип С/Т, при котором произошла транзиция нуклеотидом тимином цитозина, выявлена статистически значимо чаще в основной группе (39,2 ± 5,7 на 100 женщин) по сравнению с контрольной (22,6 ± 5,8 соответственно), χ² = 5,1, р = 0,024. Гомозиготная замена нуклеотида цитозина (С) на тимин (Т) также достоверно статистически значимо чаще выявлена в основной группе (28,4 ± 5,2 на 100 женщин), чем в группе контроля (3,8 ± 2,6 соответственно), χ² = 15,6, р < 0,001.
Таблица 4
Структура генотипов в ДНК полиморфизма генов фолатного цикла
|
Ген |
Полиморфизм |
Генотип |
Основная группа (n = 74) |
Контрольная группа (n = 53) |
χ² |
р |
||
|
Абс. |
Р ± mр |
Абс. |
Р ± mр |
|||||
|
MTHFR |
с.677 С > Т (А222V) |
С/С |
24 |
32,4 ± 5,4 |
39 |
73,6 ± 6,1 |
6,9 |
0,009 |
|
С/Т |
29 |
39,2 ± 5,7 |
12 |
22,6 ± 5,8 |
5,1 |
0,024 |
||
|
Т/Т |
21 |
28,4 ± 5,2 |
2 |
3,8 ± 2,6 |
15,6 |
< 0,001 |
||
|
c.1298 А > С (Е429А) |
А/А |
15 |
20,3 ± 4,7 |
40 |
75,5 ± 5,9 |
14,8 |
< 0,001 |
|
|
А/С |
28 |
37,8 ± 5,6 |
9 |
17,0 ± 5,2 |
6,9 |
0,009 |
||
|
С/С |
31 |
41,9 ± 5,7 |
4 |
7,6 ± 3,6 |
7,5 |
0,007 |
||
|
MTR |
с.2756 А > G (D919G) |
A/A |
20 |
27,0 ± 5,2 |
42 |
79,3 ± 5,6 |
14,8 |
< 0,001 |
|
A/G |
26 |
35,1 ± 5,6 |
8 |
15,1 ± 4,9 |
8,5 |
0,004 |
||
|
G/G |
28 |
37,8 ± 5,6 |
4 |
7,6 ± 3,6 |
9,2 |
0,003 |
||
|
MTRR |
c.66 A > G (I22M) |
A/A |
9 |
12,2 ± 3,8 |
44 |
83,0 ± 5,2 |
25,7 |
< 0,001 |
|
A/G |
27 |
36,5 ± 5,6 |
6 |
11,3 ± 4,4 |
8,9 |
0,003 |
||
|
G/G |
38 |
51,4 ± 5,8 |
3 |
5,7 ± 3,2 |
16,5 |
< 0,001 |
||
При анализе в структуре частоты встречаемости полиморфных генотипов гена MTHFR в основной группе статистически значимой разницы не обнаружено, р > 0,05. В контрольной группе статистически значимо чаще выявлен нормальный набор нуклеотидов С/С в сравнении с полиморфными, р < 0,001.
На участке ДНК гена MTHFR также выявлены варианты полиморфизма в позиции 1298, при этом нормальным является генотип А/А, выявленный статистически значимо чаще в контрольной группе (75,5 ± 5,9 на 100 женщин) в сравнении с основной группой (20,3 ± 4,7 соответственно), χ² = 14,8, р < 0,001. Замена аденина (А) на цитозин (С) выявлена статистически значимо чаще в основной группе (37,8 ± 5,6 на 100 обследованных женщин) по сравнению с группой контроля (17,0 ± 5,2 соответственно), χ² = 6,9, р = 0,009. Гомозиготная транзиция аденина (А) на цитозин (С) также статистически значимо чаще выявлена в основной группе (41,9 ± 5,7 на 100 женщин) в сравнении с группой контроля (7,6 ± 3,6 соответственно), χ² = 7,5, р = 0,007.
Сравнивая структуру генотипов в гене MTHFR, следует отметить, что в основной группе статистически значимо чаще выявлены полиморфные генотипы, р < 0,001, а в контрольной группе статистически значимо чаще нормальный набор генотипа, р < 0,001.
В гене MTR на участке 2756 выявлен генотип А/А (нормальный набор) статистически значимо чаще также в группе контроля (79,3 ± 5,6 на 100 женщин) в сравнении с основной группой (27,0 ± 5,2 соответственно), χ² = 14,8, р < 0,001. Замена аденина (А) на гуанин (G) в последовательности ДНК гена MTR выявлена статистически значимо чаще в основной группе (35,1 ± 5,6 на 100 женщин) в сравнении с группой контроля (15,1 ± 4,9 соответственно), χ² = 8,5, р = 0,004. Гомозиготная транзиция гуанина (G) на позицию аденина (А) статистически значимо чаще также выявлена в основной группе (37,8 ± 5,6 на 100 женщин), чем в группе контроля (7,6 ± 3,6 соответственно), χ² = 9,2, р = 0,003.
В структуре генотипов гена MTR в основной группе не обнаружено статистически значимой разницы, р > 0,05, а в группе контроля статистически значимо чаще встречается нормальный набор нуклеоидов, р < 0,001.
В цепочке ДНК гена MTRR на позиции 66 нормальный набор нуклеоидов А/А выявлен достоверно статистически значимо чаще также в контрольной группе (83,0 ± 5,2 на 100 женщин) в сравнении с основной группой (12,2 ± 3,8 соответственно), χ² = 25,7, р < 0,001. В основной группе статистически значимо чаще выявлен полиморфизм А > G, где произошла замена аденина (А) в позиции 66 на гуанин (G) (36,5 ± 5,6 на 100 женщин) в сравнении с группой контроля (11,3 ± 4,4 соответственно), χ² = 8,9, р = 0,003. Также в основной группе статистически значимо чаще выявлена гомозиготная замена аденина (А) на гуанин (G) (51,4 ± 5,8 на 100 женщин), чем в контрольной группе (5,7 ± 3,2 соответственно), χ² = 16,5, р < 0,001.
В структуре основной группы полиморфизм генотипов в сравнении с нормальным набором нуклеоидов был выявлен статистически значимо чаще, р < 0,001, в группе контроля, наоборот, статистически значимо чаще выявлен нормальный набор генотипа, р < 0,001.
Далее нами рассмотрено количество аллелей нуклеоидов по частоте встречаемости у женщин обеих групп (табл. 5). Как видно из таблицы, на участке ДНК гена MTHFR в позиции 677 в контрольной группе статистически значимо чаще встречается нуклеоид С, выявленный у 84,9 % женщин в сравнении с основной группой – 52,0 %, χ² = 5,0, р = 0,015, а нуклеоид Т соответственно статистически значимо чаще в основной группе – 48,0 % женщин, чем в контрольной – 15,1 %, χ² = 7,9, р = 0,005.
Таблица 5
Частота аллелей аминокислот в структуре участка ДНК полиморфных генов фолатного цикла
|
Ген |
Полиморфизм |
Аллели |
Основная группа (n = 148) |
Контрольная группа (n = 106) |
χ² |
р |
||
|
Абс. |
Р ± mр |
Абс. |
Р ± mр |
|||||
|
MTHFR |
с.677 С > Т (А222V) |
С |
77 |
52,0 ± 4,1 |
90 |
84,9 ± 3,5 |
5,0 |
0,015 |
|
Т |
71 |
48,0 ± 4,1 |
16 |
15,1 ± 3,5 |
7,9 |
0,005 |
||
|
c.1298 А > С (Е429А) |
А |
58 |
39,2 ± 4,0 |
89 |
84,0 ± 3,6 |
13,2 |
< 0,001 |
|
|
С |
90 |
60,8 ± 4,0 |
17 |
16,0 ± 3,6 |
22,4 |
< 0,001 |
||
|
MTR |
с.2756 А > G(D919G) |
A |
66 |
44,6 ± 4,1 |
92 |
86,8 ± 3,3 |
15,5 |
< 0,001 |
|
G |
82 |
55,4 ± 4,1 |
14 |
13,2 ± 3,3 |
22,8 |
< 0,001 |
||
|
MTRR |
c.66 A > G(I22M) |
A |
45 |
30,4 ± 3,8 |
94 |
88,7 ± 3,1 |
24,1 |
< 0,001 |
|
G |
103 |
69,6 ± 3,8 |
12 |
11,3 ± 3,1 |
35,6 |
< 0,001 |
||
Схожая картина наблюдается для позиции 1298 гена MTHFR, где аденин (А) выявлен статистически значимо чаще в контрольной группе у 84,0 % женщин в сравнении с основной группой у 39,2 % женщин, χ² = 13,2, р < 0,001. Нуклеоид цитозин выявлен у 60,8 % женщин основной группы, что статистически значимо чаще в сравнении с группой контроля (16,0 %), χ² = 22,4, р < 0,001.
Для гена MTR в позиции 2756 характерна статистически значимо чаще встречаемость нуклеоида аденина (А) также в контрольной группе (86,8 %), чем в основной группе (44,6 %), χ² = 15,5, р < 0,001. При этом в основной группе статистически значимо чаще выявлена встречаемость гуанина (G) – 69,6 %, чем в группе контроля – 11,3 %, χ² = 15,5, р < 0,001.
Участок ДНК гена MTRR на позиции 66 в основной группе представлен аденином (А) статистически значимо чаще также в группе контроля (88,7 %), чем в основной группе (30,4 %), χ² = 24,1, р < 0,001. Наличие нуклеоида гуанина (G) в результатах женщин основной группы статистически значимо чаще (69,6 %), чем в группе контроля (11,3 %), χ² = 35,6, р < 0,001.
Таким образом, проведенный анализ встречаемости полиморфизма генов фолатного цикла в цепочке ДНК женщин, обследованных в клиническом родильном доме НЦОМиД МЗ КР за 2015–2017 гг., установил, что:
1. Выявлено 13 модификаций генотипов с различной частотой встречаемости, в основной группе – 10, в контрольной – 8, р > 0,05. Из них пять встречаются в обеих группах, пять только в основной группе и три только в контрольной группе.
2. Гомозиготные генотипы в генах MTHFR/MTR/MTRR (С/С+А/А+A/A+A/A) выявлены статистически значимо чаще в контрольной группе – 73,6 % в сравнении с основной группой – 12,2 %, χ² = 21,8, р < 0,001. Патологические транзиции гомозиготными генотипами с содержанием аллелей Т/Т+С/С+G/G+G/G были выявлены статистически значимо чаще в основной группе – 28,4 % в сравнении с контрольной группой – 3,8 %, χ² = 15, р < 0,001.
3. В основной группе ранговые места в структуре моделей полиморфизма представлены по убыванию: Т/Т+С/С+G/G+G/G – 28,4 %, C/T+A/С+A/С+A/G – 14,9 %, С/С+А/А+A/A+A/A – 12,2 %, C/T+A/С+A/G+G/G – 9,9 %, C/T+С/С+G/G+G/G – 9,5 %, С/С+А/А+A/A+A/G – 8,1 %, С/С+A/C+А/А+A/G – 6,8 %, С/С+A/C+A/G+A/G – 5,4 %, С/Т+С/С+А/G+G/G – 4,1 % и C/T+A/С+A/G+A/G – 1,4 %.
4. В группе контроля структура ранговых мест моделей иная: С/С+А/А+A/A+A/A – 73,6 %, C/T+A/С+A/G+A/G – 9,4 %, С/Т+А/С+A/A+A/A – 3,8 %, С/Т+А/С+A/G+A/A – 3,8 %, Т/Т+С/С+G/G+G/G – 3,8 %, С/Т+А/А+A/A+A/A – 1,9 %, С/Т+С/С+А/G+G/G – 1,9 %, C/T+С/С+G/G+G/G – 1,9 %.
5. В структуре частоты полиморфных генотипов гена MTHFR на позиции 677 в основной группе статистически значимой разницы не обнаружено, р > 0,05, в контрольной группе статистически значимо чаще выявлен набор нуклеотидов С/С, р < 0,001.
6. В структуре генотипов в гене MTHFR в позиции 1298 в основной группе статистически значимо чаще выявлены полиморфные генотипы, р < 0,001, в контрольной группе статистически значимо чаще набор генотипа А/А, р < 0,001.
7. В структуре генотипов гена MTR на позиции 2756 в основной группе не обнаружено статистически значимой разницы, р > 0,05, а в группе контроля статистически значимо чаще встречается набор нуклеоидов А/А, р < 0,001.
8. В структуре основной группы полиморфизм генотипов гена MTRR в позиции 66 выявлен статистически значимо чаще, р < 0,001, а в группе контроля набор генотипа А/А, р < 0,001.
9. По частоте встречаемости нуклеоидов на участке ДНК гена MTHFR в позиции 677 в контрольной группе статистически значимо чаще встречается нуклеоид С (84,9 %), чем в основной группе (52,0 %), χ² = 5,0, р = 0,015, нуклеоид Т статистически значимо чаще в основной группе (48,0 %), чем в контрольной (15,1 %), χ² = 7,9, р = 0,005.
10. Для позиции 1298 гена MTHFR аденин статистически значимо чаще в контрольной группе (84,0 %) в сравнении с основной группой (39,2 %), χ² = 13,2, р < 0,001, цитозин (60,8 %) в основной группе статистически значимо чаще в сравнении с группой контроля (16,0 %), χ² = 22,4, р < 0,001.
11. В гене MTR на позиции 2756 статистически значимо чаще встречается аденин в контрольной группе (86,8 %), чем в основной группе (44,6 %), χ² = 15,5, р < 0,001, в основной группе статистически значимо чаще встречается гуанин (69,6 %), чем в группе контроля (11,3 %), χ² = 15,5, р < 0,001.
12. Ген MTRR на позиции 66 в основной группе представлен аденином статистически значимо чаще в группе контроля (88,7 %), чем в основной группе (30,4 %), χ² = 24,1, р < 0,001, гуанин в основной группе статистически значимо чаще (69,6 %), чем в группе контроля (11,3 %), χ² = 35,6, р < 0,001.
Заключение
Полученные и исследованные данные позволяют научно обосновать предиктовую значимость полиморфизма генотипов при невынашивании беременности. Однако учитывая, что данные предикторы являются генами предрасположенности, потенцирующими развитие различной патологии, важно на этапе планирования беременности нивелировать их действие восполнением дефицита фолиевой кислоты и витаминов группы В.

