Атипические изоформы протеинкиназы C (АИПКC) представляют собой крайне интересный класс белков, причём любопытен он не только с позиций физиологических процессов, но и с точки зрения патогенетических механизмов, в том числе механизмов канцерогенеза. Одним из важнейших представителей данного класса белков является протеинкиназа C iota (ПКCi). Данная протеинкиназа, как и другие представители семейства АИПКC, не требует для своей активации ни Ca2+, ни диацилглицерола, что сказывается на их более высокой ферментативной активности [1].
В последнее время достаточно интенсивно изучается роль ПКCi в развитии онкологических заболеваний. В частности, высокая активность ПКCi наблюдается в аденокарциномах пищевода, стимулируя процесс пролиферации опухолевых клеток и подавляя процессы апоптоза в них [2]. При раке поджелудочной железы разработаны несколько перспективных препаратов, ингибирующих данную разновидность протеинкиназ. В некоторых исследованиях было показано, что ПКCi играет существенную роль в развитии рака яичников [3]. Данный подход позволил создать способ лечения таких больных с применением ингибитора ПКCi препарата ауронофина, показавшего свою эффективность. Было выявлено, что ПКCi принимает участие в развитии рака желудка [4]. В исследованиях некоторых форм рака молочной железы определена значительная роль ПКCi в её патогенезе [5]. Также была показана роль ПКCi в развитии немелкоклеточного рака легкого и его прогрессии [6].
В некоторых исследованиях была выявлена роль ПКCi в развитии глиобластомы [7]. Это привело к тому, что при данном виде опухолей именно ПКCi стала наиболее перспективным объектом терапевтических воздействий. Так, применение такого препарата, как ауротиомалат, снижающего продуктивность каскадного пути ПКCi, позволило уменьшить инвазивность опухоли и вызвать ее регресс [8]. Использование специального ингибитора данной формы протеинконаз ICA-1 приводит к значительному уменьшению объема опухоли [9].
Несмотря на очевидную перспективность потенциального использования ПКCi в качестве диагностического маркера и возможной мишени для таргетной терапии, исследований, выявляющих участие ПКCi в патогенезе большинства опухолей головного мозга, не проводилось. Между тем существует ряд опухолей, которые в силу своей сложной локализации и наличия рецидивирующего течения нуждаются в поиске дополнительных диагностических и лечебных подходов. Одной из таких опухолей является пилоидная астроцитома (ПА). ПА является самой частой опухолью головного мозга у детей [10]. При этом нередко наблюдаются рецидивы онкологического процесса, в том числе связанные с невозможностью или повышенной трудностью в осуществлении радикального хирургического лечения вследствие сложной локализации опухоли в хиазмально-селлярной области и стволе головного мозга [11, 12].
Поэтому целью данного исследования явилось изучение роли ПКCi в канцерогенезе ПА и оценке влияния активности её экспрессии на прогноз безрецидивной выживаемости пациентов.
Материалы и методы исследования
Модель исследования
Проводилось ретроспективное, слепое исследование с включением 60 образцов опухолей пациентов с диагнозом ПА (ВОЗ Grade I), получавших хирургическое лечение в ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко в 2010–2014 гг. Проводилось наблюдение пациентов в течение минимум пяти лет, выполнялись регулярные (два раза в год) контрольные магнитно-резонансные томографии головного мозга на предмет наличия рецидивов онкологического процесса. Были сформированы две равные группы пациентов (по 30 человек в каждой): группа с наличием рецидива (ГСР) и отсутствием рецидива (ГБР) на протяжении пяти лет. Критериями рецидива выступали появление характерной клинической картины и МР-признаки рецидива онкологического процесса в том же месте, что и локализация первичной опухоли. Время до появления рецидива рассчитывалось как период времени в днях от проведенной операции по поводу первичной опухоли до возникновения признаков рецидива.
Иммуногистохимическое исследование
В ходе исследования использовались парафиновые блоки с образцами опухолей (в ГСР использовались образцы опухолей от первой операции). Из них изготавливали срезы с толщиной слоя 3 микрометра, выполняли депарафинирование срезов с использованием ксилола, после чего срезы гидратировались с помощью различных концентраций растворов этанола. Затем проводили инкубацию препаратов с кроличьими моноклональными антителами против антигена ПКСi человека (Cell Marque, «Sigma-Aldrich», США) и с антикроличьими мышиными IgG антитeлами против пероксидазы хрена (Cell Marque, «Sigma-Aldrich», США). Сайты связывaния проявляли с помощью тетрагидрохлорида 3,3'-диаминобензидина («Ventana Medical Systems», США).
Обработка результатов исследования
Препараты изучались с помощью светового микроскопа при увеличении x 200 тремя патологами. Для выявления активность экспрессии ПКСi проводилось оценка экспрессии полуколичественным методом histoscore с дальнейшим усреднением результатов.
При определении histoscore процент клеток, имеющих слабое окрашивание, умножался на один, процент клеток с умеренной интенсивностью окрашивания умножался на два, и, наконец, процент клеток с выраженным положительным окрашиванием умножался на три, после чего результат суммировался.
Статистическая обработка результатов исследования
Статистическая обработка выполнялась с помощью программного обеспечения Statistica 10 (StatSoft, США). Для определения уровня достоверности различий в активности экспрессии ПКCi для разных групп использовался U-критерий Манна – Уитни. Для определения взаимосвязи histoscore ПКCi c безрецидивной выживаемостью применялся регрессионный анализ по методу Кокса. Различия считались достоверными при p < 0,05.
Результаты исследования и их обсуждение
Характеристика групп исследования
Средний возраст пациентов на момент операции составлял 12,65 ± 2,42 года. 60 % участников были лицами мужского пола, 40 % женского пола. В ГСР средний возраст пациентов составил 9,76 ± 1,68 года, в то время как в ГБР данный показатель был на уровне 15,54 ± 3,16 года. ГСР характеризовалось средним временем до развития рецидива 775,93 ± 108,81 дней.
Сравнение активности экспрессии ПКCi в ГСР и ГБР
В рамках исследования было выявлено, что уровень экспрессии histoscore ПКCi в ГСР составил 137,89 ± 2,01 %, в то время как в ГБР данный показатель был ниже и составил 119,54 ± 2,46 % (рис. 1). Выявленные различия носили статистически достоверный характер (p = 0,000002; z = 4,72).
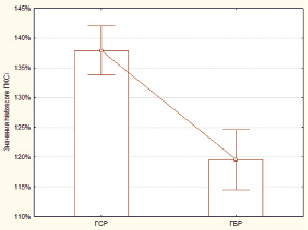
Рис. 1. Значения histoscore ПКCi в ГСР и ГБР. По оси ординат приведены средние групповые значения histoscore ПКCi в процентах. Данный показатель был статистически достоверно выше в ГСР, нежели в ГБР (p = 0,000002; z = 4,72)
Взаимосвязь активности экспрессии ПКCi с временем возникновения рецидива
Кроме того, в нашем исследовании мы оценили взаимосвязь активности экспрессии ПКCi с временем до возникновения рецидива и степень вклада данного показателя в риск возникновения рецидива. Для решения этой задачи мы провели регрессионный анализ Кокса, в результате было выявлено, что histoscore ПКCi значимо влиял на прогноз пациентов, причём повышение его значений на 1 % приводило к увеличению возникновения риска рецидива ПА на 5,57 % (p = 0,00003; expβ = 1,0557) (рис. 2).
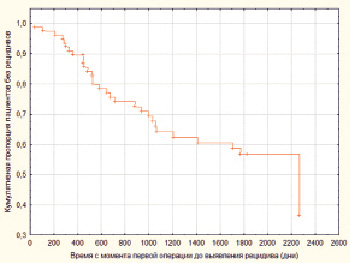
Рис. 2. Кумулятивная пропорция пациентов без наличия рецидивов (по оси ординат) в зависимости от времени до возникновения рецидива (по оси абсцисс)
Безусловно, с точки зрения выживаемости ПА не представляются такой же остро стоящей проблемой, как злокачественные опухоли глиального и неглиального происхождения. Однако в аспекте лечебных подходов ПА все равно являют собой достаточно важную проблему, поскольку их локализация, не позволяющая зачастую провести радикальное удаление опухоли, и вытекающий из этого повышенный риск развития рецидивов приводят к необходимости поиска более тонких методов терапии, способных высокоэффективно подавлять рост опухолевой ткани и индуцировать состояние ремиссии. Вопросы подобного рода в современной онкологии все чаще находят свое решение благодаря поиску важнейших драйверных молекулярных изменений в опухолевых клетках, становящихся мишенью для разработки средств таргетной терапии. Иногда этот процесс относительно прост – достаточно выявить наиболее распространенную среди данного вида опухолей молекулярно-генетическую модификацию, после чего направленный на нейтрализацию эффектов этой модификации терапевтический агент успешно подавляет рост и развитие опухолевых клеток, выводя пациента в клиническую ремиссию. К сожалению, далеко не все опухоли оказались чувствительны к такому подходу.
ПА в этом аспекте выглядят очень перспективно: есть доминирующее мутационное событие – слияние генов KIAA1549-BRAF – приводящее к гиперактивации белка BRAF и запуску сигнального каскада RAS/MAPK, играющего драйверную роль в реализации пролиферативных эффектов опухоли [13]. Тем не менее, несмотря на многообещающие предпосылки, ингибиторы BRAF не смогли показать своей эффективности в лечении ПА [14].
Чем могут быть объяснены такие результаты? Существует вероятность, что одной из причин выступает сложность организации всей системы сигнальных каскадов внутри клеток, в том числе молекулярных путей, обеспечивающих ростовые и пролиферативные процессы в норме и патологии. Одним из важнейших звеньев, на котором конвергируют различные сигнальные пути и которое также может активировать элементы различных каскадов, являются эффекторные механизмы. Очевидно, что в данном случае подобные эффекторные механизмы в ключевых патогенетических точках должны обладать достаточно специфическими свойствами. АИПКC идеально подходят на эту роль. Их биохимические особенности – более низкий в сравнении с другими протеинкиназами порог активации и возможность длительного самоподдержания активности – дают им возможность реализовывать сложные молекулярные программы, лежащие в основе прогрессирования опухолевых заболеваний.
Руководствуясь этими предположениями, ранее мы уже продемонстрировали возможность применения одного из представителей АИПКC – ПК Mζ – в патогенезе ПА [15]. В нынешнем исследовании мы продолжили развивать данную тематику и выявили роль другого представителя АИПКC – ПКСi – не только в фундаментальном плане, ведь мы впервые охарактеризовали экспрессию рассматриваемого маркера в ПА, но и в клиническом: ПКCi оказалась взаимосвязана с прогнозом.
Заключение
В данном исследовании нам удалось выявить более высокую активность экспрессии ПКCi у пациентов с наличием рецидива опухолевого процесса в течение пяти лет после первичной операции по сравнению с безрецидивными больными. Более того, уровень экспрессии ПКCi оказался статистически достоверно взаимосвязан с прогнозом заболевания в отношение рецидивирования. Таким образом, ПКСi может быть не только многообещающей мишенью для разработки средств таргетной терапии, но и существенно расширить диагностический пул, используемый в клинической практике, в качестве эффективного инструмента оценки риска возникновения рецидива.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01034 мк.

