Разработка технологии трансплантации эмбрионов началась около ста лет назад и уже в 1970-х гг. перешла в коммерческую сферу деятельности на международном уровне. Так, в 2016 г. в мире было получено 632 638 эмбрионов от 93 815 коров-доноров, из которых 196 тыс. были пересажены сразу, а оставшаяся часть были подвергнуты криоконсервации [1, 2]. Лидером в области трансплантации эмбрионов на протяжении многих лет остается Северная Америка – на долю США и Канады приходится 52,5 % от всего числа эмбрионов, полученных по технологии in vivo, в то время как в Европе только 20,4 % [1, 2]. В связи с таким широким распространением технологии трансплантации эмбрионов появилась необходимость отбора коров-доноров по генетическим показателям чувствительности к процедуре стимуляции овуляции гонадотропными гормонами [3].
Индукция суперовуляции осуществляется введением животным гонадотропных препаратов, одним из которых является лютеинизирующий гормон (ЛГ). Лютеинизирующий гормон крупного рогатого скота играет роль в развитии фолликулов, овуляции, образовании желтого тела и предымплантационном развитии эмбрионов [4]. Клеточные эффекты, вызванные ЛГ, опосредуются рецептором лютеинизирующего гормона/хориогонадотропина (luteinizing hormone/choriogonadotropin receptor, LHCGR). LHCGR принадлежит к классу мембранных рецепторов, сопряженных с G-белками. Связывание ЛГ с LHCGR приводит к диссоциации G-белков, которые регулируют активность фосфолипазы C, аденилатциклазы и ионных каналов, которые, в свою очередь, контролируют клеточные инозитолфосфаты, цАМФ, Ca2+ и другие вторичные мессенджеры.
У крупного рогатого скота ген LHCGR локализован в 11 хромосоме и состоит из 11 экзонов [5]. Есть данные о вариантах сплайсинга LHCGR с делециями экзона 10 и частичными делециями экзона 11 или экзона 3. Первые два варианта встречаются значительно чаще в культивируемых гранулезных клетках. Было показано, что полиморфизм гена LHCGR связан с суперовуляторным ответом коров на экзогенные гонадотропины [5–7]. Ген LHCGR рассматривается как ген-кандидат для прогнозирования ответа на индукцию суперовуляции, а выявленные в гене полиморфные варианты рассматриваются в связи с фертильностью крупного рогатого скота [8, 9]. Наиболее значимыми однонуклеотидными заменами (SNP) являются несинонимичные мутации, расположенные в экзонах гена, так как они ведут к замене аминокислотных остатков, что в свою очередь изменяет первичную структуру белка и может повлиять на его функции. Из всех найденных к настоящему времени SNP наибольший интерес представляет замена 1401G>T (ss52050737), так как было выявлено, что животные с генотипами GG или GT характеризуются более высокими показателями по общему количеству яйцеклеток, а по количеству выживших при трансплантации эмбрионов наилучшие показатели - у животных с генотипом GG. Так же животные с генотипом GG имеют наименьшее количество неоплодотворённых яйцеклеток по сравнению с носителями двух других генотипов [6].
Цель исследования: разработка метода генотипирования крупного рогатого скота по аллелям 1401G/T (ss52050737) гена lhcgr на основе ПЦР в реальном времени.
Материалы и методы исследования
ДНК выделяли из 195 образцов цельной крови коров черно-пестрого голштинизированного скота с использованием набора «М-сорб» (Синтол, Россия).
Нуклеотидные последовательности праймеров и зондов подбирали с помощью программ GeneRunner и Multiple primer analyzer (https://www.thermofisher.com/). Праймеры и зонды были синтезированы ООО «ДНК-синтез» (Москва, Россия).
Реакцию амплификации проводили в 10 мкл смеси ПЦР, содержащей 5 мкл реактива LightCycler® 480 Probes Master («Roche», Швейцария), по 0,4 мкМ прямого праймера lhcgr-F: 5'-TGAACTCTCTGTCTACACCCTCACA-3' и обратного праймера lhcgr-R: 5'-GCATGACTGGAATGGCATGTT-3', по 0,2 мкМ аллель-специфичных зондов lhcgr-T: 5'-(FAM)-CACTAGAAAGATGTCACACC-(BHQ1)-3' (0,2 µM) и lhcgr-G: 5'-(VIC)-CTAGAAAGATGGCACACC-(BHQ1)-3', 10 нг ДНК.
ПЦР проводили с помощью прибора LightCycler 96 («Roche», Швейцария) в оптимизированных условиях (95 °C – 10 мин.; 95 °C 15 с, 58 °C 30 с, 72 °C 20 с, 40 циклов). Детекция флуоресценции проводилась на стадии элонгации по каналам FAM и VIC. Для анализа результатов генотипирования по конечной точке использовали программное обеспечение к амплификатору LightCycler® 96 версии SW1.1.

Рис. 1. Пример детекции аллелей 1401G/T (полиморфизм ss52050737) гена lhcgr крупного рогатого скота методом ПЦР в реальном времени. Представлены кривые флуоресценции (А-В) и диаграмма распределения генотипов (Г)
Валидацию разработанного нами метода проводили методом ПЦР-ПДРФ. 20 мкл смеси для ПЦР содержали 1х буфер с 3мМ MgCl2 и 1 ед. HS Taq полимеразы («Евроген», Россия), 0,2 мкМ lhcgr_RFLP-Dir: 5'-ACAGTCCCCCGCTTTCTCAT-3' и RFLP-Rev: 5'-TGACACCCACAAGAGGCAAC-3' праймеров, 10 нг ДНК. Реакцию амплификации проводили на LightCycler® 96 (Roche, Switzerland) при условиях: 95 °С в течение 15 с, 62 °С в течение 15 с, 72 °С в течение 15 с (40 циклов).
Рестрикцию проводили в 20 мкл смеси, содержащей 2 мкл 10х буфера G и 1,5 мкл эндонуклеазы NmuCI (Thermo Scientific, США) в течение 16 ч при 37 °С. Результаты рестрикции оценивали методом электрофореза в 1,2 % агарозном геле.
Расчёт частот встречаемости выявленных генотипов проводился методом прямого подсчёта. Частоты алеллей рассчитывали, используя формулу
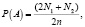
где N1 – число гомозигот по исследуемому аллелю; N2 – число гетерозигот; n – объем выборки.
Результаты исследования и их обсуждение
Технология трансплантации эмбрионов крупного рогатого скота широко используется по всему миру. Однако вариабельность реакции коров на индукцию суперовуляции продолжает оставаться одной из основных проблем, влияющих на эффективность всей технологии ускоренного воспроизводства крупного рогатого скота. Несмотря на то, что был достигнут значительный прогресс в понимании фолликулогенеза у крупного рогатого скота и были исследованы многие подходы к разработке эффективных протоколов индукции суперовуляции, задача прогнозирования ответа яичников коров на введение гонадотропинов остается нерешенной.
Гены рецепторов фолликулостимулирующего гормона (FSHR), альфа-ингибина (INHA) и прогестерона (PGR) были описаны в качестве предикторов суперовуляции [10]. Также было показано, что три SNP в экзоне 11 гена lhcgr связаны с признаками фертильности крупного рогатого скота, и четыре SNP – G51656T, A51703G, A51726G и G51737A – в интроне 9 гена lhcgr коррелируют с общим количеством яйцеклеток, полученных от коров-доноров голштинской породы после индукции суперовуляции [5, 6, 10]. Таким образом, ген lhcgr, кодирующий LHCGR, является одним из перспективных генетических маркеров репродуктивного статуса крупного рогатого скота.
На сегодняшний день одним из наиболее распространенных методов идентификации аллельных вариантов генов является ПЦР-ПДРФ. Недостатками метода ПЦР-ПДРФ являются его время- и трудозатратность. Метод ПЦР-ПДРФ включает в себя несколько стадий, а именно выделение геномной ДНК; амплификацию полиморфного участка гена; рестрикцию полученных ампликонов специфической рестриктазой; электрофоретическое разделение и анализ образующихся фрагментов ДНК. Основными недостаткамим ПЦР-ПДРФ являются продолжительность, трудоемкость и низкая производительность анализа, а также ненадёжность результатов в случае неоптимального соотношения количества ДНК, рестриктазы и времени рестрикции [11, 12].
Также для идентификации аллельных вариантов генов используют подход на основе комбинации трех методов – ПЦР, анализа конформационного полиморфизма одноцепочечной ДНК (single-stranded conformation polymorphism – SSCP) и прямого секвенирования ДНК. Для выявления аллелей 1401G/T (ss52050737) гена lhcgr крупного рогатого скота методом SSCP на первом этапе анализа амплифицируют содержащий их участок гена lhcgr методом ПЦР с использованием праймеров sense: 5'-GCTCTACCTGCTGCTCAT-3' и anti-sense: 5'-TAATTGCTGACACCCACA-3'. Затем полученные ампликоны анализируют методом SSCP, а именно смешивают с 8 мкл денатурирующего раствора (95 % формамида, 25 ммоль/л ЭДТА, 0,025 % ксилол-цианола, 0,025 % бромфенолового синего), нагревают в течение 10 мин при 98 °С и охлаждают на льду. Денатурированную ДНК подвергают электрофорезу в 13 % полиакриламидном геле (39: 1 акриламид / бисакриламид) в 1×буфере TBE при постоянном напряжении (120 В) в течение 8–10 ч. Гель окрашивают 0,1 % раствором нитратом серебра. На последнем этапе продукты ПЦР с различной электрофоретической подвижностью секвенируют в обоих направлениях [6]. Основными недостатками данного метода являются многостадийность анализа (амплификация полиморфного участка гена; электрофоретическое разделение образующихся фрагментов; секвенирование ДНК), его продолжительность, трудозатратность и относительно высокая стоимость.
Эффективной альтернативой методам ПЦР-ПДРФ и SSCP является ПЦР в реальном времени с использованием аллель-специфичных линейный разрушаемых зондов (TaqMan). В данной работе был разработан метод детекции полиморфизма ss52050737 гена lhcgr крупного рогатого скота на основе ПЦР в реальном времени. В разработанном методе использовали два праймера, общие для обоих аллелей гена lhcgr, и два аллель-специфических зонда TaqMan. С помощью праймеров lhcgr-F:5'-TGAACTCTCTGTCTACACCCTCACA-3' и lhcgr-R: 5'-GCATGACTGGAATGGCATGTT-3' проводят амплификацию фрагмента гена lhcgr длиной 113 п.н. Идентификация аллелей 1401G/T основана на сравнении интенсивности флуоресценции красителей VIC и FAM, которыми мечены зонды lhcgr-G: 5'-(VIC)-CTAGAAAGATGGCACACC-(BHQ1)-3' и lhcgr-T: 5'-(FAM)-CACTAGAAAGATGTCACACC-(BHQ1)-3' соответственно. Анализ результатов генотипирования выполняли с помощью программного обеспечения для амплификатора LightCycler® 96 версии SW1.1 (рис. 1).
Для коров с генотипом ТТ наблюдается рост флуоресцентного сигнала по каналу FAM (рис. 1, А). Для коров с генотипом GG сигнал флуоресцентного регистрировался по каналу VIC (рис. 1, Б). Для гетерозиготных коров (генотип TG) детектируются сигналы по обоим каналам - FAM и VIC (рис. 1, В). Таким образом, результаты ПЦР в реальном времени с использованием аллель-специфичных зондов TaqMan позволяют определять присутствие каждого из исследуемых аллелей 1401G/T гена lhcgr в анализируемом образце ДНК и, соответственно, генотип животного.
Разработанный нами метод на основе ПЦР в реальном времени был валидирован на 195 образцах ДНК коров черно-пестрого голштинизированного скота. Результаты генотипирования показали, что 43,2 % животных являлись носителями обоих аллелей (генотип GT), 15,2 % коров были гомозиготами по аллелю T (генотип TT) и 41,6 % % животных – гомозитотами по аллелю G (генотип GG). Таким образом, в изученной популяции крупного рогатого скота частота аллеля G, связанная с более высокими показателями общего числа ооцитов и числа выживших эмбрионов после трансплантации, а также с наименьшим числом неоплодотворенных ооцитов, составила 63,2 %.
Валидацию разработанного метода проводили с помощью ПЦР-ПДРФ анализа (рис. 2). Для идентификации генотипа каждого животного, продукты ПЦР длиной 340 п.н. обрабатывались эндонуклеазной рестрикцией NmuCI с последующим электрофоретическим разделением в 1,2 % агарозном геле (рис. 2). Наличие аллеля T приводит к появлению сайта рестрикции эндонуклеазы NmuCI. Продукты рестрикции имели следующие размеры: для генотипа GG – 340 п.н., для генотипа TT – 220/120 п.н., для гетерозигот GT – 340/220/120 п.н.
Результаты обоих методов генотипирования полностью совпали. Однако разработанный нами метод позволяет значительно (до 1 ч) сократить время проведения анализа, что выгодно отличает его от ПЦР-ПДРФ анализа и метода SSCP.
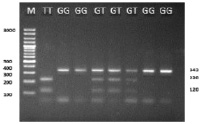
Рис. 2. Пример ПЦР-ПДРФ анализа полиморфизма ss52050737 гена lhcgr крупного рогатого скота
Выводы
Нами разработан эффективный и надежный метод детекции аллельных вариантов 1401G/T (полиморфизм ss52050737) гена lhcgr крупного рогатого скота на основе ПЦР в реальном времени с использованием аллель-специфических флуоресцентно-меченых зондов TaqMan. Данный метод позволяет одновременно проводить генотипирование до 480 животных (в зависимости от модели используемого амплификатора) в течение 1 часа и может применяться для отбора перспективных коров – доноров эмбрионов.

