Обширные и глубокие повреждения кожи при ожоговой травме являются серьезной проблемой для лечения из-за высокого риска инфицирования, значимости пораженной области и потенциального формирования деформаций и контрактур. Основным методом лечения – «золотым стандартом» при лечении дефектов кожи – остается аутодермопластика. Но при обширных поражениях кожи нередко возникает дефицит донорских участков. Для решения этой проблемы предложены методы, основанные на использовании культивированных клеток кожи кератиноцитов и/или фибробластов, мультипотентных мезенхимальных клеток. Биотехнологические методы лечения дефектов кожи интенсивно развивались на протяжении последних десятилетий [1, 2], и этот процесс непрерывно продолжается.
Особое место среди биотехнологических методов лечения пациентов с ожоговыми ранами занимают маломанипуляционные технологии [3]. Этот подход является чрезвычайно привлекательным, так как обладает такими преимуществами, как использование аутологичного клеточного материала, минимальный процессинг с исключением этапов культивирования, незначительное расходование реактивов и сред, исключение ксеногенных добавок. Среди технологий, используемых для лечения дефектов кожи, хорошо известна система ReCell® (Avita Medical Europe Ltd, Мельбурн, Великобритания). ReCell® – специальный комплект, позволяющий собирать аутологичные клетки, выделенные из небольшого образца собственной кожи пациента для создания клеточной суспензии. Технология была разработана и апробирована на модели кожи свиньи [4], а затем использована при лечении пациентов с ожогами. Клетки кожи выделяли с помощью механической дезагрегации с последующей тепловой ферментативной обработкой трипсином и полученную клеточную взвесь трансплантировали на раны при небольших по площади ожогах 2 степени. Сравнив систему ReCell® со стандартной аутодермопластикой, Gravante с коллегами [5] пришли к выводу, что эта технология является осуществимой, простой и безопасной, дающей результаты аналогичные использованию аутодермопластики при ожогах 2 степени. Использование технологии позволяло экономить донорские ресурсы кожи и уменьшало симптомы послеоперационной боли. По мнению Sood R. с коллегами [6], технология ReCell® при лечении острых ожоговых травм была более выгодной, чем аутологичная сетчатая трансплантация, так как обеспечивала уменьшение размера донорских участков с сопоставимым результатом. Однако авторы подчеркивали такие недостатки технологии, как длительность выполнения и высокая стоимость набора. Использование системы «ReCell» в ожоговых центрах России [7, 8] продемонстрировало эффективность и безопасность метода при экономичном использовании донорских ресурсов. Вместе с тем при использовании технологии ReCell®, как и Sood R. с коллегами [6], мы отмечали длительный ферментативный процесс (более 60 мин), что могло затягивать ход операции. Еще одним недостатком, на наш взгляд, была слабая фиксация (стекание) клеточной взвеси с раневого ложа при локализации его на боковых поверхностях тела и/или конечностей, лице и шее.
Для ликвидации указанных недостатков был предложен оригинальный способ лечения ожоговых ран [9]. В основе метода выделение клеток из биоптата кожи с помощью щадящей холодовой трипсинизации и трансплантации полученной клеточной взвеси на раневое ложе с одновременной фиксацией фибриновым клеем.
Дефицит донорских мест при лечении обширных поражений кожи часто приводил к необходимости использования сетчатых аутотрансплантатов с высоким коэффициентом перфорации. В результате нередко наблюдали замедление эпителизации в ячейках трансплантатов, инфицирование, лизис и формирование более грубой рубцовой ткани. Для оптимизации сроков заживления ран при обширных ожогах и улучшения качества восстановленного кожного покрова в условиях дефицита донорских мест мы применили сочетание сетчатого аутотрансплантата с растяжением 1:6 с введением взвеси аутологичных клеток в ячейки аутотрансплантата и одновременной фиксацией клеточной взвеси фибриновым клеем.
Задача исследования: оценить эффективность применения взвеси выделенных с помощью холодовой трипсинизации аутологичных клеток кожи в сочетании с сетчатым 1:6 аутотрансплантатом и фибриновым герметиком при лечении пациентов с ожоговыми ранами II–III степени.
Материалы и методы исследования
В исследование были включены 14 пациентов в возрасте старше 18 лет (11 мужчин и 3 женщины) с ожоговыми ранами II, III степени площадью > 30 % п.т. в среднем 48,0 % п.т. ± 3,35 (33–69 %). Средний возраст пациентов составил 37,4 ± 3,17 (21–69 лет), преобладали люди трудоспособного возраста. Причиной поражения у большинства пострадавших был ожог пламенем и только у одного из пациентов – ожог горячим паром Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО «ПИМУ» Минздрава России № 4 от 25.03.2015. Каждый пациент дал добровольное информированное согласие на участие в исследовании.
Получение, характеристику и подготовку взвеси аутологичных клеток проводили согласно ранее описанному протоколу [10]. Для выделения клеток использовали метод щадящей холодовой трипсинизации. Перед трансплантацией пациентам определяли концентрацию и жизнеспособность клеток взвеси с помощью счетчика клеток «Cauntes», Invitrogen, США. Подсчитывали выход клеток с одного квадратного сантиметра донорского участка. Состав взвеси оценивали, используя метод лазерной проточной цитометрии на цитометре Navios Becman Coulter и с помощью иммуногистохимического исследования.
Для оценки состояния пациента и непосредственно ран использовали клиническое наблюдение, визуальную характеристику раневой поверхности, фотодокументирование, планиметрию, бактериологическое исследование раневого отделяемого. При визуальной оценке состояния раны учитывали наличие или отсутствие пузырей, некрозов, геморрагий, количество и характер раневого отделяемого, наличие или отсутствие эпителизации, состояние окружающих тканей.
В связи с тяжестью травмы и поздним поступлением из отдаленных регионов страны у большинства пациентов общее состояние было тяжелым, что потребовало проведения интенсивной инфузионно-трансфузионной терапии, антибиотикотерапии, подготовки раневой поверхности. Поэтому операцию аутодермопластики с трансплантацией аутологичных клеток проводили в поздние сроки – в среднем через 16,4 дней (от 10 до 30 дней) после травмы. Подготовленную взвесь клеток трансплантировали через 24–48 ч после забора биоптата неповрежденной аутокожи.
С целью подготовки ожоговой раны выполняли оперативные вмешательства – некрэктомию на площади от 5 % до 20 % поверхности раны с последующим тщательным гемостазом. Трансплантацию клеток проводили на раневое ложе после некрэктомии или на гранулирующие раны. Раны были выполнены мелкозернистыми ярко-красными грануляциями. Перед трансплантацией аутокожи и клеточной взвеси раневую поверхность тщательно промывали дезинфицирующими растворами. С неповрежденных участков кожи электродерматомом забирали трансплантаты толщиной до 0,35 мм, перфорировали в соотношении 1:6 и укладывали на подготовленные раневые поверхности. Поверх сетчатых трансплантатов наносили взвесь аутологичных клеток. Для фиксации клеток на ране осуществляли распыление двухкомпонентного фибринового герметика («Тиссукол» или «Ивицел»), характеризующегося коротким периодом полимеризации (30–40 с). Сверху рана укрывалась силиконовым инертным покрытием «MEPITEL» (Швеция) и повязкой с физиологическим раствором. Покрытие «MEPITEL» было выбрано на основании опыта применения и исследования взаимодействия с культурами клеток кожи в лаборатории Университетской клиники. Это покрытие биологически инертно, не подавляет пролиферацию клеток кожи в системе in vitro, отличается значительной скважностью.
Первую перевязку после трансплантации клеток выполняли на 3–6 день. Состояние раны оценивали через прозрачное покрытие, которое не удаляли, поэтому раневая зона не травмировалась. При удовлетворительном течении раневого процесса покрытие не меняли. Если были отмечены нежелательные явления (обильная экссудация, сниженная жизнеспособность или механическое повреждение трансплантатов) или, напротив, фиксировали эпителизацию значительной площади ран, покрытие удаляли. Следующую перевязку проводили на 10–14 день и, как правило, покрытие удаляли полностью. Пациентов считали стабильными и готовыми к выписке, если при общем удовлетворительном состоянии раневая поверхность была эпителизирована более чем на 90 % и отсутствовали признаки инфицирования и лизиса трансплантатов.
В течение 12 месяцев после окончания стационарного лечения пациентов курировали сотрудники ожогового центра. Контрольные осмотры осуществляли через 6 и 12 месяцев. Состояние восстановленного кожного покрова оценивали по Ванкуверской шкале оценки рубцов (Vancouver Scar Scale).
Результаты исследования и их обсуждение
Выход клеток с одного квадратного сантиметра донорского биоптата составил 5,95 млн/см2 ± 0,88 (1,5–16,6 млн/см2), из них жизнеспособных клеток было 66,39 % ± 3,47 (48–93 %). Только в одном образце взвеси количество жизнеспособных клеток было менее 50 % (48 %). От 80 до 93 % клеток были цитокератинположительны, 7–20 % клеток положительны по типичным маркерам мезенхимальных клеток (CD90+, CD105+, CD73+, CD10+), маркеры гемопоэтических клеток CD45+, CD14+,CD HLA-DR+, CD 34+ экспрессировали не более чем 3–4 % клеток взвеси.
Клиническое наблюдение показало, что эпителизация раневой поверхности в ячейках трансплантатов наступала на 6–14 день после операции. Пациенты не отмечали дополнительного дискомфорта, связанного с локализацией примененной методики, по сравнению с классическими методами аутодермопластики. Не было выявлено случаев прогнозируемых осложнений в виде присоединения инфекции, реакций индивидуальной гиперчувствительности, объемного лизиса аутотрансплантатов, замедленной эпителизации. Восстановленная поверхность кожного покрова после трансплантации аутологичных клеток имела физиологичную окраску с небольшими хаотично расположенными участками розового оттенка. Рельеф кожи повторял ячеистую структуру аутотрансплантатов, при пальпации кожные покровы были мягкими, безболезненными, объем движений не ограничивался. Представленные результаты продемонстрировали, что разработанная технология характеризовалась низким уровнем опасности возникновения прогнозируемых и непрогнозируемых нежелательных осложнений, эффективностью при лечении термических ожогов II–III степени различных локализаций, позволила восстановить целостность кожного покрова в кратчайшие сроки и значительно уменьшить объем донорских тканей.
При катамнестическом наблюдении через 12 месяцев у 18 пациентов по Ванкуверской шкале состояние рубцов – 2 балла, у двух пациентов – 3 балла. Средний показатель составил 2,1 балла по Ванкуверской шкале.
Клинический пример. Пациент «А», возраст 53 года, получил травму в быту, в результате взрыва газобаллонного оборудования. Диагноз при поступлении: ожог пламенем I–II–III степени головы, туловища, конечностей на площади 70 % поверхности тела. Термоингаляционная травма. Экстренно был доставлен в районную многопрофильую клинику, где оказали первую медицинскую помощь. На 5-е сутки после травмы был переведен наземным транспортом в ожоговый центр университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России, где проводилось специализированное лечение до момента восстановления кожного покрова. За время лечения пациент получал поликомпонентную инфузионную терапию, включающую коллоидные и водно-электролитные растворы, трансфузии плазмы и эритроцит-содержащих сред, антибактериальную терапию препаратами широкого спектра действия с учетом выделенной микрофлоры и её чувствительности. Ему было выполнено 4 этапных тангенциальных некрэктомии и 2 операции свободной кожной пластики, с использованием трансплантации аутологичных клеток, на раны общей площадью 4200 см2. Трансплантацию клеток проводили на 10 и 16 день после травмы. Общий срок лечения в стационаре составил 71 день.
В процессе операции клеточную суспензию наносили непосредственно на рану, в ячейки аутотрансплантатов (рис. 1). Фиксацию взвеси аутоклеток осуществляли с помощью поверхностного распыления двухкомпонентного фибринового клея «Ивицел». Оперативное пособие завершилось наложением повязки «Мepitel» (рис. 2).
Первую перевязку выполнили на 5 день после операции и оценивали состояние раны через прозрачное покрытие. Так как отсутствовали прогнозируемые нежелательные явления (обильная экссудация, сниженная жизнеспособность или механическое повреждение трансплантатов), покрытие было удалено (рис 3). На раневую поверхность наложили мазевую повязку. Следующую перевязку проводили на 10 день. Кожный покров был полностью восстановлен, сохранялись сухие корочки, был виден рельеф сетчатого трансплантата. Повязка удалена (рис. 4).
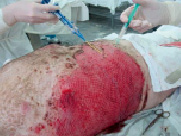
Рис. 1. Гранулирующая рана, трансплантация сетчатого трансплантата 1:6, взвеси клеток и клея
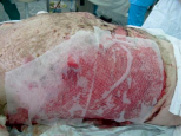
Рис. 2. Рана под покрытием
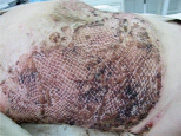
Рис. 3. Раневая зона после удаления покрытия, 5 сутки после трансплантации клеток
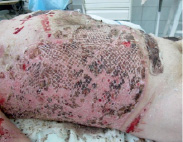
Рис. 4. Состояние восстановленного кожного покрова на 10-й день после трансплантации аутоклеток
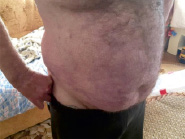
Рис. 5. Восстановленная кожа через 12 месяцев после трансплантации аутоклеток
В течение 12 месяцев после окончания стационарного лечения, пациента «А» курировали сотрудники ожогового центра. Контрольные осмотры осуществляли через 6 и 12 месяцев. Через 6 месяцев раневая зона была полностью эпителизирована, рельеф восстановленной кожи повторял ячеистую структуру аутотрансплантата. Образовавшиеся рубцы были локализованы хаотично на всей площади поверхности, на которой была выполнена трансплантация взвеси аутологичных клеток. Рубцы были фиброзными нормотрофическими, гладкими, бледно-розовыми. Поверхность восстановленной кожи неравномерно окрашена, фиксировалось наличие участков с выраженной пигментацией. При пальпации рубцовые ткани были несколько плотнее интактных кожных покровов, мягкими, эластичными, легко поддавались сдавлению, не препятствовали активным движениям. Состояние кожного покрова по Ванкуверской шкале – 2 балла.
Через 12 месяцев рельеф кожи повторял ячеистую структуру аутотрансплантата, но был более сглажен, чем при предыдущем осмотре (рис. 5). Небольшое количество рубцовых образований было локализовано хаотично по всей площади поверхности, выполненной трансплантации аутологичных клеток. Рубцы были представлены нормально пигментированными тканями с мозаичными участками с усиленной ярко-розовой пигментацией. При пальпации рубцовые ткани были несколько плотнее интактной кожи, мягкими, эластичными, легко смещались и не препятствовали активным движениям. Некоторые рубцовые образования имели неровный рельеф и возвышались над поверхностью кожи более чем на 1 мм. Состояние кожи по Ванкуверской шкале – 3. Видимые признаки формирования рубцовых деформаций и контрактур отсутствовали.
Таким образом, использование щадящего метода холодовой трипсинизации позволило увеличить выход клеток с 1 см2 кожи [10] и варьировать время использования клеточной взвеси от 24 до 48 ч после забора биоптата. Полученное количество выделенных жизнеспособных клеток кожи не уступает данным, представленным в литературе [11]. Аутологичная клеточная взвесь состояла из клеток эпидермиса (до 80 %) и клеток дермального слоя (фибробластов) – 7–20 %. Известно, что для полноценного восстановления поврежденной кожи необходимо взаимодействие клеток ее обоих слоев: и эпидермиса, и дермы. В процессе восстановления повреждений кожи наблюдается двойной паракринный эффект: эпидермоциты продуцируют факторы, активирующие синтез фибробластами факторов роста, которые в свою очередь стимулируют пролиферацию кератиноцитов. Оба типа клеток способствуют синтезу макромолекул базальной мембраны. Фибробласты производят коллаген типа IV и VII, ламинин 5, нидоген и трансформирующий фактор роста бета (TGF-b), который в свою очередь стимулирует кератиноциты синтезировать коллаген типа IV и VII. Показано [12], что в свежевыделенной клеточной взвеси повышено содержание прогениторных клеток, по сравнению с клетками, которые культивировали in vitro. Высокая жизнеспособность клеток взвеси обеспечивала лучшее качество клеточного материала. Можно предполагать, что сочетание аутологичной свежевыделенной клеточной взвеси с фибриновым герметиком создавало оптимальные условия для восстановления дефектов кожи. Известно, что фибриновые клеи активно используются в восстановительной терапии различных тканей и могут служить матрицей при культивировании, как фибробластов, так и кератиноцитов [13]. Использование фибринового клея, по нашему мнению, предотвращало «стекание» трансплантированных клеток с проблемных участков раневой поверхности, обеспечивало гемостаз и создавало оптимальные условия не только для выживания, но и для пролиферации и миграции клеток с периферии раневого ложа (в данном случае с сетчатого аутотрансплантата). Наличие дермальных фибробластов, в свежевыделенной клеточной взвеси, способствовало миграции кератиноцитов с периферии раны, увеличивало секрецию фактора роста эндотелия сосудов (VEGF) и способствовало миграции эндотелиальных клеток.
Таким образом, раневая поверхность выступала как естественный «биореактор», а каждая клетка могла дать начало новой клеточной популяции. Аналогичные результаты описывали в своих работах Esteban-Vives R. с коллегами [14]. Используя двухэтапную ферментацию диспазой и трипсином, они выделяли клетки как эпидермиса, так и дермы и распределяли полученную взвесь на раневую поверхность. Двухэтапное ферментирование позволяло использовать технологию ex tempore, что удобно при раннем поступлении пациентов. Однако авторы указывали, что при двухэтапной ферментации процедура выделения клеток была достаточно продолжительна и занимала от 70 до 90 мин. В представленном нами исследовании рассматривали случаи с поступлением пациентов с ожоговой травмой, как правило, в поздние сроки после инцидента. В такой ситуации (перевод из других клиник) часто возникала необходимость проведения предварительной инфузионно-трансфузионной терапии и /или подготовки раневого ложа до оперативного вмешательства. При таком варианте истории пациента было удобно иметь возможность подготовить клеточный материал заранее (за 1–2 суток) и использовать его на операции, не увеличивая ее продолжительность за счет времени подготовки клеточной взвеси.
Заключение
Описанная технология продемонстрировала эффективность при лечении пациентов с обширными ожоговыми ранами 2–3 степени и может быть реализована в любом хирургическом стационаре при проведении минимальных организационных мероприятий и обучении специалистов. Методика проста в выполнении, не требует сложного оборудования и дорогостоящих реактивов.
Можно обоснованно полагать, что использование некультивированной аутологичной клеточной взвеси как самостоятельно, так и в сочетании с традиционными способами лечения ожоговых ран или другими биотехнологическими методами, найдет место в структуре комплексного лечения дефектов кожи различной этиологии, особенно у пациентов, получивших критические и сверхкритические ожоги.

