К числу наиболее распространённых патологий костно-мышечной системы относятся дегенеративно-дистрофические заболевания (ДДЗ) синовиальных суставов, среди которых лидирующее место занимает диспластический коксартроз (ДКА) [1, 2]. Данное заболевание логично рассматривать как первично системное изменение метаболического профиля, приводящее к формированию дегенеративно-дистрофического процесса в тазобедренном суставе [3]. Из данных литературы известно, что нарушения метаболизма при ДКА связаны с вовлечением в процесс иммунологических структур и в конечном итоге изменением иммунологической реактивности организма [4, 5]. Полученные ранее нами данные показали, что в зависимости от степени выраженности иммунологических расстройств пациенты с ДКА на его поздних стадиях неоднородны и с помощью кластерного анализа разделяются на две группы [6, 7]. Основные отличия, характеризующие исследуемые группы и определяющие характер и выраженность иммунных нарушений у пациентов 1-й группы заключались в снижении клеток Т-ряда, а также концентрации сывороточного иммуноглобулина А (IgA). У пациентов 2-й группы, напротив, отмечалось увеличение различных субпопуляций Т-лимфоцитов и уровня IgA, а также разнообразные комбинации нарушений функциональной активности клеток иммунной системы. В этой же группе пациентов отмечен вклад аутоиммунного компонента в патогенез заболевания. Выявленные особенности иммунного статуса у пациентов с коксартрозом позволили нам условно выделить «компенсированную форму иммунодефицитного состояния» (КФ ИДС – 1-я группа) и «субкомпенсированную форму ИДС» (СКФ ИДС – 2-я группа).
В связи с тем, что консервативное лечение ДДЗ тазобедренного сустава при далеко зашедшем процессе не дает выраженного эффекта, основным методом лечения является оперативный. При этом тотальное эндопротезирование тазобедренного сустава (ТЭТС) зарекомендовало себя как метод выбора в решении проблемы оказания действенной помощи больным с тяжелыми формами коксартроза. [8]. Однако, как и любое хирургическое вмешательство, операция эндопротезирования оказывает выраженное супрессивное воздействие на иммунную систему пациента, что на фоне, как правило, уже имеющихся нарушений приводит к усугублению иммунологической дисфункции и снижению адаптационного потенциала [9]. Поэтому проблемы адаптации организма в послеоперационном периоде заслуживают особого внимания, поскольку во многом определяют течение восстановительного процесса и, как следствие, результат хирургического лечения.
Цель работы: оценить адаптивные свойства факторов иммунной системы у пациентов с коксартрозом в зависимости от степени компенсации иммунодефицитного состояния после тотального эндопротезирования тазобедренного сустава.
Материалы и методы исследования
Работа основана на результатах обследования и лечения 73 пациентов с диагнозом «диспластический коксартроз», подписавших информированное согласие на участие в исследовании. Диагноз устанавливался на основании клинико-рентгенологических критериев. Тяжесть процесса у всех больных, включенных в исследование, соответствовала коксартрозу III стадии. В первую клиническую группу (КФ ИДС) вошли 46 пациентов (средний возраст 45,5 ± 1,5), из них лиц женского пола – 27 (58,7 %), мужского – 19 (41,3 %). Вторую клиническую группу (2-я группа) составили 27 пациентов (средний возраст 47,1 ± 2,3), лиц женского пола – 14 (51,9 %), мужского – 13 (48,1 %). Суммарный показатель правильной классификации (СПК) составил 97 %, что является высоким значением дифференциации исследуемых групп.
Оценивали фенотипический состав лимфоидных клеток (CD3+, CD4+, CD8+, CD16+, CD21+, CD95+) методом проточной цитофлуорометрии на цитометре фирмы «Coulter» (Франция) с использованием моноклональных антител (ООО «Сорбент»); концентрацию иммуноглобулинов классов G, А, М определяли методом иммуноферментного анализа (ЗАО «Вектор-Бест», Новосибирск); содержание циркулирующих иммунных комплексов (ЦИК) определяли в сыворотке крови методом осаждения полиэтиленгликолем с молекулярной массой 6000; оценку миграционной активности лейкоцитов проводили в реакции торможения миграции лейкоцитов с хондроитинсульфатом (РТМЛхс). Фагоцитарную активность нейтрофилов периферической крови определяли по их способности поглощать частицы латекса диаметром 1,66 мкм. Подсчитывали процент активных фагоцитов (ФП). Метаболическую активность нейтрофилов оценивали в тесте восстановления нитросинего тетразолия в спонтанном (НСТ спонт.) и стимулированном зимозаном вариантах (НСТ стим.). Концентрацию цитокинов (IL-1β, TNFα, IL-2, IL-4, IF-γ) определяли в стандартной культивационной среде и при стимуляции митогенами методом твердофазного иммуноферментного анализа (тест-системы «Протеиновый контур», Санкт-Петербург). В качестве митогенов использовали фитогемагглютинин (ФГА) в концентрации 20 мкг/мл и липополисахарид (ЛПС) в концентрации 10 мкг/мл («Sigma», USA). Сроки культивирования определялись максимумом продукции исследуемых цитокинов in vitro: для TNFα – 3 ч; для IL-1β, IL-2, IL-4 – 24 ч, для IFγ – 48 ч. Для каждого исследуемого цитокина высчитывали индекс стимуляции (ИС) – соотношение стимулированной продукции цитокина к его спонтанному уровню. Исследования проводились до операции, на 3-и, 10-е и 21-е сутки послеоперационного периода.
Статистическую обработку и анализ результатов проводили по общепринятым математическим алгоритмам с использованием пакета прикладных программ Statistica 6.0 и математического пакета «Mathcad-2001, Pro».
Результаты исследования и их обсуждение
Иммунная система человека, как часть общей системы, поддерживающей гомеостаз и выполняющей функции адаптации, постоянно находится в функционально активном состоянии и реагирует на любые внешние и внутренние воздействия. От её состояния в немалой степени зависят характер течения восстановительного процесса в послеоперационном периоде и в целом результат хирургического лечения. При анализе реакций иммунной системы наряду с количественными характеристиками основных компонентов важно учитывать её качественные свойства. К числу таких качественных свойств относят устойчивость или неустойчивость различных биологических систем при воздействии на них внешних или внутренних факторов. Важность использования методов качественного анализа при изучении динамики биологических систем убедительно доказана в работе Л. Глас и М. Мэки [10]. Они дают дополнительную информацию о степени выраженности и патогенетической сущности реакций адаптивного или дизадаптивного значения, а также выявляют их наиболее слабое или напряжённое звено. В данной работе нами была предпринята попытка формализовать поведение факторов иммунной системы в плане выявления общих закономерностей в изменении качественных свойств в ответ на оперативное вмешательство у больных как с «компенсированной», так и с «субкомпенсированной» формами ИДС.
Поскольку поведение биологических систем обычно описывается нелинейными дифференциальными уравнениями, не имеющими аналитических решений, качественные свойства этих нелинейных уравнений обычно выявляют, не решая их явно. С учётом полученных нами результатов в разные сроки наблюдения мы посчитали наиболее уместным использовать изучение характера поведения различных факторов путём решения обыкновенных дифференциальных уравнений автономной или динамической системы, где независимая переменная (t) не входит явно в эту систему, а производная dx/dt зависит только от x. При этом любая нормальная система, состоящая, например, из двух уравнений, может быть преобразована в динамическую или автономную систему если
dx/dt = f(t, x),
где dx1/dt = f1(x1, x2);
dx2/dt = f2(x1, x2).
Тогда решение системы уравнений – x1 = j1(t), x2 = j2(t) – задаётся в параметрической форме либо в виде фазовой траектории на плоскости x1, x2, либо в трёхмерном пространстве переменных x1, x2, t – в виде интегральной кривой, по характеру которых можно оценить состояние динамической системы. Кроме того, характер устойчивости автономной системы в ответ на её возмущение можно установить по действительным числам собственных значений матрицы автономной системы [11]. Если собственные значения матрицы λ1,2 системы двух дифференциальных уравнений примут значения комплексных чисел, то точка покоя будет асимптотически устойчива – Reλ1,2 < 0 или неустойчива при Reλ1,2 > 0. В том случае, когда собственные значения матрицы λ1,2 примут значения действительных чисел и λ1,2 < 0, тогда интегральная кривая будет выглядеть в виде устойчивого узла, а при λ1,2 > 0 – в виде неустойчивого узла. В первом случае поведение системы носит устойчивый, а во втором – неустойчивый характер. Если собственные значения матрицы λ1,2 покажут значение действительных чисел, но имеющих разные знаки, то такая система дифференциальных уравнений является неустойчивой и будет выглядеть в виде асимптоты.
Иными словами, если в условиях ДКА автономная система после оперативного вмешательства будет стремиться к устойчивому состоянию (или точке покоя), то это, скорее всего, будет указывать на её способность адаптироваться в новых условиях функционального состояния организма. И, наоборот, отсутствие способности системы адаптироваться к этим условиям будет отражаться в виде её неустойчивого поведения.
Для исследования адаптивных свойств различных факторов иммунной системы у больных с КФ и СКФ ИДС в ответ на оперативное вмешательство мы использовали для каждой из них следующую систему линейных уравнений:
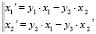
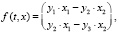
где f(t, x) – вектор-функции правой части системы, в которой y1 = u – v, y2 = v – w, y3 = w – z; средние показатели: u – в исходном состоянии, v – на 3-и сутки, w – на 10-е сутки, z – на 21-е сутки после операции.
Таким образом, в качестве коэффициентов уравнений выступала разница между предыдущим и последующим сроком наблюдения, а для начальных условий использовался средний показатель в исходном состоянии. Нами исследовалась динамика изменений исследуемых иммунологических факторов, которые условно будем обозначать как «системы». Расчёты проводились с помощью математического пакета «Mathcad-2001, Pro», в которых применялись данные в абсолютных величинах.
На рис. 1, a, в качестве примера показано состояние системы CD4+ у пациентов с КФ ИДС после ТЭТС. На основании результатов решения системы дифференциальных уравнений видно, что интегральная кривая отражает «асимптотически устойчивый фокус», следовательно, динамическая система в целом за весь период после операции стремилась к устойчивому состоянию, т.е. автономная система CD4+ у пациентов данной группы способна адаптироваться к новым условиям функционального состояния организма. В то же время у пациентов с СКФ ИДС интегральная кривая отражала «неустойчивый фокус», следовательно, динамическая система в целом за весь наблюдаемый период находилась в неустойчивом состоянии (рис. 1, б). Это указывает на отсутствие способности автономной системы CD4+ адаптироваться к новым условиям.
В табл. 1 показаны сводные результаты поведения исследуемых систем в обеих группах больных. Как видно из таблицы, реакция этих систем у пациентов с КФ ИДС носила преимущественно устойчивый, т.е. адаптивный характер, у пациентов с СКФ ИДС – неустойчивый характер.
Кроме того, был проведён расчёт времени, в пределах которого автономные системы пациентов с КФ и СКФ ИДС в послеоперационном периоде могли достигать ожидаемой точки покоя. Для этого использовались математические модели полиномиальной или линейной регрессии. Например, на рис. 2 показано, что ожидаемая точка покоя y(r) системы CD4+ у пациентов с КФ ИДС определялась на 37-е сутки (r) после операции, что указывало на способность данной системы адаптироваться к новым условиям в пределах отмеченного срока.
Сводные данные о времени достижения ожидаемой точки покоя автономных систем показали, что у пациентов с КФ ИДС большинство исследуемых систем адаптируются в пределах 27–37 суток (табл. 2), что свидетельствует о включении функциональных резервов иммунной системы и, следовательно, о способности адаптироваться в пределах указанного промежутка времени.
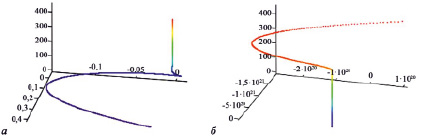
Рис. 1. Состояние автономной системы CD4+ у пациентов c КФ ИДС (a) и СКФ ИДС (б) после тотального эндопротезирования тазобедренного сустава
Таблица 1
Качественные свойства поведения различных автономных систем у пациентов с КФ и СКФ ИДС после ТЭТС
|
Автономные системы |
Характер поведения автономных систем |
|||
|
пациенты с КФ ИДС |
пациенты с СКФ ИДС |
|||
|
CD4+, CD8+, СD3+, CD21+, CD95+ |
устойчивые фокусы |
устойчивый |
неустойчивый фокус, асимптоты |
неустойчивый |
|
ЦИК |
асимптота |
неустойчивый |
устойчивый узел |
устойчивый |
|
IL-1βст. |
устойчивые фокусы |
устойчивый |
асимптота |
неустойчивый |
|
INFγсп. |
неустойчивый узел |
|||
|
INFγст. |
асимптота |
неустойчивый |
устойчивый фокус |
устойчивый |
|
НСТст. |
устойчивый фокус |
устойчивый |
неустойчивый узел |
неустойчивый |
|
РТМЛ хс |
неустойчивый фокус |
неустойчивый |
устойчивый фокус |
устойчивый |
Примечание. В таблице показаны результаты, которые отражали только неоднородный характер поведения автономных систем, выявленный в обеих группах больных.
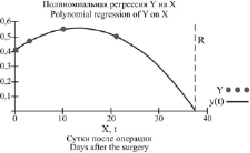
Рис. 2. Результат полиномиальной регрессии 3-й степени системы CD4+ у пациентов с КФ ИДС
Таблица 2
Сводные данные о времени достижения ожидаемой точки покоя адаптивных систем, выявленных у пациентов с КФ ИДС после ТЭТС
|
Система |
Средний уровень исследуемых показателей |
Время достижения точки покоя |
R2 |
|||
|
исход |
3-и сутки |
10-е сутки |
21-е сутки |
|||
|
CD3+ |
0,83 |
0,87 |
0,96 |
0,85 |
32-е сутки |
1,00 |
|
CD4+ |
0,41 |
0,47 |
0,55 |
0,50 |
37-е сутки |
1.00 |
|
CD8+ |
0,33 |
0,34 |
0,36 |
0,32 |
34-е сутки |
1,00 |
|
CD21+ |
0,16 |
0,18 |
0,21 |
0,19 |
35-е сутки |
1,00 |
|
CD95+ |
0,07 |
0,08 |
0,11 |
0,10 |
29-е сутки |
1,00 |
|
IL-1βст. |
3058 |
3671 |
4836 |
4309 |
30-е сутки |
1,00 |
|
INFγсп. * |
56 |
65 |
52 |
26 |
27-е сутки |
0,955 |
|
НСТст. * |
1,48 |
1,56 |
1,36 |
1,2 |
59-е сутки |
0,891 |
Примечание. * – полиномиальная регрессия 2-й степени, остальные – 3-й степени; R2 – коэффициент детерминации.
Таблица 3
Сводные данные о времени достижения ожидаемой точки покоя адаптивных систем, выявленных у пациентов с СКФ ИДС после ТЭТС
|
Система |
Средний уровень исследуемых показателей |
Время достижения точки покоя |
R2 |
|||
|
исход |
3-и сутки |
7–10-е сутки |
21-е сутки |
|||
|
ЦИК |
210 |
217 |
224 |
203 |
43 сутки |
1,00 |
|
INFγст. ** |
191 |
204 |
76,8 |
15,4 |
24 сутки |
0.930 |
|
РТМЛхс* |
0,985 |
0,925 |
0,547 |
0,484 |
38 сутки |
0,845 |
Примечание. * – полиномиальная регрессия 2-й степени, остальные – 3-й степени; ** – линейная регрессия; R2 – коэффициент детерминации.
В группе пациентов с СКФ ИДС только три автономные системы адаптируются в сроки от 24 до 43 суток (табл. 3). Следовательно, адаптивные возможности автономных систем у пациентов данной группы существенно ограничены. В данном случае можно говорить о пределе функциональных возможностей и, соответственно, о превалировании патогенетических механизмов над саногенетическими, что обусловливает значительно более длительный восстановительный период в данной группе пациентов.
Заключение
Выявленные закономерности в изменении качественных свойств факторов иммунной системы в ответ на оперативное вмешательство у пациентов с коксартрозом в зависимости от степени компенсации ИДС позволяют оценить её адаптационные возможности и дают прогностически важную информацию о характере течения восстановительного процесса после операции. В нашем исследовании изучение качественной характеристики поведения различных «иммунологических систем» в ответ на оперативное вмешательство показало, что реакция этих систем у пациентов с КФ ИДС носила преимущественно адаптивный характер, что свидетельствует об их способности адаптироваться к новым условиям функционального состояния организма. В то же время у пациентов с СКФ неустойчивый характер реакций автономных систем и длительный период достижения ожидаемой точки покоя указывают на отсутствие способности их адекватно адаптироваться в послеоперационном периоде. Данное направление открывает перспективу для разработки и использования программ предоперационной подготовки и послеоперационной реабилитации данной категории пациентов с использованием препаратов, нормализующих иммунологический гомеостаз.

