Полифункциональные полимерные материалы, благодаря наличию различных функциональных групп в макромолекуле, обладают комплексом полезных свойств и находят широкое применение в различных областях современной техники. Применение реакционноспособных олигомеров или макромономеров (МкМн) в качестве мономеров позволяет получить высокомолекулярные соединения с гораздо высокой степенью функциональности, способствующей к дальнейшим химическим превращениям в сравнительно мягких условиях [1, 2]. Такой способ производства полимерных материалов или непосредственно изделий обладает рядом преимуществ перед использованием мономеров. Среди новых технологий наиболее прогрессивными и интенсивно развивающимися являются способы формирования полимерных материалов, в том числе полимерных пленок и покрытий методами электрополимеризации мономеров при электрохимическом инициировании и поликонденсации. Главное преимущество электрохимических методов заключается в их одностадийности, а именно, возможности исключения из технологической схемы этапов предварительного синтеза полимерного вещества, его последующее растворение или диспергирование и фиксацию на подложке, объединяя все эти стадии в одном процессе [3]. Работа посвящена фотоэлектрохимическому (ФЭХ) синтезу и исследованию ММР полифункциональных олигомеров на основе функционализированного полиаминотиокарбамида (ПАТК) методом ЭЖХ. При этом многофункциональный характер МкМн позволяет в условиях ФЭХ инициирования в широком диапазоне варьировать состав и свойства получаемых олигомеров [4].
Материалы и методы исследования
Синтез исходного нефункционализированного ПАТК олигомера в различных мольных соотношениях осуществлен при 120–140 °С, а функционализированные олигомеры в сравнительно низких температурах (80–90 °С) в течение 3–4 ч. Реакцию провели в стеклянном термостатируемом реакторе, снабженном мешалкой и капельной воронкой в атмосфере сухого азота [5]. В качестве аминов в работе использован полиэтиленполиамин с ММ-150, соответствующей триэтилентетраамину и гексаметилендиамину.
МкМн получены вводом в состав исходного ПАТК (гексаметилендиаминтиокарбамид, Mn = 320) функциональных заместителей, содержащие в структуре двойные связи, сложноэфирные и кетонные группы, а также хлор. Олигомеризация МкМн осуществлена методом электролиза в водном растворе хлористого натрия при облучении реакционной зоны видимым светом с использованием лампы накаливания мощностью 500 Вт (анодом и катодом служил графит) [6]. Электролитом служил водный раствор хлористого натрия (4 %). Исследуемые МкМн, растворенные в ДМФА, вместе с фоновым электролитом помещали в электролизер, снабженный катодом и анодом из графита. С облучением реакционной зоны видимым светом процесс олигомеризации осуществляли при температуре в пределах 40–50 °С и плотности тока i = 0,15А/см2. Продолжительность реакции составляла от 8 до 10 ч.
Строение полученных олигомеров, представляющих собой густые жидкости от светло-коричневого до темно-коричневого цвета, определено методом ИК-спектроскопии на ИК-Фурье спектрометре фирмы Perkin Elmer.
Содержание функциональных групп NH2 и OH определяли элементным анализом и по методике [7]. ММ и параметры ММР синтезированных продуктов были определены методом ЭЖХ на высокоэффективном жидкостном хроматографе фирмы Kovo (Чехия) c рефрактометрическим детектором. Использованы две колонки размером 3,3×150 мм, заполненные неподвижной фазой Separon-SGX с размером частиц 7 мкм и пористостью 100 A. Элюент-ДМФА (х.ч., nd20 = 1,4300, Ткип = 153 °С) скорость потока 0,3 мл/мин. Т = 20–25 °С. Калибровочную зависимость lgM от VR в диапазоне М = (1,5 – 100)×102, описывающаяся уравнением VR = C1 – C2lgM, где С1 = 24,4, С2 = 4, получали с использованием ПЭГ стандартов. Интерпретацию хроматограмм выполняли по методике [8]. Содержание связей C=C установлено методом озонирования на приборе АДС-4.
Среднечисленную функциональность fn по указанным группам вычисляли по формуле fn = Mn/Мэ по методике [2]. Mn – суммарная ММ олигомеров I, II, III и IV. Величину Мэ (эквивалентная ММ) получали из соотношения F•100/g – где F соответствует ММ функциональным группам NH2, OH и связей C=C, равными – 16, 17 и 26 соответственно, g – содержание указанных групп.
Величины степени полимеризации P вычислены по ММ олигомеров I, II, III и IV (таблица, образцы 1, 3, 5 и 7) по формуле: Мw/M и Mn/M – где значения М равны Mn исходных МкМн I, II, III и IV (таблица, образцы 2, 4, 6 и 8) и близки к теоретическим.
Результаты исследования и их обсуждение
Разработан процесс ФЭХ синтеза полифункциональных олигомеров на основе функционализированных ПАТК, содержащие двойные связи, сложноэфирные, кетонные, гидроксильные, первичные аминные группы, а также тиокарбамидные и тиолевые группы, находящиеся в таутомерном равновесии со следующей структурой:
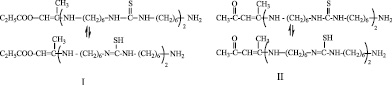
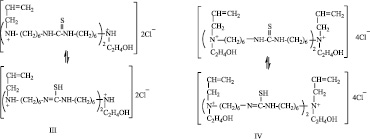
Реакция олигомеризации осуществлена при ФЭХ воздействии на указаннные МкМн, путем облучения реакционной зоны видимым светом. При этом происходит инициирование их строго по двойным связям, раскрытие которых приводит к образованию реакционных центров. В этом случае образуются сополимеры с чередующимся распределением макромономерных звеньев в цепи. Ход реакции схематически можно представить в следующем виде. Так, в первых трех случаях, когда МкМн характеризуются наличием одного активного центра по двойной связи, рост олигомерной цепи происходит по следующей схеме:
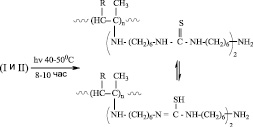
где (I) R=CH3CO- (II) R=C2H5COO-
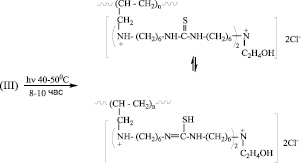
А в последнем случае, когда в состав МкМн входят две двойные связи, с образованием двух активных центров, рост олигомерной цепи происходит по двум центрам. В этом случае схему реакции можно представить в следующем виде:
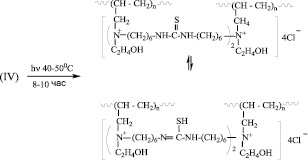
Ниже в табл. 1 и на рисунке представлены результаты ЭЖХ исследований молекулярной характеристики исходных МкМн и ММР наиболее характерных продуктов их олигомеризации.
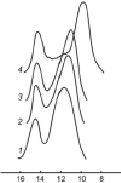
Эксклюзионные кривые ММР продуктов ФЭХ олигомеризации ПАТК. Кривые 1, 2, 3 и 4 – макромономеры I, II, III и IV соответственно. Условия хроматографирования: Колонки размером 3.3×150 мм, адсорбент: Separon-SGX с размером частиц 7 мкм и пористостью 100 A. Элюент-ДМФА, скорость потока 0,3 мл/мин. Детектор – рефрактометрический. Т = 20 –25 °С. 1 счет = 0,13 мл
Из представленных данных видно, что во всех случаях полученные олигомеры характеризуются близкими значениями полидисперсности, меняющимися в пределах 1,97–3,17. Сравнительно высокая полидисперсность олигомеров, как следует из этих данных, связана с их бимодальным составом, состоящим из примерно 60–70 % олигомера и 25–35 % исходного мономера.
Выявлено, что в указанных ФЭХ условиях олигомеризация начинается лишь после двух часов, и в течение восьми часов около 65–75 % количества исходных МкМн превращается в олигомер. Показано, что суммарные ММ олигомеров меняются в пределах 1340–6150 (Мw) и 700–1600 (Mn). Однако в отдельности олигомеры характеризуются довольно высокими ММ, колеблющихся в интервале 1780–7940 (Мw) и 1240–6850 (Mn) (табл. 1, образцы 2, 4, 6 и 8, рисунок, кривые 1–4). Фракция, обнаруживаемая в низкомолекулярном участке хроматограммы состоит из исходного мономера с ММ 320–380 (Мw) и 290–340 (Mn), часть которого образуется при деструкции с отщеплением их от макроцепи.
В отличие от значения VR олигомерной фракции, максимумы фракции исходного мономера не меняются (VR = 14,25). При этом установлено, что изменения осуществляемые в условиях проведения процесса влияют только на их количество в составе образующихся продуктов, т.е. в сравнительно мягких ФЭХ условиях увеличивается лишь количество олигомерных фракций, или наоборот в более жестких условиях растет количество отщепленных концевых фрагментов т.е. исходных мономерных звеньев.
Таблица 1
Молекулярно-массовые характеристики МкМн и продуктов их олигомеризации
|
№ п/п |
Образец |
Фракция, % |
ММР* |
P** |
|||
|
Мw |
Mn |
Мw /Mn |
Мw |
Mn |
|||
|
1 |
МкМн I |
– |
790 |
620 |
1,26 |
– |
– |
|
2 |
Олигомер I |
– 70 30 |
1340 1780 320 |
660 1230 290 |
2,11 1,44 1,08 |
– 2,25 – |
– 1,87 – |
|
3 |
МкМн II |
– |
780 |
620 |
1,26 |
– |
– |
|
4 |
олигомер II |
– 65 35 |
1470 1910 320 |
690 1460 280 |
2,13 1,31 1,14 |
– 2,45 – |
– 2,35 – |
|
5 |
МкМн III |
– |
860 |
690 |
1,34 |
– |
– |
|
6 |
олигомер III |
64 36 |
1390 1970 330 |
700 1540 320 |
1,97 1,28 1,12 |
– 2,29 – |
– 2,22 – |
|
7 |
МкМн IV |
– |
1080 |
850 |
1,2 |
– |
– |
|
8 |
олигомер IV |
82 18 |
6150 7940 370 |
1560 6850 320 |
3,92 1,16 1,12 |
– 7,35 – |
– 8,05 – |
Примечание. *Цифры по столбцам характеризуют Мw и Mn суммарного (жирные) продукта, олигомера и исходного макромономера соответственно.
**Степень полимеризации по Мw и Mn, рассчитаны отдельно для олигомера.
Таким образом, из характера кривых ММР видно, что ФЭХ синтез ПАТК олигомеров протекает параллельно по двум направлениям, по первому происходит олигомеризация МкМн, а по второму – деструкция с отщеплением от макроцепи исходных мономерных звеньев. Следует отметить, что деструкция макромолекул в глубоких стадиях процесса с отщеплением низкомолекулярных фрагментов, характерна для подобных олигомеров и была зафиксирована еще в наших ранних исследованиях. Данная реакция может быть использована для регулирования ММ образующихся олигомеров [8]. При этом рост деструкции, как и в упомянутой уже нами работе, чувствуются также по физическому состоянию реакционной смеси. Так, загустевшая реакционная масса усилением деструкции становится маловязкой.
Расчет степени полимеризации (P) по параметрам ММР характерных образцов, представленных в таблице, показал, что значения ее в составе исследуемых олигомеров меняются в пределах 2–8. Сравнительно высокая степень полимеризации по сравнению с олигомером I, II и III была зафиксирована в случае олигомера IV, достигающей 8,05 (по Mn) и 7,35 (по Мw), что связано с наличием в его составе двух реакционных центров.
Изучение функциональной структуры исследуемых МкМн и образующихся олигомеров показало, что они практически обладают одинаковой функциональностью (табл. 2). Из данных таблицы видно, что среднечисленные функциональности fn по NH2 и OH группам равными единице, после олигомеризации практически остаются неизменными. Изменения, как и следовало ожидать, фиксируются в значениях fn по группам С=С равными до начала реакции единице (в случаях I, II и III) и двум (в случае IV).
Как видно, функциональность МкМн по группам С=С после реакции полностью не исчезают. Полученные олигомеры имеют функциональности по этим группам от 0,25 (для первых трех олигомеров) до 0,61 (олигомер IV). Это, несомненно, говорит о том, что в процессе имеют место акты рекомбинации или диспропорционирования свободных радикалов, заново приводившие к появлению двойных связей на концах макромолекул [9]. Исходя из этих данных, можно полагать, что часть полученных олигомеров, как и исходные МкМн характеризуются функциональностью по группам C=C, т.е. обладают реакционной способностью.
ИК-спектроскопическое исследование структур МкМн и синтезированных олигомеров показало, что во всех ИК-спектрах найденные полосы поглощения в области 3410, 1560, 1450, 1310 и 1100 см-1 относятся к тиокарбамидной группе, а при 3400 см-1 – к вторичным амидным группам тиокарбамидов. Полоса поглощения наблюдаемой при 2572 см-1, соответствующая валентным колебаниям группы SH, относится к тиолевой группе, указывающей на наличие в составе МкМн, а также олигомеров, одновременно тиокарбамидной и тиолевой группы, которое подтверждает таутомерной структуры исследуемых веществ. Следует отметить, что таутомерная структура в составе указанных соединений появляется лишь после ввода функциональных заместителей в состав исходного МкМн. Сильные полосы при 1700 и 1630 см-1 указывают на наличие в молекуле связей С=О и С=С. Полосы поглощения в области 3550–3590 см-1 соответствуют концевым гидроксильным группам. Полосы поглощения в области 672-1 характерны для ионов хлора.
Таблица 2
Среднечисленные функциональности (fn) МкМн и продуктов их олигомеризации
|
№ п/п |
Образец |
Содержание функциональных групп, % |
fn |
||||||
|
C=C |
NH2 |
OH |
Cl |
C=C |
NH2 |
OH |
Cl |
||
|
1 |
МкМн I |
4,03 |
2,46 |
– |
– |
0,97 |
0,96 |
– |
– |
|
2 |
олигомер I |
1,03 |
2,41 |
– |
– |
0,26 |
0,94 |
– |
– |
|
3 |
МкМн II |
4,11 |
2,51 |
– |
– |
0,98 |
0,97 |
– |
– |
|
4 |
олигомер II |
0,94 |
2,21 |
– |
– |
0,25 |
0,95 |
– |
– |
|
5 |
МкМн III |
3,69 |
– |
2,22 |
9,98 |
0,98 |
– |
0,96 |
1,97 |
|
6 |
олигомер III |
0,99 |
– |
2,09 |
9,64 |
0,27 |
– |
0,92 |
1,94 |
|
7 |
МкМн IV |
5,96 |
– |
3,61 |
16,1 |
1,95 |
– |
1,92 |
3,91 |
|
8 |
олигомер IV |
1,02 |
– |
1,87 |
8,73 |
0,61 |
– |
1,83 |
3,89 |
Валентные колебания метильных групп (СН3) функциональных заместителей наблюдаются в виде двух полос поглощения при 2962 и 2872 см-1. Первая – результат антисимметричного валентного колебания, в котором две связи С-Н метильной группы растягиваются, а третья сужается. Вторая полоса обусловлена симметричными валентными колебаниями, когда все три связи СН также растягиваются или сужаются. В виде двух полос поглощения зафиксированы также валентные колебания метиленовых групп (СН2) (2962 и 2853 см-1), обусловленных антисимметричными (νas CH2) и симметричными (νs CH2) валентными колебаниями. Кетонные и сложноэфирные карбонильные группы характеризуется интенсивной полосой поглощения валентного колебания связи С=О с частотой, лежащей в довольно широком интервале 1850–1550 см-1 [10].
Заключение
Разработанные условия ФЭХ синтеза ПАТК олигомера позволяют, изменяя условия реакции, направить процесс преимущественно по тому или иному механизму образования целевого продукта и получить олигомеры с регулируемыми параметрами ММР и соответственно свойствами. Композиции, полученные при модификации различных промышленных полимеров (поливинилхлорид, бутадиен-стирол, бутадиен-нитрил, эпоксидиановая смола ЭД-20) с этими олигомерами, обладают высокими эксплутационными свойствами и могут быть использованы в качестве атмосферостойкого, радиационно-защитного, адгезионно-прочного, пленкообразующего и антикоррозионного материала в различных областях техники.

