Процессы автогенной плавки медных концентратов на богатый штейн характеризуются повышенным содержанием меди в шлаках, что требует дальнейшей их переработки с целью ее извлечения [1, 2]. Обеднение шлаков включает в себя снижение механических и растворенных потерь меди со шлаками. При этом если решение вопроса осаждения механически увлеченных штейновых включений в шлаке представляет традиционную задачу, то снижение растворенных потерь меди со шлаком требует термодинамического анализа. В литературе известен ряд работ, посвященных изучению данного вопроса в широком диапазоне изменения парциального давления кислорода – от окислительных (РО2 = 10-6÷10-8атм), до восстановительных (РО2 = 10-9÷10-11 атм) условий. Системные исследования по изучению растворимости меди в железосиликатных расплавах проведены авторами работ [3–5]. Влияние незначительных добавок MgO, A12О3 и CaO на растворимость меди в железосиликатных шлаках опубликовано в исследованиях [6–8]. В работе [9] исследована растворимость меди в кальций-ферритовых шлаках, насыщенных кремнеземом. Анализ состава шлака, использованного для проведения экспериментальных исследований двухстадийного восстановительного его обеднения природным газом [10], показывает идентичность с составами шлаков известных работ, что позволяет провести сравнительную оценку полученных результатов с общих позиций – с точки зрения термодинамики равновесия системы: металл (сплав) – шлак.
Цель настоящих исследований – термодинамический анализ поведения меди и сопутствующих примесей при двухстадийном восстановительном обеднении высокомедистых шлаков и изучение растворимости меди в железосиликатном расплаве при равновесии в системе: металл (сплав) – шлак.
Материалы и методы исследования
Оценка вероятного направления реакций взаимодействия компонентов высокомедистого шлака с природным газом в присутствии угля проводилась на основании расчета изменения энергии Гиббса (∆G0T) в зависимости от температуры. Термодинамический анализ взаимодействия оксидов цветных металлов, железа и мышьяка с твердым углем представлен в работе [11]. В настоящей работе основное внимание уделено исследованию поведения меди, свинца, цинка, железа и мышьяка при глубоко восстановительном обеднении шлака природным газом.
Исходные данные стандартного состояния веществ, принятых для проведения термодинамических расчетов, получены из веб-сайта NIST-JANAF Thermochemical Tables (http://kinetics.nist.gov/janaf).
Термодинамический анализ проведен на основе результатов экспериментальных исследований двухстадийного восстановления природным газом шлаков процесса «Isasmelt» (ТОО «Казцинк») следующего состава, %: 0,66 Cu; 1,02 Pb; 4,22 Zn; 0,1 As; 38,4 Fe; 30,3 SiO2; 4,1 CaO; 5,1 Al2O3; 0,5 MgO [10].
Результаты исследования и их обсуждение
Термодинамический анализ поведения цветных металлов, железа и мышьяка в условиях двухстадийного восстановительного обеднения высокомедистых шлаков
Результаты ранее выполненных термодинамических расчетов энергии Гиббса реакций восстановления компонентов шлака углем [11], как одного из предпочтительных способов обеднения шлаков, показали селективное извлечение цветных металлов в целевые продукты: меди – в донную фазу (металлический сплав), свинца и цинка – в газы. Однако это требует большого избытка угля от теоретически необходимого его расхода для восстановления оксидов цветных металлов и железа. Кроме того, в этих условиях наблюдается повышенный переход железа и мышьяка в донную фазу, что значительно снижает качество получаемого медного сплава и ограничивает его дальнейшее использование.
Наиболее рациональным и эффективным представляется способ двухстадийного восстановительного обеднения шлака с использованием природного газа [10], который включает селективное разделение металлов в целевые продукты. На первой стадии – путем обработки шлакового расплава природным газом – максимально удаляется мышьяк в пыль, газы в виде легколетучего его триоксида (As2О3). На второй стадии осуществляется продувка шлака природным газом в присутствии угля, что обеспечивает глубокое удаление мышьяка из шлака, высокое извлечение меди в металлический сплав и свинца, цинка – в пыль, в форме возгонов, выносимых из реакционной зоны отходящими газами.
Механизм восстановления оксидов цветных металлов, железа и мышьяка природным газом можно представить системой реакций, приведенных в табл. 1.
Таблица 1
Расчетные значения энергии Гиббса (∆G0T) для высокотемпературной обработки оксидной системы Cu-Pb-Zn-As-Fe-O-SiO2 природным газом
|
№ |
Реакция |
Изменение энергии Гиббса, ∆G0T, кДж/моль |
|||
|
Температура, К |
|||||
|
1273 |
1473 |
1573 |
1273…1573 |
||
|
1 |
3Cu2Oж + CH4 = 6Cu ж + CO г + 2H2O г |
–395,8 |
–456,5 |
–481,2 |
∆G0T = –33,2 – 0,286*T |
|
2 |
3ZnO ж + CH4 = 3Zn г + CO г + 2H2O г |
3,5 |
–133,6 |
–201,5 |
∆G0T = –881,06 – 0,689*T |
|
3 |
3PbO ж + CH4 = 3Pb г + CO г + 2H2O г |
–141,2 |
–253,2 |
–308,1 |
∆G0T = 585,6 – 0,572*T |
|
4 |
2As2O5 ж + CH4 = 2As2O3 г + CO2 г + 2H2O г |
–943,2 |
–1064,0 |
–1122,7 |
∆G0T = –171,76 – 0,605*T |
|
5 |
3FeO ж + CH4 = 3Fe ж + CO г + 2H2O г |
–105 |
–167,0 |
–197,6 |
∆G0T = 291,3 – 0,311*T |
Выделяющиеся по реакциям (1)–(5) СО и СО2, не вступая во взаимодействие с компонентами шлака, выносятся из реакционной зоны вместе с отходящими газами ввиду их малого времени пребывания в реакционной зоне.
Сравнительный анализ расчетных значений изменения энергии Гиббса восстановления оксидов цветных металлов и мышьяка природным газом (табл. 1), с расчетными величинами убыли энергии Гиббса, полученными для условий восстановления шлака углем, показывают возможность глубокого восстановления нелетучего оксида мышьяка (V) природным газом до его летучего оксида (III). Расчетные значения ∆G0T реакции (4) при заданных температурах не менее чем в два раза (по абсолютной величине) превышают значения ∆G0T реакций восстановления оксидов цветных металлов и железа (табл. 1), что свидетельствует о высокой вероятности восстановления As2O5 до легколетучего оксида мышьяка (As2O3) и удаления его с отходящими газами. Данное положение полностью подтверждено результатами экспериментальных исследований: после первой стадии продувки шлака природным газом при расходе природного газа, превышающем его расход от стехиометрически необходимого его расхода для восстановления As2O5 до As2O3 на 30 %, содержание мышьяка в конечном шлаке было снижено с 0,1 % до 0,01 %.
Очень высока термодинамическая вероятность восстановления меди из ее оксида при обработке шлака природным газом. Убыль энергии Гиббса по реакции (1) ∆G1573К = –481,2 кДж/моль более чем в два раза превышает изменение энергии Гиббса, полученное при восстановлении оксида меди углем (∆G1573К = –192,3 кДж/моль). В условиях отсутствия угля и коллектирующей металлической фазы ожидать выделения меди в самостоятельную донную фазу не следует в силу относительно невысокого содержания меди в исходном шлаке. При этом металлическая медь, образующаяся в небольшом количестве по реакции (1), присутствует в шлаке в виде мелко диспергированных металлических включений.
Дополнительный ввод металлической меди в качестве коллектора во второй стадии и интенсивный барботаж шлакового расплава природным газом в присутствии угля создают благоприятные условия для коалесценции мелкой взвеси металлической меди в более крупные капли и последующего выделения их в самостоятельный донный сплав. При этом образование механических потерь меди со шлаком сводится к минимуму, и остаточное содержание меди в шлаке определяется лишь ее незначительной растворимостью.
Обеспечение глубоко восстановительных условий (добавка угля, продувка природным газом) значительно повышает термодинамическую вероятность восстановления оксида цинка и свинца. Расчетные значения убыли энергии Гиббса реакций (2) и (3) при температуре ведения процесса обеднения шлака (1300 °С) превышают ∆G01573 реакции (5) – восстановления оксида железа природным газом. В условиях двухстадийного обеднения вероятность восстановления железа из его оксида будет носить подчиненный характер в силу недостаточного избытка угля и низкой температуры. Кроме того, образование металлического железа будет затруднено, пока в шлаке присутствуют оксиды меди, свинца и цинка. Минимальное количество металлического железа, переходящего из шлака в сплав по реакции (5), существенного влияния на качество и свойства получаемого сплава не окажет. Данное положение полностью подтверждается результатами экспериментальных исследований: содержание железа в получаемых сплавах с ростом расхода природного газа увеличивается незначительно – до 0,13 % [10].
Термодинамика равновесия системы сплав – шлак
В системе сплав – шлак активность оксида меди (I) в шлаке определяется равновесием реакции
Cu ж + ¼ О2 = CuО0,5 ж . (1)
Константу равновесия (К1) реакции (1) можно представить в виде
К1 = аCuO 0.5 / aCu * PO2¼ . (2)
Исходя из уравнения (2) а CuO 0.5 определяется как
аCuO 0.5 = К1 * aCu * PO2¼, (3)
или, в альтернативном виде:
аCuO 0.5 = γCuO 0.5 * NCuO 0.5 , (4)
где γCuO 0.5 – коэффициент активности оксида меди (I);
NCuO 0.5 – мольная доля оксида меди в шлаке (I).
Из выражения (3) видно, что аCuO0.5 определяется активностью меди (aCu), парциальным давлением кислорода (PO2) над шлаковым расплавом и температурой. В нашем случае активность меди не равна единице, так как шлак находится в контакте не с чистой медью, а с раствором железа в меди. Термодинамический анализ затрудняется тем, что состав шлака зависит от парциального давления кислорода. Следовательно, как коэффициент активности, так и мольная доля оксида меди являются функцией парциального давления кислорода. Таким образом, при Т = const для термодинамического описания системы сплав – шлак достаточно определить величины PO2 и аCuO0.5.
Для расчета парциального давления кислорода применена процедура эволюционной аппроксимации результатов экспериментальных данных работ [3, 5, 7, 9], где исследована растворимость меди в железосиликатных шлаках при температуре 1300 °С в широком диапазоне изменения парциального давления кислорода – от окислительных (РО2 = 10-7 атм) до восстановительных условий (РО2 = 10-10 атм). Сравнительный анализ составов исходных шлаков и условий проведения опытов указанных работ с исследованиями настоящей работы показывает их идентичность, что предполагает возможность использования зависимости (5), установленной в работе [9], для расчета парциального давления кислорода над шлаком в зависимости от содержания меди в шлаке.
lg (Cu) = 0,221 lg PO2 + 2,09, (5)
где Cu – содержание меди в шлаке, % мас.;
PO2 – парциальное давление кислорода, атм.
Выбор зависимости (5) обусловлен ее универсальностью, позволяющей применять ее для расчета растворимости меди в железосиликатных шлаках в широком диапазоне изменения их состава и парциального давления кислорода. Результаты расчетных значений PO2 по уравнению (5) показали хорошую сходимость данных по растворимости меди в шлаках, полученных в работах [3, 5, 7, 9] и настоящих исследованиях.
Для расчета активности оксида меди (I) в шлаке использовали уравнение (6), приведенное в работе [9], где зависимость содержания меди в шлаке от активности оксида меди (I) в нем определена при условиях, идентичных условиям настоящей работы: температура 1300 °С, содержание СаО и Al2O3 в шлаке 4,0 и 6,0 % соответственно:
(Cu) = 20,1 * аCuO 0.5 + 0,03. (6)
После определения значений парциального давления кислорода (РО2) и аCuO 0.5 проводился расчет активности меди в сплаве (aCu) для каждой серии опытов исходя из выражения (2). Результаты расчетов мольной доли (NCuO 0.5) и активности (аCuO 0.5) оксида меди (I) в шлаке, парциального давления кислорода над шлаком (log РO2) и aCu, полученные с использованием экспериментальных данных [10], представлены в табл. 2.
Таблица 2
Расчетные значения аCuO 0.5, РO2 и aCu в сплаве в условиях восстановительного обеднения шлаков природным газом
|
№ опыта |
Расход СН4, % |
(Сu), % |
NCuO 0.5 |
аCuO 0.5 |
log РO2, атм |
aCu |
|
1 |
10 |
0,41 |
0,0023 |
0,019 |
–11,20 |
0,74 |
|
2 |
20 |
0,32 |
0,0018 |
0,014 |
–11,69 |
0,78 |
|
3 |
30 |
0,23 |
0,0013 |
0,009 |
–12,34 |
0,83 |
|
4 |
40 |
0,21 |
0,0011 |
0,008 |
–12,55 |
0,84 |
|
5 |
50 |
0,17 |
0,0010 |
0,007 |
–12,90 |
0,86 |
|
6 |
60 |
0,14 |
0,0008 |
0,005 |
–13,34 |
0,88 |
В глубоко восстановительных условиях обеднения шлака содержание железа в сплаве, минимально (максимальное содержание железа в сплаве [Fe]Cu для опыта 6 (табл. 2) достигает 0,12 %), что характеризует бинарную систему Cu-Fe вблизи медного края диаграммы. При минимальном содержании железа в сплаве можно принять [Fe]Cu ≈ N[Fe]Cu. Тогда зависимость aCu = f([Fe]Cu) должна описывать закономерность, свойственную бесконечно разбавленным растворам с подчинением закону Генри. И действительно, изменение активности меди в сплаве от ее мольной доли и содержания железа в нем, показанное на рис. 1, подтверждает данное положение и характеризует сплав как бесконечно разбавленный раствор железа в меди.
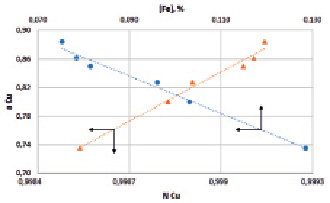
Рис. 1. Зависимость активности меди в сплаве от мольной доли и содержания железа в нем
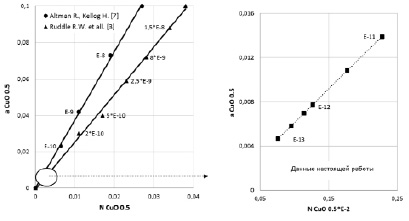
Рис. 2. Изменение активности оксида меди (аCuO 0.5) от мольной доли (NCuO 0.5) в шлаке. Цифры на рисунках – значение РО2 = 10-n, атм.
Изменение аCuO 0.5 и мольной доли NCuO 0.5 оксида меди в шлаках, уравновешенных с медно-железистым сплавом, в условиях глубокого восстановительного обеднения при различных значениях РО2, показано на рис. 2.
Установленная зависимость аCuO 0.5 от мольной доли NCuO 0.5 в шлаке показывает, что растворимость меди в шлаках каждой опции опытов подчиняется закону Генри. В глубоко восстановительных условиях (РО2 < 10-11 атм) растворимость меди в шлаке минимальна. Значения коэффициента активности оксида меди (γCuO 0.5), рассчитанные из выражения (4), для каждого опыта (1–6, табл. 2) равны: 8,3; 7,8; 6,9; 7,3; 7,0 и 6,25 соответственно.
Линейная зависимость содержания растворенной в шлаке меди от аCuO 0.5, показанная на рис. 3, указывает на то, что изменение состава растворителя (шлака) от числа молей компонентов шлака, из расчета на удельную массу шлака, меньше экспериментальной ошибки. В этом случае содержание меди в шлаке прямо пропорционально мольной доле и активности оксида меди (CuO0.5).
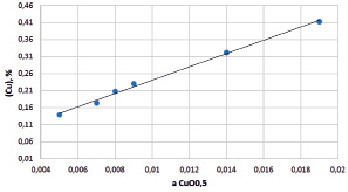
Рис. 3. Зависимость содержания меди в шлаке от аCuO 0.5
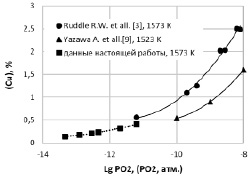
Рис. 4. Зависимость содержания меди в шлаке от парциального давления кислорода (РО2)
На рис. 4 показана зависимость изменения содержания меди в шлаке от парциального давления кислорода (РО2).
Согласно ионной теории строения шлаков растворимость меди в шлаке падает с ростом температуры, повышением γCuO0.5, снижающего аCuO 0.5 и уменьшением кислородного потенциала [6, 12, 13]. Установленные закономерности, представленные на рис. 3 и 4, полностью подтверждают это положение и показывают хорошую согласованность с данными работ [3, 9].
При фиксированных значениях активности меди в шлаке, давления кислорода и температуры, растворимостью меди в шлаке можно оперировать варьированием γCuO0.5, величина которого определяется ионными взаимодействиями, происходящими в шлаке.
Как известно, железосиликатные расплавы содержат высокополимерные силикатные анионы (SixOyz-), катионы двух- (Fe2+) и трехвалентного железа (Fe3+) и незначительную концентрацию свободных анионов кислорода (О2-). При этом ионные взаимодействия Fe2+ – O2- и Fe3+ – O2-, в которых анион O2- представляет собой кислород, происходят на силикатном анионе SixOyz- [6, 13].
Наличие меди в шлаке обуславливает взаимодействие катиона Cu+ с анионом кислорода O2-. Как показали результаты минералогических исследований твердых проб шлаков каждой серии опытов, содержание магнетита в них практически сведено к минимуму. Смещение редокс-перехода Fe3+↔ Fe2+ в сторону двухвалентного железа и наличие высокоосновного оксида СаО способствует образованию ферритовых анионов. Следовательно, конечные расплавы будут содержать ферриты, свободные анионы кислорода и катионы Fe2+ и Ca2+. В таких расплавах предпочтительными будут взаимодействия катионов Ca2+ и Fe2+ с анионом кислорода (O2-). Наличие меди в шлаке, по-видимому, будет определяться взаимодействием катиона меди Cu+ со свободным анионом кислорода, присутствующего в ферритном анионе. Доказательством данного предположения может служить факт, что медь в шлаковых расплавах, полученных после обеднения, в форме силиката не обнаружена. Следовательно, оксид меди (I), взаимодействуя с оксидом железа, связывается в устойчивое соединение делафоссит (CuFeO2), которое было обнаружено в твердых пробах шлаков, полученных в результате минералогических исследований.
Выводы
1. На основании результатов экспериментальных исследований проведен термодинамический анализ поведения Cu, Pb, Zn и As в условиях глубоко восстановительного (РО2 = 10-11 – 10-13 атм) двухстадийного обеднения высокомедистых шлаков природным газом в присутствии угля.
2. Рассчитаны активность оксида меди (I) в шлаке и активность меди в сплаве, которые были использованы для раскрытия механизма растворимости меди в шлаке с точки зрения ионной природы строения оксидного расплава.
3. Показано, что термодинамические закономерности растворимости меди в шлаках, протекающие в условиях глубокого восстановительного обеднения высокомедистых шлаков, подчиняются закону Генри.

