Некротический энтероколит (НЭК) – тяжёлое полиэтиологическое, неспецифическое, воспалительное заболевание, которое часто осложняется перфорацией кишечника, перитонитом, спаечной кишечной непроходимостью, инфильтратом брюшной полости и сепсисом [1]. НЭК встречается с частотой 2,4:10000 новорожденных, что составляет 2,1–4 % среди всех детей, поступающих в неонатальное отделение реанимации. Несмотря на многочисленные теоретические, клинические, инструментальные исследования, патогенез НЭК изучен не до конца [2, 3]. В основе патогенеза НЭК лежат сосудистые расстройства, которые приводят к некрозу стенки желудочно-кишечного тракта разной степени, глубины и протяженности. Под действием гипоксии и асфиксии происходит централизация кровообращения, спазм мезентеральных сосудов с кровоизлияниями в кишечную стенку, колонизацией патогенной бактериальной флорой, воспаление, активизирующее провоспалительные медиаторы, что в итоге приводит к изъязвлению слизистого слоя, некрозу и перфорации [2, 4, 5]. В последние годы частота встречаемости НЭК у новорожденных увеличилась, что связано со значительными успехами в неонатологии, позволяющими выхаживание маловесных детей. Установлено, что уровень заболеваемости и смертности НЭК прямо пропорционален сроку гестации новорожденного. Это связано с интенсивным развитием неонатологии и реаниматологии, что позволяет выхаживать глубоконедоношенных детей [3, 4].
В настоящее время дискутируется вопрос об использовании новых биохимических агентов в качестве маркеров выраженности воспалительной реакции и предикторов прогноза при различных заболеваниях у новорожденных детей [6–8]. Среди них важное место занимают система матриксных металлопротеиназ, кальпротектин, лактоферрин и другие маркеры [7].
Как известно, ключевым фактором, определяющим активность воспаления и выраженность повреждений кишки у недоношенных детей, является нарушение баланса между синтезом и разрушением белков внеклеточного матрикса [8]. Этот прогрессирующий процесс контролируют ферменты – матриксные металлопротеиназы, активность которых подавляется их тканевыми ингибиторами. Металлопротеиназы принадлежат к семейству цинксодержащих матриксинов, являющихся основными компонентами базальной мембраны, разрушение которой способствует развитию перфораций кишечной стенки [9]. Учитывая многообразие эффектов компонентов системы матриксные металлопротеиназы и тканевыми ингибиторами в тканях, их изучение в качестве факторов диагностики, прогноза и оценки течения НЭК у детей представляется актуальным.
Цель исследования: оценить диагностическую, клиническую и прогностическую значимость матриксных металлопротеиназ при некротическом энтероколите у новорожденных.
Материалы и методы исследования
Обследования новорожденных проводились на базе Научно-исследовательского института педиатрии имени К.Я. Фараджевой (Баку, Азербайджан) в период с 2016 по 2018 гг. В основную группу вошли 110 новорожденных с НЭК, поступивших в отделение реанимации и интенсивной терапии в возрасте от 1 до 28 дней. Все обследованные новорожденные были разделены на три группы по стадиям НЭК. I группу составили новорожденные с НЭК I стадии, II группу – новорождённые с НЭК II стадии, III группу – новорожденные с НЭК III стадии. Согласно клинико-рентгенологическим признакам I стадия НЭК отмечалась у 49 (40,5 %), II стадия у 48 (39,7 %), a III стадия у 13 (10,7 %) новорожденных. Контрольную группу составили 30 условно здоровых новорожденных, без внутриутробной инфекции и врожденных пороков развития. Мальчики составили 56,4 % от общего числа детей (62 младенца), а девочки 43,6 % (48 младенцев).
Диагноз был поставлен на основании анамнестических, клиническо-лабораторных и инструментальных методов исследования. Стадия заболевания определялась согласно классификации Walsh и Kliegman.
Масса тела новорожденных составила в среднем 2231 ± 71,7 г. В группе наблюдавшихся больных было 62 (56,4 ± 4,7 %) мальчиков и 48 (43,6 ± 4,7 %) девочек. Срок гестации новорожденных варьировал в пределах 22–37 недель. Так, гестационный возраст у 3 (2,7 ± 1,6 %) недоношенных составил 22–28 недель, у 13 (11,8 ± 3,1 %) недоношенных 29–31 неделю, у 25 (22,7 ± 4,0 %) 32–34 недели, у 69 (62,7 ± 4,8 %) свыше 35 недель.
Всем детям проводилось комплексное лабораторно-инструментальное исследование: общие анализы крови и мочи, биохимические показатели крови, определение кислотно-основного состояния газов крови, посев крови и кала, иммуноферментный анализ и инструментальные методы – обзорное рентгенологическое обследование брюшной полости, нейросонография, ультразвуковое исследование брюшной полости, эхокардиографическое обследование.
У 50 детей с НЭК был определен уровень матриксных металлопротеиназ 2, 9 и 17 (ММП-2, ММП-9 и ММП-17). Концентрации ММП-2, – 9–17 определяли в сыворотке крови новорожденных с НЭК при поступления в реанимационное отделение и в динамике через 7 дней после лечения.
Определение матриксных металлопротеиназ выполняли иммуноферментным анализом с набором реактивов фирмы «CUSABIO BIOTECH» на анализаторе Elisys Uno Human (Германия).
Полученные цифровые данные подверглись статистической обработке методами медицинской статистики с учетом современных требований. Применены методы вариационного – U-Манна – Уитни, KU-Краскеля – Уоллиса, дисперсионного – ANOVA – F-Фишер, FS-Фишер – Снедекор, дискриминантного-чувствительность и специфичность и ROC-анализов. Вычисления проводились на электронной таблице EXCEL-2010 и SPSS-20.
Принимая во внимания многообразие факторов риска развития НЭК, нами был проведен анализ анамнестических данных, антенатальных и интранатальных факторов риска в группах.
Возраст матерей основной группы с НЭК колебался от 19 до 43 лет и составил в среднем 26,4 ± 0,5 лет, из них матерей в возрасте до 30 лет было 88 (80 %), а старше 30 лет 22 (20 %) женщин. Большинство матерей были в возрасте от 19 до 30 лет.
Акушерский анамнез матерей был отягощен во всех группах. В основной группе у 93 (84,5 ± 3,4 %) матерей отмечались проявления гестоза первой половины беременности, у 35 (31,8 ± 4,4 %) матерей гестоз второй половины беременности, у 70 (63,6 ± 4,6 %) матерей анемия. Оперативные роды были у 57 (51,8 ± 4,8 %) матерей.
Результаты исследования и их обсуждение
Болезнь началась остро у всех детей. Признаки интоксикации были у всех детей (100 %). У детей наблюдалась желчная рвота и нарушение кала. Было выявлено, что у 47 детей (42,7 ± 7,7 %) нормальное, а у 63 детей (57,3 ± 4,7 %) высокое температура. Так, у 22 больных (20 ± 3,8 %) была отмечена субфебрильная, у 20 детей (18,2 ± 3,7 %) фебрильная, у 3 больных (2,7 ± 1,6 %) пиретическая, у 2 больных (1,8 ± 1,3 %) гиперпиретическая температура.
В рентгенологическом обследовании брюшной полости у 69 (62,7 ± 4,6 %) детей обнаружен метеоризм, у 42 (38,2 ± 4,6 %) детей – утолщение кишечных петель, у 34 (30,9 ± 4,4 %) детей – пневматоз, у 12 (10,9 ± 3 %) детей – свободный воздух в брюшной полости.
У новорожденных I группы 72,4 ± 6,5 % детей наблюдался метеоризм во время обзорного рентгенологического обследования. У 21 (42,9 ± 7,1 %) пациентов было обнаружено утолщение кишечных петель, у 8 (16,3 ± 5,3 %) пациентов – пневматоз. У пациентов II группы метеоризм обнаружен у 30 (62,5 ± 7 %) больных, у 15 (31,3 ± 6,7 %) – утолщение кишечных петель у 22 (45,8 ± 7,2 %) – пневматоз кишечника. А в III группе ситуация несколько иная, тяжелее. Так, при этом у всех пациентов, входящих в группу, наблюдался свободный воздух в брюшной полости, что является обязательным показанием к хирургической операции. Метеоризм у 4 (30,8 ± 12,8 %) пациентов, утолщение кишечных петель у 6 пациентов (46,2 ± 13,8 %), пневмония у 4 (30,8 ± 12,8 %) пациентов.
У всех больных проведено бактериологическое обследование кала. При этом патологическая микрофлора обнаружена у 42 (45,3 ± 1,0 %) пациентов. У 27 больных выявлен (24,5 ± 4,1 %) stafilococcus aureus. А у других больных обнаружен stafilococcus epiderm. (10,9 ± 3 %), psevd. aeruginosa (4,1 ± 2,8 %), klebsiella (4,5 ± 2,0 %), prot.mirabilis (2,0 ± 2,0 %), candida (6,1 ± 3,4 %).
У всех новорожденных с НЭК при поступлении обнаружены разное по степени выраженности увеличение ММП-2, ММП-9, ММП-17 в сыворотке крови в зависимости от стадии заболевания по сравнению с контрольной группой (таблица).
В результате проведения сравнительного анализа было установлено, что уровень ММП-2 у новорожденных в I группе увеличивался в 6,9 раза, во II группе в 8,3 раза, а в III группе в 10,7 раза по сравнению с новорожденными контрольной группы (р = 0,015; F = 4,686). Уровень ММП-9 тоже увеличивался в 3 раза в I группе, в 3,4 раз в II группе, в 4,5 раз в III группе (р < 0,001; F = 13,617). Концентрация ММП-17 у новорожденных в группах I и II была почти одинакова, повышена в среднем в 2,5 раза, a в III группе в 3,6 раза по сравнению с контролем (р = 0,007; F = 13,617).
Концентрация матрикс металлопротеиназ у новорожденных с некротическим энтероколитом на различных стадиях
|
Маркеры |
Контрольная группа (п = 10) |
I группа (n = 16) |
II группа (n = 16) |
IIIгруппа (n = 8) |
P(КУ) |
F; p |
|
ММП-2, нг/мл |
44,8 ± 1,8 (35–52) |
309,4 ± 15,4 (249–519)* ** |
374,1 ± 23,4 (270–598)***# |
480,8 ± 87,8 (285–950)***# |
р = 0,040 |
F = 4,686 p = 0,015 |
|
ММП-9, нг/мл |
122,1 ± 2,7 (102–131) |
367 ± 20,5 (233–502) *** |
412,3 ± 19,7 (284–522) *** |
544,1 ± 25,4 (484–671) ***###^^ |
p = 0,001 |
F = 13,617 p < 0,001 |
|
ММП-17, нг/мл |
397,2 ± 23,1 (317–580) |
983,6 ± 75,7 (521–1444) *** |
1016,1 ± 74,3 (533–1497) *** |
1426,6 ± 142,5 (749–1989) ***##^^ |
p = 0,035 |
F = 5,666 p = 0,007 |
Примечание:
1. В скобках указан 95 % доверительный интервал (нижняя и верхняя границы).
2. Результаты непараметрического критерия Манна – Уитни: статистическая значимая разница:
– с контрольной группой * – p < 0,05; ** – p < 0,01; *** – p < 0,001;
– с I группой # – p1 < 0,05; ## – p1 < 0,01; ### – p1 < 0,001;
– с II группой ^ – p2 < 0,05; ^^ – p2 < 0,01; ^^^ – p2 < 0,001.
3. p (КУ) – результаты одностороннего вариационного анализа по критерию Краскела – Уоллиса (сравнение трех групп).
4. F; p – результаты однофакторного дисперсионного анализа по критерию Фишера (сравнение трех групп).
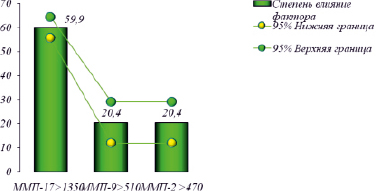
Степень влияния каждого фактора на исход новорожденных с НЭК
Достоверные изменения с различной степенью ММП-2, ММП-9 и ММП-17 наблюдались у новорожденных II, III групп по сравнению с новорожденными I группы (р1 < 0,001; р1 < 0,001; р1 < 0,01).
С помощью корреляционного анализа ρ-Спирмена у новорожденных с некротическим энтероколитом выявлена связь между матрикс металлопротеиназ и тяжестью болезни:
– прямая средней силы корреляционная связь с MMП-9 (ρs = 0,578, p = 0,001),
– обратная связь слабой силы с MMП-17 (ρs = 0,337, p = 0,033) и MMП-2 (ρs = 0,401, p = 0,010)
Для более полного отражения и взаимосвязи матрикс металлопротеиназ с некротическим энтероколитом, нами проводилась оценка полученных показателей с помощью ROC-анализа. Вычислены площадь ROC-кривой, стандартная ошибка, определены 95 %-ные верхние и нижние границы площади и асимптотические значения (достоверность результата). Согласно значениям ММП-2 S = 0,610 ± 0,153 (95 %ДИ: 0,310–0,911; р = 0,039), ММП-9 S = 0,716 ± 1,22 (95 %ДИ: 0,477–0,954; р = 0,096), ММП-17 S = 0,863 ± 0,66 (95 %ДИ: 0,734–0,992; р < 0,005).
На основании координат ROC-кривой определены Cut of Point (точки отсечения), когда сумма значений чувствительности и специфичности достигает максимального уровня. Применение данного диагностического метода даёт возможность оценить прогностическую ценность положительных и отрицательных результатов.
Оптимальной «точкой отсечения» для ММП-17 является величина 1350 пг/мл. В этой точке чувствительность равна (Se) 83,3 ± 15,2 %, специфичность (Sp) 88,2 ± 5,5 %; для ММП-9 ≥ 510 пг/мл – Se = 50,0 ± 20,4 %, Sp = 91,2 ± 4,9 %, ММП-2 ≥ 470 пг/мл Sе = 50,0 ± 20,4 %, Sp = 91,2 ± 4,9 %.
Общий диагностический вес тест составляет для ММП-17 87,5 %, ММП-9 85 %, а у ММП-9 85 %, что свидетельствует об их хорошей диагностической эффективности.
С помощью дисперсионного анализа ANOVA (FS-Фишер-Снедекор) мы оценили степень влияния каждого фактора (СВФ) на исход новорожденных с НЭК (рисунок).
Как видно из рисунка, наиболее значимое влияние на исход заболевания выявлено при повышенной концентрации ММР-17 СФВ = 59,9 (95 %ДИ: 64,2–55,5; р < 0,001), ММР-9 СФВ = 20,4 (95 %ДИ: 29,0–11,8; р < 0,001), MMP-2 СФВ = 20,4 (95 %ДИ: 29,0–11,8; р < 0,001).
Заключение
У новорожденных детей с НЭК выявлена различная динамика уровня ММП-2, ММП-9 и ММП-17 в зависимости от стадии болезни. Выраженность изменений уровня этих металлопротеиназ коррелирует с тяжестью течения НЭК. Изменение уровня матрикс металлопротеиназ показывает возможность использовать этих маркеров диагностике и прогнозировании НЭК. Дальнейшее изучение эти маркеры как потенциальных маркеров реализации НЭК и предикторов их исходов у новорожденных.

