Глиобластома (ГБ) является самой распространенной первичной злокачественной опухолью ЦНС: в данной нозологической группе её доля составляет 46,1 % [1]. Мы живем в эпоху таргетной терапии, когда терапевтические агенты, прецизионно нацеленные на ключевые драйверные молекулярные факторы опухолевых клеток, дают возможность преобразить клиническое течение и прогноз пациентов при многих злокачественных опухолях. Таргетная терапия, основанная на оценке межопухолевой молекулярно-генетической гетерогенности, стала поистине революционным веянием во многих областях онкологии [2]. Тем не менее в отношении ГБ подобный подход не работает – многочисленные разработки препаратов таргетной терапии ГБ не увенчались успехом [3]. Важнейшей причиной подобных неудач и ключом к созданию новых, эффективных диагностических и лечебных инструментов является внутриопухолевая гетерогенность ГБ. Наличие в рамках одной и той же опухоли клеточных популяций с различными молекулярными свойствами и драйверными факторами ограничивает эффективность традиционно применяемых подходов к разработке препаратов таргетной терапии [4]. Поэтому более глубокое понимание особенностей внутриопухолевой гетерогенности ГБ необходимо для создания более действенных средств лечения данной высокозлокачественной опухоли.
Несмотря на несомненную важность поставленной проблемы, исследований, посвященных внутриопухолевой гетерогенности ГБ, не так много. На сегодняшний день классическим для изучения внутриопухолевой гетерогенности при различных локализациях онкологического процесса стал метод single-cell ДНК и РНК секвенирования. Данная технология позволяет дифференцированно оценивать молекулярные свойства каждой опухолевой клетки, а полученный массив данных подвергнуть кластерному анализу с целью выделения различных клеточных популяций в рамках каждой отдельно взятой опухоли. Не так давно данный подход был применен и для оценки внутриопухолевой гетерогенности в ГБ. Neftel с коллегами показали, что злокачественные клетки в ГБ могут быть классифицированы на 4 молекулярных подтипа или молекулярных состояния: клетки, подобные нейрональным предшественникам (NPC), клетки, подобные олигодендрогиальным предшественникам (OPC), клетки, подобные астроцитарным предшественникам (AC), и мезенхимоподобные клетки (MES). Хотя каждый образец ГБ содержит клетки в нескольких состояниях, относительная частота каждого состояния или подтипа варьируется между опухолями. Также авторы показали, что для каждого подтипа характерны некоторые драйверные генетические изменения. В частности, NPC характеризуется амплификацией гена CDK4, для OPC типично наличие амплификации гена PDGFRA, амплификация гена EGFR наиболее часто встречается в AC, в то время как для MES ключевым драйверным молекулярным событием является инактивирующая мутация гена NF1 [5].
Методологический подход, примененный Neftel с коллегами, является мощным инструментом для оценки внутриопухолевой гетерогенности, генерирующим большое количество генетических данных высокого качества на уровне одной клетки. Однако данный подход не лишен недостатков, так как он не позволяет оценить топографическое распределение описанных клеточных популяций в ткани опухоли. Его применение предполагает лизирование образца с получением однородного в гистологическом отношении массива клеток, что исключает возможность изучения взаимоотношений популяций опухолевых клеток с ключевыми гистологическими детерминантами и тканевыми нишами, а также межпопуляционных взаимодействий. Это ограничивает применимость полученных результатов как в фундаментальной, так и в практической плоскости.
Мы попытались решить данную проблему, используя разрабатываемые нами авторские методики кластерного анализа комплексных изображений опухолей. На основе оценки пролиферативной и антиапоптозной активности опухолевых клеток, а также их топографического положения как в образце ткани в целом, так и относительно ключевых гистологических детерминант – некрозов и сосудов, нам удалось выделить пять кластеров в ГБ: перинекротический кластер (ПНК), непосредственно окружающий зону некрозов; транзиторный некротический кластер (ТНК), расположенный вокруг ПНК; периваскулярный кластер (ПВК), окружающий сосудистую стенку; транзиторный васкулярный кластер (ТВК), расположенный вокруг ПВК; промежуточный кластер (ПК), занимающий промежуточное положение между четырьмя другими кластерами [6].
При этом выяснилось, что наибольшая активность наблюдается в ПВК, отличающиеся в том числе самой высокой пролиферативной активностью. Наименее пролиферативно активным был ПНК, при этом соседний ТНК характеризовался относительно высокой пролиферативной активностью. ТНК отличался низкой пролиферативной активностью, в то время как для ПК были характерны средние значения всех показателей [6].
В настоящей работе мы решили оценить распределение ключевых популяций опухолевых клеток – NPC, OPC, AC и MES – в выделенных нами ранее клеточных кластерах ГБ. Для этой цели, используя методики флуоресцентной гибридизации in situ, мы оценили пространственную гетерогенность экспрессии матричных РНК (мРНК) генов CDK4, EGFR, PDGFRA и NF1 в образцах ГБ и провели раздельный подсчет активности экспрессии (АЭ) данных факторов в различных кластерах опухоли. Также мы оценили влияние показателей АЭ раздельно в каждом кластере на прогноз пациентов.
Материалы и методы исследования
Общая характеристика исследованной группы
В ретроспективное исследование были включены 50 образцов опухолей от пациентов с установленным диагнозом глиобластомы без мутаций в генах IDH1 и IDH2 (WHO Grade IV), проходивших хирургическое лечение в ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко в 2012–2014 гг. Мутационный статус генов IDH1 и IDH2 определялся методами прямого секвенирования и полимеразной цепной реакции с ДНК зондами. Все пациенты, включенные в исследование, находились под динамическим наблюдением онколога или радиолога в течение минимум 5 лет и получали стандартные схемы химиотерапии и лучевой терапии. Критериями исключения были мультифокальный рост опухоли, облучение всего мозга, неполное лечение темозоламидом. Показатели общей выживаемости были рассчитаны в днях.
Проведение иммуногистохимического исследования
Из парафиновых блоков с фиксированными в них образцами опухолей изготавливали срезы толщиной 3 микрометра, депарафинировали с использованием ксилола и повторно гидратировали с помощью различных концентраций этанола, срезы высушивали в термостате при 45 °C. Затем срезы последовательно инкубировали с кроличьими моноклональными антителами против антигена Ki-67 человека (CONFIRM anti-Ki67, «Roche-Ventana»), мышиными моноклональными антителами против антигена человека Bcl-2 (CONFIRM anti-bcl-2, «Roche-Ventana»), мышиными моноклональными антителами против антигена человека BCL6 (клон GI191E/A8, Cell Marque, «Sigma-Aldrich», США) и после этого конъюгировали с антикроличьими мышиными (в случае с Ki-67) и антимышиными кроличьими (в случае Bcl-2 и BCL6) IgG антителами против пероксидазы хрена. Сайты связывания антител визуализировали с использованием тетрагидрохлорида 3,3’-диаминобензидина («Ventana Medical Systems», США), ядра клеток окрашивали гематоксилином.
Получение и первичный анализ изображений
Затем препараты подвергались оцифровке с использованием сканера Aperio AT2 (Leica Biosystems, GmbH). Изображения для всех маркеров (Ki-67, Bcl-2, BCL6) в формате SVS максимально точно сопоставлялись друг с другом по координатным данным с получением сложных комплексных изображений с помощью программного обеспечения Aperio ImageScope (Leica Biosystems, GmbH), ImageJ (Национальный институт здравоохранения, США) и QuPath (University of Edinburgh, Division of Pathology, Великобритания). Комплексные изображения модифицировались в отношении цветового диапазона с помощью медианной фильтрации с использованием программного обеспечения ImageJ, Adobe Photoshop (Adobe Systems, США) и QuPath. Далее применялось нерезкое маскирование для всех изображений с использованием Aperio ImageScope, ImageJ и QuPath. С применением программных алгоритмов под контролем оператора определялись границы сосудов и некрозов в образцах опухолей. Затем проводился кластерный анализ комплексных изображений с использованием программного обеспечения Matlab (The MathWorks, США) и SPSS Statistics 23 (IBM, США). Для этих целей применялся метод k-средних. В качестве исходного алгоритма кластеризации применялся ранее использованный алгоритм, основанный на определении для каждого пикселя в изображении показателей в семивекторной системе, учитывающей координатное положение пикселя, расстояние пикселя до края сосуда и некроза, значения показателей цветности по шкале RGB. Показатели цветности подсчитывались и интерпретировались по разработанной и описанной нами ранее методике [7]. Применяя данный алгоритм, проводили определение пяти ранее описанных кластеров в каждом образце опухоли.
Флуоресцентная гибридизация in situ с РНК-зондами
Парафиновые срезы тканей опухолей были фиксированы на предметных стеклах и хранились при 80 °С. Предметные стекла помещали в термостат и хранили там в течение 1 ч при температуре 60 °С, депарафинизировали и дегидратировали ксилолом и этанолом. Ткань предварительно обрабатывали перекисью водорода RNAscope Hydrogen Peroxide (Advanced Cell Technologies, США) в течение 10 мин при комнатной температуре и RNAscope Target Retrieval Reagent (Advanced Cell Technologies, США) в течение 15 мин при 98 °С. RNAscope Protease Plus (Advanced Cell Technologies, США) затем наносили на ткань и инкубировали в течение 30 мин при 40 °С. Гибридизационные зонды готовили разбавлением зонда С2 (красный) 1:50 в зонде С1 (зеленый). Использовались зонды-мишени для РНК EGFR, PDGFRA, CDK4 и NF1 (все Advanced Cell Technologies, США). Зонды добавляли к ткани и гибридизовали в течение 2 ч при 40 °С. Серия из 10 стадий амплификации была выполнена с использованием инструкций и реагентов, предоставленных в RNAscope 2.5 HD Duplex Detection Kit (Advanced Cell Technologies, США). Ткань подкрашивали гематоксилином в течение 25 с при комнатной температуре с последующим маунтингом с использованием среды VectaMount (Vector Laboratories, США).
Вторичный анализ флуоресцентных изображений при гибридизации in situ
Проводилась оцифровка препаратов, полученных методом флуоресцентной гибридизации in situ с применением сканера стекол Aperio VERSA (Leica Biosystems, GmbH) в флуоресцентном режиме. Далее с помощью программного обеспечения Matlab и SPSS Statistics 23 проводилось сопоставление данных изображений с комплексными изображениями, полученными на предыдущих этапах, с выделением кластеров в флуоресцентных изображениях. Далее как в препарате в целом, так и в выделенных кластерах раздельно проводился автоматически подсчет АЭ каждой мРНК во всех образцах по ранее описанной методике [7].
Статистический анализ
Для статистической обработки результатов применялось программное обеспечение SPSS Statistics 23. Проводилось сравнение средних значений АЭ мРНК между различными кластерами и оценка значимости различий с помощью U-критерия Манна-Уитни. Для выявления влияния АЭ мРНК в различных кластерах на прогноз пациентов применялась регрессия Кокса с подсчетом отношения рисков (ОР). Различия считали достоверными при p < 0,05 %.
Результаты исследования и их обсуждение
Общее описание исследованной группы
Средний возраст пациентов на момент операции составил 59,13 ± 2,96 года. Мужчины составляли 58 %, женщины – 42 %. Опухоли височной доли доминировали, они были обнаружены в 36 % случаев, за ними следовали опухоли лобной доли, что составило 24 % случаев, а затем – опухоли теменной доли с 22 % случаев, опухоли затылочной доли – 16 % и, наконец, 2 % опухолей имели стволовую локализацию. Общая пятилетняя выживаемость в группе пациентов составила 4 % (рис. 1).
Подсчет АЭ мРНК CDK4 в различных кластерах и межкластерные сравнения
Проводился раздельный подсчет АЭ мРНК CDK4 в каждом кластере с вычислением средних значений. АЭ CDK4 была наибольшей в ПВК и составила 73,52 ± 3,46 %. Далее по уровню АЭ CDK4 следовал соседний ТВК, в котором этот показатель составил 60,77 ± 1,35 %. Затем несколько меньшие значение были выявлены в ТНК, где АЭ CDK4 составила 47,87 ± 3,8 %. Далее расположились ПК – 46,5 ± 1,29 % и ПНК – 16,62 ± 1,25 % (рис. 2).
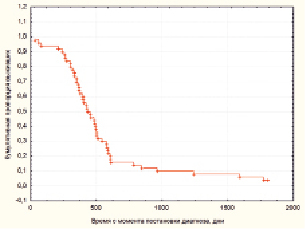
Рис. 1. Общая выживаемость исследованных пациентов с глиобластомой, кривая Каплан-Майер. По оси ординат – кумулятивная пропорция выживших пациентов, по оси абсцисс – время с момента постановки диагноза в днях
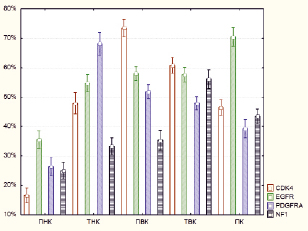
Рис. 2. Значения активности экспрессии (АЭ) матричных РНК CDK 4, EGFR, PDGFRA и NF1. По оси ординат обозначена АЭ в процентах, по оси абсцисс располагаются пять кластеров – перинекротический кластер (ПНК), транзиторный некротический кластер (ТНК), периваскулярный кластер (ПВК), транзиторный васкулярный кластер (ТВК), промежуточный кластер (ПК). Внутри каждого кластера проведен раздельный подсчет каждой мРНК (цветовые обозначения справа от графика)
Таблица 1
Статистическая достоверность различий активности экспрессии матричной РНК CDK4 в различных кластерах. Значимые различия выделены красным цветом
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
|
ПНК |
– |
p < 0,000001; Z = 8,35 |
p < 0,000001; Z = 8,62 |
p < 0,000001; Z = 8,61 |
p < 0,000001; Z = 8,46 |
|
ТНК |
p < 0,000001; Z = 8,35 |
– |
p < 0,000001; Z = 7,57 |
p < 0,000001; Z = 5,12 |
p = 0,689273; Z = 0,4 |
|
ПВК |
p < 0,000001; Z = 8,62 |
p < 0,000001; Z = 7,57 |
– |
p < 0,000001; Z = 5,42 |
p < 0,000001; Z = 8,28 |
|
ТВК |
p < 0,000001; Z = 8,61 |
p < 0,000001; Z = 5,12 |
p < 0,000001; Z = 5,42 |
– |
p < 0,000001; Z = 6,24 |
|
ПК |
p < 0,000001; Z = 8,46 |
p = 0,689273; Z = 0,4 |
p < 0,000001; Z = 8,28 |
p < 0,000001; Z = 6,24 |
– |
Таблица 2
Статистическая достоверность различий активности экспрессии матричной РНК EGFR в различных кластерах. Значимые различия выделены красным цветом
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
|
ПНК |
– |
p < 0,000001; Z = 7,07 |
p < 0,000001; Z = 7,93 |
p < 0,000001; Z = 7,82 |
p < 0,000001; Z = 8,53 |
|
ТНК |
p < 0,000001; Z = 7,07 |
– |
p = 0,081136; Z = 1,74 |
p = 0,120876; Z = 1,55 |
p < 0,000001; Z = 6,01 |
|
ПВК |
p < 0,000001; Z = 7,93 |
p = 0,081136; Z = 1,74 |
– |
p = 0,674104; Z = 0,42 |
p < 0,000001; Z = 5,45 |
|
ТВК |
p < 0,000001; Z = 7,82 |
p = 0,120876; Z = 1,55 |
p = 0,674104; Z = 0,42 |
– |
p < 0,000001; Z = 5,49 |
|
ПК |
p < 0,000001; Z = 8,53 |
p < 0,000001; Z = 6,01 |
p < 0,000001; Z = 5,45 |
p < 0,000001; Z = 5,49 |
– |
При этом стоит отметить, что выявленные различия между всеми кластерами носили статистически достоверный характер, за исключением ТНК и ПК – здесь достоверных различий не выявлялось (табл. 1).
АЭ мРНК EGFR в различных кластерах и межкластерный сравненительный анализ
Наибольшая АЭ мРНК EGFR наблюдалась в ПК и составила 70,49 ± 4,56 %. Далее следуют ПВК, ТВК и ТНК, в которых АЭ мРНК EGFR составляют 58,01 ± 5,16 %, 57,61 ± 3,27 % и 54,72 ± 1,47 % соответственно. Затем расположился ПНК со значением АЭ мРНК EGFR 35,59 ± 1,48 % (рис. 2). При этом выявленные отличия были достоверными между всеми кластерами, за исключением ПВК, ТВК и ТНК – они между собой по данному параметру не различались (табл. 2).
Определение АЭ мРНК PDGFRA в различных кластерах и межкластерные сравнения
При подсчете АЭ мРНК PDGFRA в различных кластерах было выявлено, что наибольшее его значение определяется в ТНК и составляет 68,14 ± 4,91 %. Далее по данному показателю следует ПВК, в котором он составляет 51,81 ± 3,17 %. Затем по АЭ мРНК PDGFRA располагаются ТВК – 47,93 ± 4,12 %, ПК – 39,25 ± 4,54 % и ПНК – 26,33 % (рис. 2). Различия между всеми кластерами были статистически достоверными (табл. 3).
АЭ мРНК NF1 в различных кластерах и межкластерные сравнения
Было выявлено, что наименьшая АЭ мРНК NF1 наблюдается в ПНК и составляет 24,96 ± 3,43 %. Далее располагаются ПВК и ТНК, в которых АЭ мРНК NF1 составляют 35,35 ± 6,69 % и 33,29 ± 4,43 %. Далее по возрастающей следуют ПК – 43.46 ± 4.24 %, и ТВК – 56,12 ± 4,58 % (рис. 2). Различия между всеми кластерами, за исключением ПВК и ТНК, носили достоверный характер (табл. 4).
Влияние АЭ различных мРНК в отдельных кластерах на прогноз пациентов
Далее мы провели оценку влияния АЭ всех исследуемых мРНК на общую выживаемость пациентов с ГБ с помощью регрессионного анализа по методу Кокса. Выяснилось, что ни одна из мРНК при подсчете её в целом в препарате, без учета кластерной гетерогенности, не обладала прогностической ценностью. При проведении дифференцированного анализа влияния АЭ мРНК в отдельных кластерах на прогноз пациентов было выявлено, что АЭ трех мРНК значимо связана с показателями общей выживаемости пациентов с ГБ. Так, АЭ мРНК CDK4 в ПВК имела наибольшее влияние на прогноз (табл. 5). Также на общую выживаемость пациентов значимо влияет АЭ мРНК PDGFRA в ТНК. Наконец, наименее значимое влияние на прогноз оказывал уровень мРНК NF1 в ПНК, АЭ которого отрицательно коррелировала с показателями выживаемости (табл. 5). Также при проведении мультипараметрического анализа выяснилось, что диагностическая модель, учитывающая АЭ мРНК CDK4 в ПВК, PDGFRA в ТНК и NF1 в ПНК, обладает наибольшей прогностической ценностью (p = 0,001345; ОР = 1,02).
Таблица 3
Статистическая достоверность различий активности экспрессии матричной РНК PDGFRA в различных кластерах. Различия между всеми кластерами были статистически значимы
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
|
ПНК |
– |
p < 0,000001; Z = 8,39 |
p < 0,000001; Z = 8,17 |
p < 0,000001; Z = 7,58 |
p = 0,000001; Z = 5,03 |
|
ТНК |
p < 0,000001; Z = 8,39 |
– |
p < 0,000001; Z = 6,09 |
p < 0,000001; Z = 6,87 |
p < 0,000001; Z = 7,69 |
|
ПВК |
p < 0,000001; Z = 8,17 |
p < 0,000001; Z = 6,09 |
– |
p = 0,049445; Z = 1,97 |
p < 0,000001; Z = 5,45 |
|
ТВК |
p < 0,000001; Z = 7,58 |
p < 0,000001; Z = 6,87 |
p = 0,049445; Z = 1,97 |
– |
p = 0,000057; Z = 4,03 |
|
ПК |
p = 0,000001; Z = 5,03 |
p < 0,000001; Z = 7,69 |
p < 0,000001; Z = 5,45 |
p = 0,000057; Z = 4,03 |
– |
Таблица 4
Статистическая достоверность различий активности экспрессии матричной РНК NF1 в различных кластерах. Значимые различия выделены красным цветом
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
|
ПНК |
– |
p = 0,000066; Z = 3,99 |
p = 0,000004; Z = 4,63 |
p < 0,000001; Z = 8,25 |
p < 0,000001; Z = 7,25 |
|
ТНК |
p = 0,000066; Z = 3,99 |
– |
p = 0,359207; Z = 0,92 |
p < 0,000001; Z = 7,46 |
p = 0,000002; Z = 4,76 |
|
ПВК |
p = 0,000004; Z = 4,63 |
p = 0,359207; Z = 0,92 |
– |
p < 0,000001; Z = 6,92 |
p = 0,000438; Z = 3,52 |
|
ТВК |
p < 0,000001; Z = 8,25 |
p < 0,000001; Z = 7,46 |
p < 0,000001; Z = 6,92 |
– |
p < 0,000001; Z = 5,32 |
|
ПК |
p < 0,000001; Z = 7,25 |
p = 0,000002; Z = 4,76 |
p = 0,000438; Z = 3,52 |
p < 0,000001; Z = 5,32 |
– |
Таблица 5
Значимость влияния активности экспрессии матричных РНК в отдельных кластерах и в образце в целом на прогноз пациентов. В ячейках приведены значения p и отношения рисков для соответствующего кластера и соответствующей матричной РНК (маркера). Статистически значимое влияние выделено красным цветом
|
Маркеры Кластеры |
CDK4 |
EGFR |
PDGFRA |
NF1 |
|
ПНК |
p = 0,694145; ОР = 0,99 |
p = 0,835566; ОР = 1 |
p = 0,066418; ОР = 0,97 |
p = 0,023626; ОР = 1,04 |
|
ТНК |
p = 0,607117; ОР = 0,99 |
p = 0,412205; ОР = 0,99 |
p = 0,003991; ОР = 0,97 |
p = 0,168929; ОР = 0,99 |
|
ПВК |
p = 0,002095; ОР = 0,95 |
p = 0,068166; ОР = 0,99 |
p = 0,25458; ОР = 0,99 |
p = 0,541925; ОР = 0,99 |
|
ТВК |
p = 0,346662; ОР = 0,99 |
p = 0,271331; ОР = 0,99 |
p = 0,506679; ОР = 0,99 |
p = 0,745824; ОР = 1 |
|
ПК |
p = 0,910576; ОР = 1 |
p = 0,373218; ОР = 0,99 |
p = 0,136252; ОР = 0,98 |
p = 0,665226; ОР = 1 |
|
В образце в целом |
p = 0,070865; ОР = 0,97 |
p = 0,547432; ОР = 0,99 |
p = 0,094917; ОР = 0,98 |
p = 0,653041; ОР = 1,01 |
В настоящей работе мы впервые попытались оценить внутриопухолевую гетерогенность ГБ и охарактеризовать распределение ключевых опухолевых клеточных популяций в различных клеточных кластерах, выделенных с учетом топографических данных и гистологических детерминант. Наши результаты оказались довольно интригующими. Выяснилось, что в самом активном кластере – ПВК – наиболее выражена экспрессия мРНК CDK4. При сопоставлении с результатами, полученными в исследовании Neftel с коллегами, можно сделать вывод, что триггером активности ПВК служат именно NPC клетки, для которых амплификация гена CDK4 является драйверным событием. Таким образом, NPC популяция опухолевых клеток является ключевой кластерообразующей единицей для ПВК. Тем не менее остальные клеточные популяции – OPC, AC и MES – также относительно активны в данном кластере, однако, по-видимому, играют лишь вспомогательную роль.
Второй по активности кластер – это ТНК. Здесь на лидирующие позиции уже выходит другая популяция клеток – OPC, в качестве ключевого драйверного молекулярного события в которой наиболее часто встречается амплификация гена PDGFRA. В целом полученные данные довольно четко коррелируют с исследованиями Neftel и коллег: по данным single-cell секвенирования наиболее пролиферативно активными клеточными популяциями являются NPC и OPC. Эти же клеточные популяции наиболее распространены в ПВК и ТНК, при том именно эти кластеры в свою очередь лидировали в отношении пролиферативной активности в нашем предыдущем исследовании [7].
Цитологическая картина в ТНК дополняется относительно высокой активностью MES клеток. По-видимому, это связано с соседствующим положением с ПНК, в котором MES клеточная популяция превалирует и является основной. Подобное распределение клеточных популяций также хорошо коррелирует с данными single-cell секвенирования: часть MES клеток экспрессирует преимущественно прогипоксическую транскрипционную программу [5]. Это может способствовать выживанию опухолевых клеток в условиях ПНК, отличающегося выраженными гипоксическими изменениями.
В ТВК практически в равной степени задействованы NPC и AC клеточные популяции при небольшом преобладании NPC клеток. Превалирование NPC может быть связано с близким расположением ПВК, являющимся основной нишей для NPC популяции в ткани ГБ.
Наконец, в ПК ключевую роль играет AC клеточная популяция. При этом некоторое значение имеет также и MES клеточная популяция, причем в данном случае, по-видимому, речь идет о втором подтипе MES клеток с активацией провоспалительной транскрипционной программы [5].
Заключение
Таким образом, наши исследования демонстрируют важные закономерности фундаментальных свойств внутриопухолевой гетерогенности в ГБ. Два наиболее активных клеточных кластера, выявленных нами ранее, формируются в основе своей двумя наиболее пролиферативно активными клеточными популяциями. По-видимому, именно ПВК и ТНК с NPC и OPC клеточными популяциями в качестве драйверов являются главными движущими силами развития и прогрессирования ГБ. Это подтверждается также и клиническими данными, полученными в нашем исследовании. Нам удалось показать, что АЭ ключевых молекулярных маркеров в виде мРНК CDK4, PDGFRA и NF1 в основных клеточных популяциях трех кластеров – ПВК, ТНК и ПНК – значимо влияет на общую выживаемость пациентов с ГБ. Дифференцированный кластерный подход к оценке молекулярных свойств опухоли имеет высокую фундаментальную и практическую ценность, поскольку ранее все исследования прогностической значимости генов CDK4, PDGFRA и NF1, основанные на молекулярном анализе статуса данных факторов в опухоли в целом, не смогли продемонстрировать влияние их мутационных изменений на общую выживаемость пациентов [8–10]. При этом определенное значение может иметь также тот факт, что в целом наш подход ориентирован в первую очередь на функциональный принцип оценки молекулярных свойств опухолевых клеток. С этой целью мы использовали именно РНК флуоресцентную гибридизацию in situ, позволяющую охарактеризовать количественно уровень экспрессии изучаемых молекулярных факторов. За счет максимального приближения с помощью данного методологического подхода непосредственно к уровню реализации молекулярных патологических потенций в клетке удается добиться оценки молекулярных свойств опухоли, более адекватно описывающей степень её биологической агрессивности и злокачественности. Поэтому данный подход открывает новые перспективы как в области фундаментальных, так и клинико-практических изысканий, нацеленных на всеобъемлющую оценку свойств внутриопухолевой гетерогенности как ключа к эффективному таргетному лечению ГБ в рамках современной концепции персонализированной медицины.

