Гуминовые соединения природного происхождения относятся к высокоэффективным веществам, обладающим полисистемным фармакологическим действием, обусловленным иммуно-стимулирующими, регенераторными, противовоспалительными свойствами [1]. В растворах они в основном присутствуют в диссоциированном состоянии (кислоты). Данные кислоты характеризуются подобием структурного ароматического углеродного скелета с функциональными группами (карбоксильные, гидроксильные, метоксильные и алкильные группы) и периферической группой соединений, обогащенных полисахаридными и полипептидными фрагментами. При гидролизе кислоты в раствор переходят в основном ее низкомолекулярные фрагменты, амино- и моносахариды. Гуминовые соединения по составу подобны аминокислотам, находящимся в растениях и бактериальной плазме в тех же соотношениях, что и в природной среде [2].
Биологическая эффективность препаратов на основе гуминовых кислот четко определяется местом их добычи, идентичностью по составу, природным композициям и их содержанием в водной среде, в основном в малых и относительно больших диапазонах концентраций. Их абсолютная активность определяется уровнем концентрации образующихся перекисных анионных радикалов в диапазоне от 10 до 20 мкг/л, что обеспечивает поддержание электрического равновесия клеточных мембран и органелл и сопровождается активацией энергетической системы клетки (окислительной фосфорилирующей системы и АТФ-продуцирующей способности АТФ-синтазы митохондрий клеток), а также усиливает каталитическое действие клеточных ферментов и коферментов, восстанавливает активность электронно-транспортных цепей клеточного гомеостаза, усиливает антиоксидантную активность и резервы адаптации клеточного иммунитета [3].
Механизм фармакологического действия данных препаратов связывают, как правило, с адсорбционной способностью кислот, ионообменом и комплексообразованием [2]. Однако не представляется возможным выделить из смеси гуминовых веществ действующее начало, так как разделение смеси кислот приводит к потере их фармакологических свойств. До настоящего времени ни одному из исследователей не удалось выделить в структуре макромолекул гуминовых кислот участок или функциональные группы, определяющие конкретный вид биологической активности [4]. Очевидно, что подобные особенности данных препаратов не связаны с единым механизмом действия, предполагающим исключительно контактные физико-химические процессы превращения веществ и их связывание.
В последние годы обращается внимание на принципиально иные механизмы действия природных соединений и воды, основанные на квантовых обменных процессах между квантово-сопряженными системами. В подобных сопряженных системах участником взаимодействия, с одной стороны, является водный раствор гуминовых кислот, а с другой – природный резервуар энергии делокализованных электронов (грунты) [5].
В квантовой физике под сопряженными объектами понимаются идентичные по физическим свойствам объекты, квантовое взаимодействие между которыми определяется делокализованными электронами в структурах аморфного вещества (фазы ассоциированной воды), что предполагает идентичность их строения, а также, возможно, подобие других особенностей макроскопического квантового объекта (формы, пространственной структуры, микроскопической организации, квантового состояния) [6, 7]. Как правило, такие условия возникают при разделении изотропного по составу макроскопического объекта. Например, воду из одного сосуда разливают в две емкости, между которыми устанавливается квантовое сопряжение, которое поддерживается до тех пор, пока химический состав образцов и структурная организация фазы ассоциированной воды существенно не изменились под влиянием внешней среды. Данное физическое явление известно в квантовой физике как квантовая нелокальность, которая может наблюдаться не только для элементарных частиц, но и для макроскопических объектов, находящихся в квантово-коррелированном состоянии [7, 8].
Однако само по себе квантовое сопряжение между взаимодействующими объектами недостаточно для реализации эффективного переноса электронов. Интенсификация обменных электронных процессов между сопряженными объектами требует дополнительных условий, которыми является возбуждение квантовой системы, реализуемое при возникновении фазовых неустойчивостей в ассоциированной воде, являющейся носителем делокализованных электронов [9].
В квантово-сопряженной системе растворов гуминовых соединений исходным донором электронов являются грунты залегания пелоидов. Гуминовые кислоты в пелоидах характеризуются высокими отрицательными значениями окислительно-восстановительного потенциала, которые достигают в анаэробных условиях грунтов максимальных величин в летнее время (Еh = –810мВ), а минимальных – в весенний период (Еh = –390 мВ). Продукты анаэробного микробиологического превращения пелоидов и образуемые из них надкислоты (при увлажнении грунтов и частичной аэрации) обеспечивают высокие электрон-донорные свойства полугидроморфных почв болот. Их абсолютная активность определяется уровнем концентрации образующихся перекисных анионных радикалов в диапазоне от 10 до 20 мкг/л, что обеспечивает поддержание электрического равновесия клеточных мембран и органелл и сопровождается активацией энергетической системы клетки (окислительной фосфорилирующей системы и АТФ-продуцирующей способности АТФ-синтазы митохондрий клеток), а также усиливает каталитическое действие клеточных ферментов и коферментов, восстанавливает активность электронно-транспортных цепей клеточного гомеостаза, усиливает антиоксидантную активность и резервы адаптации клеточного иммунитета.
Для реализации акцепторной способности препарата, находящегося в нелокальном квантовом сопряжении с донором электронов (электрически активными грунтами), необходимо возбуждение квантовой системы водного раствора препарата (акцептора электронов). Это достигается тем, что в процессе растворения препарата в воде гуминовые кислоты оказывают модулирующее влияние на состояние фазы ассоциированной воды. При этом происходит увеличение доли фазы ассоциированной воды [5]. В ней появляются дополнительные дефекты структуры с парамагнитным кислородом (О^^2), служащие ловушками для делокализованных электронов (2е-). Протекающие квантово-физические процессы могут быть представлены схемой, согласно которой на начальном этапе образуется короткоживущий супероксидный анион-радикал (О2-(*)(Н2О)асс.), а затем относительно стабильный пероксид-анион-радикал (НО2-(*)(Н2О)асс.):
2е- + О2(Н2О)асс.→О2-(*)(Н2О)асс. →НО2-(*)(Н2О)асс. ,
где (Н2О)асс. – структуры фазы ассоциированной воды [9].
Следовательно физический механизм усиления электрон-донорной способности водных растворов гуминовых препаратов, связанный с растворением препаратов, заключается в инициировании квантовой конденсации электронов (стимулированном запуске процесса квантовой конденсации) из пространственно сопряженных структур грунтов с низкими значениями окислительно-восстановительного потенциала с последующим накоплением нестабильных анион-радикалов в фазе ассоциированной воды, которая при попадании в организм распадается с переносом электронов на водные структуры мембран (акцепторы электронов).
Цель исследования: изучение электрон-донорной активирующей способности растворов гуминовых кислот (концентрата биодоступных органических кислот, полученного из реликтовых природных органических месторождений, производитель – ООО «Вио-Фарм» (далее «гуминовый концентрат»)) за счет нелокального взаимодействия их с электрон-донорными грунтами, согласующимися по составу и структуре с гуминовыми веществами, используемыми для приготовления препарата.
Материалы и методы исследования
Исследования процессов нелокального переноса электронов на водную среду проводились при постоянной температуре (35 °С) на свежеприготовленных растворах препарата («гуминовый концентрат») различной концентрации в термостатируемых условиях (термостат «Biosan»). Регистрация переноса электронов на водную среду осуществлялась по изменению значений окислительно-восстановительного потенциала (прибор рН-013 – высокоточный прибор для измерения рН, ОВП и температуры воды) и концентрации пероксидных анион-радикалов (кинетический хемилюминесцентный анализатор ЛИК [9]). Растворы препарата готовились на предварительно термостабилизированной воде в различных концентрациях в полимерных емкостях (0,5 л) и снова помещались в термостат. Определение значений окислительно-восстановительного потенциала растворов проводилось периодически с интервалом в несколько минут между измерениями.
Нелокальная активирующая способность растворов оценивалась по изменению концентрации пероксидных анион-радикалов (НО2-(*)) в дистиллированной воде, находящейся в непосредственном контакте с исследуемым раствором препарата при комнатной температуре из-за окрашивания растворов препарата, что затрудняет фиксацию анион-радикалов при использовании хемилюминесценции.
Результаты исследования и их обсуждение
Анализ зависимости, приведенной на рис. 1, показывает, что абсолютные величины потенциала (Eh), устанавливающего процесс накопления электронов в форме анион-радикалов в воде, зависят от количества вносимого в воду препарата. Чем выше концентрация препарата, тем ниже значения окислительно–восстановительного потенциала. Снижение потенциала (активация раствора) протекает во времени в течение первых 20 мин.
Кроме того, полученные кинетические зависимости изменений Еh-потенциала указывают на периодическую осцилляцию его значений, что отражает наличие в растворах конкурирующих процессов активации и дезактивации (обменное взаимодействие с нелокальным источником электронов [9]) во времени. Синхронные изменения Eh в контрольном и опытных образцах свидетельствуют о вовлечении в обменные электронные процессы не только нелокальных источников электронов, но и о наличии вневременных изменений в собственных состояниях растворов (нелокальность 2 рода [10, 11]). При этом временные осцилляции потенциалов синхронизированы во времени, что позволяет утверждать, что процесс квантового взаимодействия образцов носит периодический макроскопический характер.
Параллельно осуществлялись измерения динамики концентрации пероксидных анион-радикалов в дистиллированной воде, находившейся в контакте со свежеприготовленным раствором препарата. Как следует из данных, представленных на рис. 2, в динамике концентрации пероксидных анион-радикалов (аппроксимирующая линия) отмечаются временные неравномерные колебания. Так, в интервале 0–50 мин происходит рост активности, а затем последующее ее падение. Повторный «всплеск» активности отмечается в интервале экспозиции 180–220 мин (в условиях настоящего эксперимента).
Подобное изменение каталитической активности раствора отражает, так же как и на предыдущем графике, эффекты не только пространственной, но и временной нелокальности процессов активации, проявляющихся в знакопеременных направлениях потоков электронов между двумя квантовыми объектами.
Активные состояния растворов сохраняются в течение 20–80 мин от начала экспозиции. В последующие интервалы времени растворы теряют свою активность и по истечении времени порядка 170 мин они приобретают электрон-акцепторные свойства, что может оказывать отрицательное влияние на организм человека.
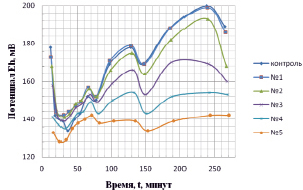
Рис. 1. Динамика изменений значений окислительно-восстановительного потенциала растворов гуминовых кислот (препарат «гуминовый концентрат»). Разведения в отстоянной водопроводной воде: № 1 – контроль; № 2 – 15 мл/л; № 3 – 30 мл/л; № 3 – 60 мл/л; № 4 – 90 мл/л; № 5 – 120 мл/л концентрата раствора кислот (концентрация – 1 г/л)
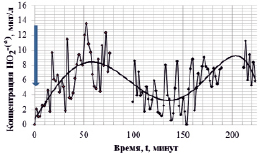
Рис. 2. Динамика изменений средних значений концентрации (сплошная кривая) и временные осцилляции концентрации (кривая с маркерами) пероксидных анион-радикалов в дистиллированной воде при неконтактном действии смесевого раствора гуминовых кислот (объем активирующего раствора с концентрацией препарата «гуминовый концентрат» 90 мл/л – 1 л, объем воды в полипропиленовой емкости, размещенной в емкости с активирующим раствором – 250 мл). Стрелка указывает на момент разведения препарата
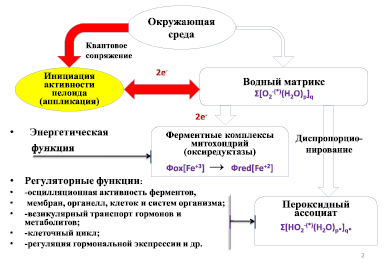
Рис. 3. Схема основных транспортных путей переноса электронов в квантово–сопряженной системе «грунт – раствор препарата – организм» в процессе взаимодействия организма человека с активированным раствором препарата «гуминовый концентрат»
Из этого следует, что эффекты квантовой нелокальности электрически активных структур пелоидов (препаратов) и технологии, реализующие эти процессы, являются определяющими, обеспечивающими перенос электронов из квантово-сопряженных структур грунтов на водные растворы препарата. Это формирует высокую биологическую эффективность свежеприготовленных растворов гуминовых кислот.
Полученные экспериментальные результаты показывают, что инициация процесса активации препарата на основе гуминовых кислот при его растворении в воде отрывает дополнительный канал поступления электронов из квантово-сопряженных грунтов на водную квантово-коррелированную структуру (рис. 3).
Электроны, накопленные в фазе ассоциированной воды, поступают на водный матрикс митохондрий, что обеспечивает увеличение их энергетической функции (нелокальная активация синтеза АТФ АТФ-синтазой [5]). При этом дополнительно в водной фазе клеток происходит наработка пероксидных ассоциатов, выполняющих регуляторные, транспортные и контрольные функции в клеточных структурах [5, 9].
Поступление электронов в организм восстанавливает нарушения в структурно-физическом состоянии внутриклеточной фазы ассоциированной воды, ответственной за системный гомеостаз клетки, включая колебательную активность ферментов, мембран, органелл клеток и систем организма. При этом интенсифицируется внутриклеточный везикулярный транспорт метаболитов и гормональных регуляторов, нормализуется баланс экспрессии гормональных регуляторов, восстанавливается клеточный цикл и нормальный уровень апоптоза клеток [9].
Растворы препарата «гуминовый концентрат» являются высокоактивными электрон-донорными средами, обеспечивающими эффективный перенос электронной активности в организм человека. Их абсолютная активность определяется уровнем концентрации нарабатываемых пероксидных анион-радикалов в диапазоне от 10 до 20 мкг/л, что обеспечивает поддержание электрической неравновесности мембран и органелл клеток и сопровождается активизацией энергетической системы клетки (системы окислительного фосфорилирования и АТФ-продуцирующую способность АТФ-синтазы митохондрий клеток), а также увеличивает каталитическое действие клеточных ферментов и ко-ферментов, восстанавливает активность электрон-транспортных цепей гомеостаза клеток, усиливает антиоксидантную активность и резервы адаптации клеточного иммунитета [11].
Заключение
Исходя из предложенного механизма действия препарата «гуминовый концентрат», данное средство относится к препаратам системного гомеостатического действия, оказывающим регуляторное и энергетическое действие на клеточные структуры организма. Эта способность препарата определяется его нелокальным сопряжением с электрон-донорными иловыми отложениями, обеспечивающими поставку электронов в фазу ассоциированной воды в процессе разведения препарата водой, с последующим переносом заряда на мембраны клеточных структур организма при принятии водного раствора «гуминовый концентрат» in vivo.
Установлено, что перенос электронов от донора к акцептору в системе «грунт – фаза ассоциированной воды – мембраны» происходит во времени в знакопеременных направлениях, что необходимо учитывать при лечебном, бальнеологическом и профилактическом использовании препарата.
В целом препарат «гуминовый концентрат» представляет собой высокоактивную электрон-донорную среду, обеспечивающую поддержание электронной неравновесности мембран и органелл клеток, а также осуществляющую активизацию энергетической системы клеток, регуляцию их метаболической активности (включая регуляторные опероны ДНК) и транспортные функции в системах лиганд-рецепторного взаимодействия и эндосомальных циклов.

