Яровая мягкая пшеница имеет множество заболеваний, возбудителями которых являются вирусы и микоплазма, бактерии, грибы, нематоды. Все эти болезни фенотипически достаточно хорошо идентифицируются.
Вирусные болезни растений делятся на две группы: мозаики и желтухи [1]. Вирусы полосатой мозаики относятся к семейству Potyviridae [2]. Мозаика характеризуется мозаичной расцветкой листьев, которая может сопровождаться некрозами [1–4]. Для желтух характерно более равномерное изменение окраски листьев, чрезмерное кущение, короткоузлие. При этом возбудителями некоторых болезней типа желтух являются не вирусы, а микоплазмы, занимающие промежуточное положение между вирусами и бактериями. Поражение вирусами в ряде случаев вызывает закукливание злаков. Характерными признаками данной болезни являются усиленное кущение, сильное отставание в росте, карликовость [3].
Среди заболеваний бактериального характера выделяют: черный бактериоз, базальный бактериоз, бактериальный ожог, желтый слизистый бактериоз, белую пятнистость, бурый бактериоз, бактериальную мозаику, бактериальную пятнистость, бактериальную гниль, пятнистый бактериоз, стеблевой меланоз, бактериальную гниль влагалища листа, розовый бактериоз [5]. Их возбудителями являются палочковидные бактерии, относящиеся к родам Pceudomonas, Xanthomonas и Bacillus [3]. Возбудители бактериоза пшеницы поражают в основном все органы надземной части вегетирующих растений и фенотипическое проявление данного вида заболеваний заключается в появлении на стеблях, листьях, колосе пятен различного цветового оттенка с дальнейшей их трансформацией [3, 5, 6].
Грибные болезни могут быть разделены на грибы, поражающие надземную часть растений, и грибы, поражающие корневую систему (корневые гнили). К первой категории относятся головневые, ржавчинные болезни, мучнистая роса, септориозные пятнистости [3, 7, 8].
Возбудитель стеблевой головни (Urocystis tritici), поражает листья, влагалище, стебель. В результате на их поверхности появляются длинные черные полосы, прикрытые эпидермисом. Объектом поражения возбудителей твердой (Tilleetia caries, T. levis), карликовой (Tilleetia controversa), и пыльной (Ustilago tritici) головни является колос растения. При этом все органы колоса превращаются в черную, сажистую массу (пыльная головня), либо вместо зерновок формируются головневые мешочки. При поражении пшеницы возбудителем спорыньи (Claviceps purpurea) в цветках колоса образуются склероции [7].
Объектом поражения ржавчинных болезней также является надземная часть растения. Возбудители стеблевой (Puccinia graminis f. sp. trutuci) и желтой (Puccinia striformis) ржавчины поражают стебли, листовые влагалища, колосковые чешуйки, ости [3, 7]. При стеблевой ржавчине образуются крупные оранжевые или кирпично-красные уредопустолы, располагающие линейными рядами. В случае поражения растений возбудителем желтой ржавчины появляются уредопустулы от ярко-оранжевого до желтых. На листьях возникают продольные полосы, располагающие вплотную друг к другу [3, 7, 8]. Объектом поражения возбудителя бурой ржавчины (Puccinia recondita f. sp. trutuci) является листовой аппарат растений пшеницы. Болезнь проявляется в виде бурых или желтых мелких округлых или овальных порошащих пустул [3, 7, 8].
Возбудитель мучнистой росы (Eresiphe graminis f. sp. Tritici) – это облигатный паразит, который встречается в основном на листьях в виде белого мучнистого, а затем паутинного налета [7, 8].
Надземная часть растений также может поражаться септариозом. Основными возбудителями данной болезни являются Stagonospora (Septoria) nodorom Berk и Septoria tritici [3]. Гриб S. tritici поражает в основном листья, где заболевание проявляется в виде желтовато-коричневых полос или темно-бурых пятен. S. nodorum поражает все надземные органы растений. На листьях образуются хлоротичные пятна, на междоузлиях – белесоватые или бурые расплывчатые пятна [3]. Первые признаки болезни проявляются на колеоптиле. Схож по своему проявлению и ризоктониоз, возбудителем которой является Rhizoctonia cerealis, R. Solani [7].
Особую группу составляют грибы, поражающие корневую систему пшеницы. В зависимости от типа возбудителя различают следующие виды корневых гнилей злаковых культур.
Фузариозная корневая гниль (возбудители: Fusarium culmorum, F. avenaceum, F. oxysporum, F. gibbosum, F. graminearum и др). Поражает всходы и взрослые растения. Проявляется в виде побурения проростков, первичных и вторичных корней, узла кущения. Фенотипическим проявлением болезни является трухлявость корней, побеление стебля, пустоколосость [3, 7, 9].
Гельминтоспориозная корневая гниль вызывается грибами Bipolaris sorokiniana. Возбудитель сначала поражает проростки и приводит к их гибели. На фазе выхода в трубку начинают буреть подземное междоузлие, основание стеблей. Корни загнивают и отмирают. При этом наблюдаются бурая пятнистость листьев и черный зародыш зерна [3, 7, 9, 10].
Офиоболезная корневая гниль. Возбудитель – Ophiobolus graminis Syn. Gaeumannomyces graminis. Мицелий данного гриба проникает в ткани корня и затем в проводящую систему растения пшеницы. По прошествию некоторого времени растения могут погибнуть [8]. Симптомы: почернение зародышевых и мочковатых корней, стеблевого междоузлия [7].
Церкоспореллез (Pseudocercosporella herpotrichoides) вызывает гниль корневой шейки. На надземной части растения образуются светлые, элипсовидные пятна в виде глазка. Иногда они окольцовывают стебель. Внутри соломины образуется серый налет спороношения гриба [3, 7].
Нематодные болезни. Возбудитель Anguina Tritici в основном обитает в почве. Заболевание в период вегетации проявляется в виде искривления стебля и деформации листьев. Нематоды, поражающие корневую систему (Heterodera avenea, Meloidogyne spp., Pratylenchus spp.), развиваются на корневой системе всходов, которая утолщается и разветвляется. Позже появляются наросты и цисты, вначале белые, затем темно-коричневые [3].
Таким образом, все ныне известные болезни, имеющие место своего проявления на мягкой пшенице, достаточно хорошо изучены. Однако в ходе работ, проводимых по программе научных исследований, нам пришлось столкнуться с проявлением заболевания растений пшеницы, которое не было ранее описано и идентифицировано.
Цель исследования: определить причины гибели растений яровой мягкой пшеницы.
Материалы и методы исследования
Исследования причины гибели растений осуществлялись на посевах с проявлением данного вида заболевания. Таким очагом поражения оказались опыты, проводимые по цитогенетике пшеницы. В данном случае в качестве объектов исследования оказались серии моносомных линий сортов пшеницы Чайниз Спринг (21 линия) и Мильтурум 553 (21 линия). В качестве контроля высевали F1 сестринских дисомиков и исходные эуплоидные сорта Чайниз Спринг и Мильтурум 553. Закладка опытов осуществлялась на двух разных участках (сетчатый дворик, опытный участок – поле), по пару, в оптимальные сроки, в четырехкратной повторности с площадью питания растений 10х20 см. По каждой линии в повторности высевали 30 зерен. Варианты опыта в повторности размещали рендомизированно. В одном из вариантов опыта, перед посевом, семена и почву обрабатывали мощным природным биофунгицидом – триходермином (Trichoderma) [11–13]. В процессе вегетации растений проводились соответствующие фенологические наблюдения и уход за посевами (прополка, защита растений от вредителей).
Микробиологические исследования проводились на фиксированных окрашенных фуксином препаратах с помощью светового микроскопа МБИ 3 при увеличении 90х10. Перед приготовлением биологических препаратов корневую систему и узел кущения растений тщательно промывали под проточной водой с последующей обработкой их 96 % этиловым спиртом и легким обжиганием на пламени спиртовки. После тщательного просмотра корневой системы под световым микроскопом МБС 9, производился срез в зоне корневой шейки и из полученного среза выдавливали сок на предметное стекло с последующими процессами приготовления временного фуксинового препарата. Кроме того, цитологические исследования проводились на почвенной вытяжке, взятой из-под больных (погибших) растений.
Посев биологического материала, выделенного из зоны корневой шейки, осуществляли на плотные питательные среды (агар-агар) с помощью микробиологической петли. Посев проводили в пробирки со скошенным агар-агаром зигзагообразным способом [14]. Посевы на твердые питательные среды в чашках Петри осуществляли «газонным» способом. В качестве питательных сред использовали среду Чапека, Эшби и рыбный агар [15]. Микрофотосъемку проводили с помощью светового микроскопа МБИ 11, снабженного микрофотонасадкой МФН 12У при увеличении 90х10.
В лабораторных условиях осуществляли заражение растений пшеницы, выращенных в цветочных горшочках. Для этого в фазу кущения проводили инъекцию в зону корневой шейки бактерий, взятых из субстрата, выделенного от больных растений, их газонного посева и посева почвенной вытяжки в чашках Петри.
Результаты исследования и их обсуждение
После посева всходы появлялись на 6–7 сутки. Развитие растений по всем вариантам опыта шло нормально до начала кущения. Проблемы начинались, когда растения переходили на автономное питание, вступив в межфазный период кущение – выход в трубку. Хорошо раскустившиеся растения внезапно погибали. При этом их гибель наступала настолько скоротечно, что они не успевали пожелтеть и засыхали зелеными подобно скошенной траве (рисунок).
Наблюдавшаяся гибель растений продолжалась и на последующих стадиях развития. Причем в первую очередь засыхали боковые побеги, и если растение выживало, то к концу вегетации оно было представлено в виде одного стебля.

а) б) в) г)
Рис. 1. Гербарий растений яровой мягкой пшеницы: а – здорового растения; б – погибшего на ранней стадии кущения; в – погибшего на стадии полного кущения; г – погибшего на стадии выхода в трубку
Гибель растений в полевых опытах при разреженном посеве (20х10 см)
|
Год проводимых исследований |
Материал |
Кол-во раскустившихся растений |
Кол-во погибших растений, % |
|
1979 (поле) |
Серия моносомных линий сорта пшеницы Чайниз Спринг |
1048 |
95,23 |
|
Дисомный контроль (F1 сестринских дисомиков) |
163 |
93,25 |
|
|
Сорт Чайниз Спринг |
175 |
90,29 |
|
|
Серия моносомных линий сорта пшеницы Мильтурум 553 |
1096 |
50,09 |
|
|
Дисомный контроль (F1 сестринских дисомиков) |
166 |
50,00 |
|
|
Сорт Мильтурум 553 |
164 |
39,64 |
|
|
1981 (сетчатый дворик)* |
Серия моносомных линий сорта пшеницы Мильтурум 553 |
2026 |
51,83 |
|
Дисомный контроль (F1 сестринских дисомиков) |
162 |
40,74 |
|
|
Сорт Мильтурум 553 |
157 |
42,04 |
Примечание. * Закладка опыта и его проведение осуществлялась c обработкой семян и посевов триходермином.
По данным статистического анализа, моносомные линии и контроль сорта Чайниз Спринг имели более значительные выпады, чем Мильтурум 553 (таблица). В первом случае доля погибших растений, от общего количества раскустившихся, достигала 95 %, во втором – 50 %. Причем доля гибели растений на обработанном участке триходермином мало чем отличалось от контроля (таблица).
Несмотря на то, что закладка опытов всегда проводилась по пару, гибель растений наблюдалась в течение многих лет (1975–1982). При этом прямое влияние абиотических факторов полностью исключается самим характером проявления гибели растений. Так, если это было бы связано с агрохимическими особенностями почвы, то угнетение развития посевов имело бы территориальное определение (проявление отдельными участками). Тем не менее гибель отдельных растений проявлялась по всему опытному участку в рендомизированном порядке, когда среди здоровых форм наблюдались погибшие или больные.
Из биотических факторов можно также исключить все возбудители, вызывающие поражение надземной части растения, так как фенотипические проявления ее у анализируемого материала полностью отсутствовали. Характер проявления заболевания и гибели растений свидетельствовал о наличии поражения корневой системы. При этом значительных повреждений, вызываемых энтомологическими факторами (проволочник, скрытостебельные вредители, нематода), не наблюдалось. При проведении тщательного осмотра поверхности больных и погибших растений под микроскопом МБИ 9 не были обнаружены какие-либо признаки известных болезней растений злаковых культур, включая корневые гнили. Однако характер проявления болезни растений мягкой пшеницы подобно «скошенной траве» или «сена» свидетельствует о том, что их гибель связана с прекращением поступления в надземную часть сока от корневой системы и указывало на ее связь с функцией сосудопроводящей системы.
Результаты проведенных анатомических исследований показали, что на срезе проводящие сосуды выглядели в виде темно-бурых пятен. При надавливании среза выделялась бурая масса, которая использовалась для приготовления цитологических препаратов.
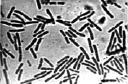
Результаты проведенных микроскопических исследований показали, что проводящие пучки в зоне корневой шейки на 100 % были забиты бактериями. Причем бактерии имели палочковидную форму, состоящую из двух смежных элементов (рис. 2, а).
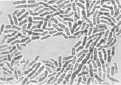
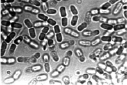
Выделенные из зоны корневой шейки больных растений бактерии были пересеяны на косой агар-агар в пробирки со средой Чапека [15]. Кроме этого использовались питательные среды Эшби и рыбный агар [15]. Во всех случаях размножались только бактерии. Однако, в отличие от исходного образца, бактерии при пересеве несколько утрачивали свою первоначальную форму, обретая более округлые очертания и сокращаясь в длине (рис. 2, б). Пробы почвы на микрофлору, взятые из-под погибших растений, также показали наличие бактерий, имеющих бочонкообразную форму (рис. 2, в). Во всех случаях выделялись только бактерии. Посевы, сделанные на чашках Петри, также не выявили наличие каких-либо грибов. Способность выделенных нами бактерий расти на питательной среде, лишенной нитратов (среда Эшби), дает основание считать, что закупоривание проводящих сосудов растений вызывают азотобактеры [16]. Предположение о том, что выделенные бактерии являются азотобактерами, подтверждается характерным для них плеоморфизмом (рис. 2).
а) б) в)
Рис. 2. Бактерии, выделенные из зоны корневой шейки погибших растений (а); после пересева их на питательную среду Чапека (б); бактерии водной вытяжки почвы из-под погибших растений

а) б)
Рис. 3. Растения яровой мягкой пшеницы в фазу кущения: а – здоровое; б – после инъекции бактерий, взятых из субстрата корневой шейки. Стрелкой указано погибшее растение
Опыты с растениями, выращенными в лабораторных условиях, показали, что инъекция, проведенная в зону корневой шейки, бактерий, взятых непосредственно из зоны корневой шейки больных и погибших растений, приводила к аналогичной с полевыми опытами гибели растений (рис. 3). Повторно выделенные бактерии были идентичны исходным формам бактерий. К сожалению, по техническим причинам автор не смог провести их идентификацию. Однако поставленная цель была достигнута.
Таким образом, в результате проведенных исследований установлено, что угнетение и гибель растений пшеницы на опытных участках были вызваны закупориванием сосудов в зоне корневой шейки бактериями палочковидной формы. В свою очередь это могло быть следствием неправильной эксплуатации земельного участка. Прежде всего, в сетчатом дворике использовался многопольный севооборот (10–12 ярусов). При этом обработка участка, из-за наличия опорных труб, поддерживающих сетчатую крышу, проводилась в двух направлениях (продольном и поперечном). В результате растительные остатки разносились по всем ярусам, что существенно снижало эффект парования. Из-за разностей периметров полевого участка его обработка также осуществлялась в поперечном направлении к предыдущему расположению ярусов. Очевидно, данные обстоятельства и послужили основной причиной приобретения свойств вирулентности обычных почвенных бактерий.

а)

б)
Рис. 4. Полевые опыты при разреженном посеве пшеницы: а – одиночные растения пшеницы, сохранившиеся на участке поражения к концу вегетации; б – растения в фазу колошения по двухлетнему пару
Выход из сложившейся ситуации был найден, когда закладку полевых опытов с разреженными посевами начали проводить по пару, полученному в результате продольной обработки почвы вдоль ярусов прошлого посева трехпольного севооборота и при посеве по двухлетнему пару. В этих условиях растения имели нормальное развитие и обладали максимальным проявлением своего генотипа (рис. 4, б), что имеет важное значение для генетических, цитогенетических, физиологических и других видов анализа, где исследования проводятся индивидуально по растениям.
Выражаю благодарность Борисенко Алексею Степановичу за оказанную помощь в проведении работ по микробиологии. Также выражаю благодарность сотрудникам лаборатории микробиологии СибНИИСХ за предоставление питательных сред и допуска к оборудованию.

