Многие природные соединения, содержащие в своем составе хинолиновое ядро, проявляют биологическую активность, что привлекает к хинолину в последнее десятилетие пристальное внимание ученых. По сравнению с другими гетероциклическими соединениями, производные хинолина являются наиболее перспективными для разработки новых фармацевтических препаратов. Обзор [1] посвящен синтезу производных хинолина с усиленной биологической активностью за счет включения активной функциональной группы в хинолиновое кольцо. Работы [2, 3] рассматривают синтетические подходы к синтезу структурно разнообразных хинолинов.
Хинолин – конденсированный гетероцикл с широким спектром химиотерапевтического действия. Хинолиновый каркас, введенный в различные молекулы, сообщает им разнообразную биологическую активность, что позволяет использовать его для разработки новых лекарственных препаратов. Известны производные хинолина, проявляющие противотуберкулезную, противомалярийную, противоопухолевую, антибактериальную, антигельминтную, противовирусную, антипротозойную, противогрибковую, противовоспалительную, анальгетическую, цитотоксическую активность и др. [4–6].
Широкому спектру механизмов действия противоопухолевых препаратов на основе хинолина посвящены обзоры [5, 7]. Наиболее распространенным механизмом является ингибирование изоферментов тирозинкиназы. Наряду с этим производные хинолина действуют как ингибиторы роста за счет остановки клеточного цикла и как ингибиторы ангиогенеза опухолей. Кроме того, такие препараты вызывают нарушение миграции злокачественных клеток. Таким образом, производные хинолина можно рассматривать как наиболее перспективный класс активных фармацевтических агентов по сравнению с другими гетероциклическими соединениями.
Винилхалькогениды широко используются как полупродукты и синтоны в современном органическом синтезе [8–10]. Нуклеофильное присоединение органилхалькогенолат- или халькогенид-анионов к алкинам – основной способ получения винилхалькогенидов [10, 11]. Синтез новых потенциально биологически активных винилсульфидов с фармакофорными группами представляется, несомненно, актуальным.
Цель исследования: разработка эффективных методов синтеза ранее неизвестных функциональных винилсульфидов с потенциальной биологической активностью, содержащих фармакофорный хинолиновый каркас, на основе реакции нуклеофильного присоединения 2-меркаптохинолина к активированным ацетиленам.
Материалы и методы исследования
2-Меркаптохинолин – импортный реактив. Метилпропиолат – импортный реактив. Этилпропиолат – импортный реактив. Фенилэтинилкетон – импортный реактив.
Спектры ЯМР сняты на приборе Bruker DPX-400 в CDCl3 на рабочих частотах 400.13 (1Н) и 100.61 (13С) в CDCl3. Внутренний стандарт: ГМДС. Элементный анализ выполнен на CHNS-анализаторе Thermo Scientific Flash 2000. Температуры плавления измерены на приборе Boёtius (PHMK 05 VEB Wagetechnik Rapido). В реакциях использовались осушенные и перегнанные растворители.
(Z)- и (Е)-метил-3-(хинолин-2-илсульфанил)пропеноат (1, 3). К раствору 0.328 г (2.03 ммоль) 2-меркаптохинолина в 20 мл метилового спирта (подогретого на водяной бане для полного растворения) добавляют раствор 0,171 г (2,03 ммоль) метилпропиолата в 5 мл метилового спирта. Смесь перемешивают при комнатной температуре в течение 99 ч. Удаляют растворитель на роторе. Сушат в вакууме. Получают продукт в виде смеси Z- и E- изомеров в соотношении 10 : 0.5. Выход: 0,497 г (99 %), кристаллическое вещество бледно-желтого цвета. T пл. 82–84 °С.
(Z)-изомер (1). Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д. (J, Гц): 3.82 с (3H, CH3), 6.20 д (1H, =CH–C=O, 3Jцис = 10.2 Гц), 7.32–7.34 м (1H, Cquino), 7.48–7.52 м (1H, Cquino), 7.69–7.73 м (1H, Cquino), 7.76–7.78 м (1H, Cquino), 8.01–8.03 м (2H, Cquino), 8.91 д (1H, =CHS, 3Jцис = 10.2 Гц). Спектр ЯМР 13С (100.61 МГц, CDCl3), δ, м. д. (J, Гц): 51.71 (CH3), 114.20 (=CH), 121.32 (Cquino), 126.32 (Cquino), 127.06 (Cquino), 127.88 (Cquino), 128.49 (Cquino), 130.34 (Cquino), 136.83 (Cquino), 141.59 (=CHS), 148.11 (Cquino), 154.99 (NCS, Cquino), 167.39 (C=O).
(Е)-изомер (3). Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д. (J, Гц): 3.82 с (3H, CH3), 6.23 д (1H, =CH–C=O, 3Jтранс = 16.0 Гц), 7.32–7.34 м (1H, Cquino), 7.48–7.52 м (1H, Cquino), 7.69–7.73 м (1H, Cquino), 7.76–7.78 м (1H, Cquino), 8.01–8.03 м (2H, Cquino), 8.93 д (1H, =CHS, 3Jтранс = 16.0 Гц). Спектр ЯМР 13С (100.61 МГц, CDCl3), δ, м. д. (J, Гц): 51.71 (CH3), 114.20 (=CH), 121.32 (Cquino), 126.32 (Cquino), 127.06 (Cquino), 127.88 (Cquino), 128.49 (Cquino), 130.34 (Cquino), 136.83 (Cquino), 141.59 (=CHS), 148.11 (Cquino), 154.99 (NCS, Cquino), 167.39 (C=O). Найдено, %: С 63.72; Н 4.63; N 5.96; S 13.13. C13H11NO2S. Вычислено, %: С 63.65; Н 4.52; N 5.71; S 13.07.
(Z)- и (Е)-этил-3-(хинолин-2-илсульфанил)пропеноат (2, 4). К раствору 0.080 г (0,5 ммоль) 2-меркаптохинолина в 10 мл метилового спирта добавляют раствор 0,049 г (0,5 ммоль) этилпропиолата в 5 мл метилового спирта. Смесь перемешивают при комнатной температуре в течение 18 ч. Удаляют растворитель на роторе. Сушат в вакууме. Выход: 0,122 г (94 %), кристаллическое вещество бледно-желтого цвета. T пл. 76–78 °С.
(Z)-изомер (2). Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д. (J, Гц): 1.35 т (3H, CH3), 4.28 кв (2H, CH2), 6.19 д (1H, =CH–C=O, 3Jцис = 10.2 Гц), 7.31–7.34 м (1H, Cquino), 7.48–7.51 м (1H, Cquino), 7.69–7.73 м (1H, Cquino), 7.76–7.78 м (1H, Cquino), 8.01–8.03 м (2H, Cquino), 8.89 д (1H, =CHS, 3Jцис = 10.3 Гц). Спектр ЯМР 13С (100.61 МГц, CDCl3), δ, м. д. (J, Гц): 14.50 (CH3), 60.65 (CH2), 114.68 (=CH), 121.19 (Cquino), 126.29 (Cquino), 127.05 (Cquino), 127.88 (Cquino), 128.51 (Cquino), 130.30 (Cquino), 136.77 (Cquino), 141.20 (=CHS), 148.14 (Cquino), 155.14 (NCS, Cquino), 167.01 (C=O).
(E)-изомер (4). Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д. (J, Гц): 1.35 т (3H, CH3), 4.28 кв (2H, CH2), 6.24 д (1H, =CH–C=O, 3Jтранс = 16.0 Гц), 7.31–7.34 м (1H, Cquino), 7.48–7.51 м (1H, Cquino), 7.69–7.73 м (1H, Cquino), 7.76–7.78 м (1H, Cquino), 8.01–8.03 м (2H, Cquino), 8.92 д (1H, =CHS, 3Jтранс = 16.0 Гц). Спектр ЯМР 13С (100.61 МГц, CDCl3), δ, м. д. (J, Гц): 14.50 (CH3), 60.65 (CH2), 114.68 (=CH), 121.19 (Cquino), 126.29 (Cquino), 127.05 (Cquino), 127.88 (Cquino), 128.51 (Cquino), 130.30 (Cquino), 136.77 (Cquino), 141.20 (=CHS), 148.14 (Cquino), 155.14 (NCS, Cquino), 167.01 (C=O). Найдено, %: С 65.00; Н 5.23; N 5.66; S 12.43. C14H13NO2S. Вычислено, %: С 64.84; Н 5.05; N 5.40; S 12.37.
(Z)- и (Е)-1-фенил-3-(хинолин-2-илсульфанил)проп-2-ен-1-он (5, 6). Раствор фенилэтинилкетона 0,235 г (1,8 ммоль) в 5 мл этилового спирта добавляют к раствору 2-меркаптохинолина 0,291 г (1,8 ммоль) и гидроксида калия 0,01 г (0,18 ммоль) в 15 мл этилового спирта. Смесь перемешивают в течение 3 ч при комнатной температуре. Добавляют 0.01 г хлористого аммония для нейтрализации КОН. Удаляют растворитель на роторе. К полученному остатку добавляют 20 мл хлористого метилена. Фильтруют. Удаляют растворитель на роторе. Сушат в вакууме. Получают продукт в виде смеси Z- и E-изомеров в соотношении 4 : 1. Выход: 0,360 г (68 %), масло оранжевого цвета.
(Z)-изомер (5). Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д. (J, Гц): 7.32–7.34 м (1H, Cquino), 7.38–7.46 м (2H, =СН, Cquino), 7.51–7.52 м (4H, CPh,), 7.56–7.58 м (1H, Cquino), 7.63–7.65 м (1H, CPh), 7.71–7.75 м (1H, Cquino), 7.77–7.81 м (1H, Cquino), 8.05–8.07 м (2H, CPy), 9.20 д (1H, =CHS, 3Jцис = 9.8 Гц). Спектр ЯМР 13С (100.61 МГц, CDCl3), δ, м. д. (J, Гц): 117.31 (Cquino), 121.33 (=CH), 126.25 (Cquino), 127.01 (Cquino), 127.78 (Cquino), 128.17 (CPh), 128.33 (CPh), 128.68 (CPh), 130.19 (Cquino), 132.72 (Cquino), 136.71 (Cquino), 137.69 (CPh), 143.00 (=CHS), 147.95 (Cquino), 155.64 (NCS, Cquino), 189.27 (C=O).
(E)-изомер (6). Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д. (J, Гц): 7.32–7.34 м (1H, Cquino), 7.38–7.46 м (2H, =СН, Cquino), 7.51–7.52 м (4H, CPh,), 7.56–7.58 м (1H, Cquino), 7.63–7.65 м (1H, CPh), 7.71–7.75 м (1H, Cquino), 7.77–7.81 м (1H, Cquino), 8.05–8.07 м (2H, CPy), 9.14 д (1H, =CHS, 3Jтранс = 16.0 Гц). Спектр ЯМР 13С (100.61 МГц, CDCl3), δ, м. д. (J, Гц): 117.31 (Cquino), 121.33 (=CH), 126.25 (Cquino), 127.01 (Cquino), 127.78 (Cquino), 128.17 (CPh), 128.33 (CPh), 128.68 (CPh), 130.19 (Cquino), 132.72 (Cquino), 136.71 (Cquino), 137.69 (CPh), 143.00 (=CHS), 147.95 (Cquino), 155.64 (NCS, Cquino), 189.27 (C=O). Найдено, %: С 74.80; Н 4.63; N 4.96; S 11.23. C18H13NOS. Вычислено, %: С 74.20; Н 4.50; N 4.81; S 11.01.
Результаты исследования и их обсуждение
Ранее нами сообщалось о разработке эффективных методов синтеза функционально замещенных винилсульфидов с потенциальной биологической активностью на основе реакции пиридин-2-тиола с пропиоловой кислотой и с алкилпропиолатами [12, 13]. Были найдены условия регио- и стереоселективного присоединения алкиловых эфиров пропиоловой кислоты к пиридин-2-тиолу: реакция протекает при охлаждении до –15 ÷ –18 °С в присутствии каталитических количеств основания (NaOH, 5 % мол) в метаноле с метилпропиолатом и в этаноле – с этилпропиолатом с последующим перемешиванием при комнатной температуре; при этом получаются (Z)-алкил-3-(2-пиридинилсульфанил)-2-пропеноаты с высокими выходами (97–98 %) (рис. 1).
В некаталитических условиях реакция протекает регио-, но не стереоселективно; соотношение (Z)- и (Е)-изомеров в этом случае зависит от условий реакции.
Актуальной задачей представляется расширение спектра ранее неизвестных винилсульфидов, имеющих в своем составе хинолиновое кольцо и являющихся вследствие этого соединениями с потенциальной биологической активностью. Такие соединения очень перспективны для фармакологии, так как использование хинолинового каркаса дает возможность для разработки многих новых лекарственных препаратов.
Известно, что тройная связь очень чувствительна к нуклеофильной атаке. Активация тройной связи при нуклеофильной атаке заметно возрастает при введении в молекулу ацетилена электроноакцепторных заместителей при этой связи. Винилсульфиды, не описанные ранее в литературе, были синтезированы нами путем нуклеофильного присоединения 2-меркаптохинолина к ацетиленам с активированной тройной связью. В качестве активированных ацетиленов были использованы алкиловые эфиры пропиоловой кислоты и фенилэтинилкетон.
Реакцию с алкилпропиолатами проводили в некаталитических условиях при комнатной температуре в метаноле. Установлено, что взаимодействие 2-меркаптохинолина с алкилпропиолатами в данных условиях протекает как региоселективно, так и стереоселективно и приводит преимущественно к (Z)-алкил-3-(хинолин-2-илсульфанил)пропеноатам (1, 2) и небольшим количествам (Е)-алкил-3-(хинолин-2-илсульфанил)пропеноатов (3, 4) (рис. 2). Примесь (Е)-изомеров не превышает 10 %. Винилсульфиды 1–4 ранее в литературе описаны не были.
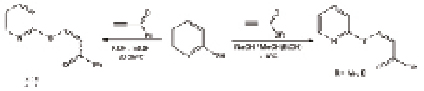
Рис. 1. Схема синтеза алкил-3-(2-пиридинилсульфанил)-2-пропеноатов
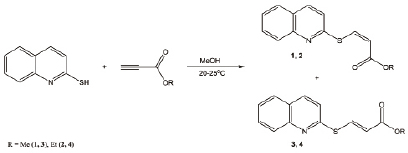
Рис. 2. Взаимодействие 2-меркаптохинолина с алкилпропиолатами
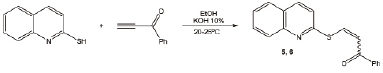
Рис. 3. Взаимодействие 2-меркаптохинолина с фенилэтинилкетоном
Выход и физико-химические свойства соединений 1–6
|
Соединение |
Брутто-формула |
(Z)/(E)-соотношение |
Выход, % |
Т. пл, °С |
|
1, 3 |
С13H11NO2S |
10 : 0,5 |
99 |
82–84 |
|
2, 4 |
С14H13NO2S |
10 : 1 |
94 |
76–78 |
|
5, 6 |
С18H13NOS |
4 : 1 |
68 |
– |
Выходы продуктов реакции достигают 95 %. Увеличение длины алкильной составляющей на одну СН2-группу приводит к увеличению доли (Е)-изомера в два раза: соотношение (Z):(E) для соединений 1, 2 составляет = 10:0,5, а для соединений 2, 4 – 10:1.
Взаимодействие 2-меркаптохинолина с фенилэтинилкетоном в этаноле при комнатной температуре в присутствии КОН (10 % мол.) приводит к ранее неизвестным винилсульфидам 5, 6 с выходом 68 % (рис. 3). При этом в смеси возрастает количество (Е)-изомера: соотношение (Z) / (E) становится равным 4 : 1.
Выход и физико-химические свойства соединений 1–6 представлены в таблице.
Строение синтезированных соединений доказано методом ЯМР 1Н и 13С и подтверждено данными элементного анализа.
Заключение
Таким образом, осуществлены и изучены реакции нуклеофильного присоединения 2-меркаптохинолина к активированным ацетиленам: метил- и этилпропиолату и фенилэтинилкетону. На основании этого разработаны эффективные способы получения ранее неизвестных винилсульфидов: (Z)- и (Е)-метил-3-(хинолин-2-илсульфанил)пропеноата, (Z)- и (Е)-этил-3-(хинолин-2-илсульфанил)пропеноата, (Z)- и (Е)-1-фенил-3-(хинолин-2-ил-тио)проп-2-ен-1-она – новых перспективных полупродуктов с потенциальной биологической активностью, которые могут найти свое применение в органическом синтезе или в фармацевтике. Хинолиновое кольцо, входящее в состав этих новых функционализированных винилсульфидов, представляет собой фармакофорную группу, что делает полученные соединения особо ценными полупродуктами и синтонами. Данные гетероциклы очень перспективны для фармакологии, так как использование хинолинового каркаса открывает широкие возможности для разработки многих новых фармацевтических препаратов. Присутствие винилсульфанильной, сложноэфирной групп, нуклеофильного атома азота повышает реакционную способность синтезированных соединений и открывает большие возможности для функционализации и получения новых производных.
Спектральные исследования проведены с использованием материально-технической базы Байкальского аналитического центра коллективного пользования СО РАН.

