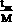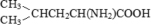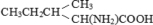Генетический код определяет соответствие последовательности в молекулах РНК и ДНК с последовательностью аминокислот в молекулах белка [1]. «Каноническую» версию генетического кода обычно представляют в виде таблицы из 64 триплетов для 20 протеиногенных аминокислот и трех стоп-кодонов остановки трансляции, допуская ее «универсальность» почти для всех живущих прокариот и эукариот.
Впоследствии, однако, было установлено, что иногда через стоп-кодоны могут синтезироваться дополнительные неканонические аминокислоты: селеноцистеин (SeC) из серина через UGA [2] и пирролизин (Pyl) из лизина и орнитина через UAG [3]. Обнаруженная способность ряда кодонов выполнять двойственную функцию позволила предположить существование альтернативных версий генетического кода, в частности, в митохондриях, хлоропластах и бактериальных симбионтах [4].
При изучении проблемы происхождения генетического кода был выдвинут ряд взаимодополняющих гипотез от «замерзшей случайности» до теории коэволюции кодонов и путей синтеза аминокислот при создании триплетного кода по мере появления новых аминокислот в примордиальных биохимических системах [5–7]. Причем первое основание кодона они неизменно связывали с синтетическими путями аминокислот при поэтапной самоорганизации генетического кода. Затем при обсуждении селекции биологически кодируемых аминокислот отмечена важность особенностей пребиотического синтеза, энергетических биосинтетических издержек при анаэробиозе, заряда, полярности, растворимости в воде, формы функциональных групп, хиральности, связи со стабильностью протеиновых структур и РНК-миром [8, 9]. Аминоацилирование тРНК и гомохиральность «одноруких» сахаров и аминокислот, вероятно, произошли при переходе от химической эволюции к рибозимам и РНК-миру [10, 11]. Несмотря на большое число работ по проблеме происхождения генетического кода, можно констатировать, что практически не изучены физико-химические закономерности отбора протобиомономеров из множества первозданных органических соединений с разнообразными структурами и свойствами.
Цель работы: определение детерминирующих факторов отбора компонентов нуклеиновых кислот, протеиногенных аминокислот и их предшественников при поэтапном формировании генетического кода от абиогенеза до начальных биогенных стадий.
Абиогенный синтез протобиомолекул
В примитивной атмосфере на первобытной Земле, возможно, содержались малые молекулы, преимущественно стабильные CO2, N2 и H2O, а также CH4 и NH3, состоящие из атомов водорода, углерода, кислорода и азота. В зависимости от видов потоков энергии (электрические разряды, ультрафиолетовое излучение, бета-частицы или теплота), проходящих через одну из таких газообразных смесей, в условиях лабораторных экспериментов удалось получить альдегиды, сахара, карбоновые кислоты, аминокислоты, пуриновые и пиримидиновые азотистые основания [12]. В хронологии появления аминокислот в генетическом коде установлено совпадение десяти первых протеиногенных аминокислот с набором выявленных аминокислот в метеоритах и синтезированных в имитирующих экcпериментах Миллера [12, 13]. Все эти мономеры – основные строительные блоки живых систем и бесчисленное множество иных соединений могли образоваться из малых молекул в качестве вероятных продуктов «химического реактора» при абиогенных геофизических процессах на древней Земле и других планетах [14].
В 2000 г. вне Срединно-Атлантического хребта было обнаружено обширное гидротермальное поле, названное «Lost City» (Потерянный город) [15]. В отличие от вулканогенных «черных курильщиков», эти гидротермальные флюиды менее горячие (150–200 °C), сильнощелочные (рН 9–10) и богаты водородом. Их подводные постройки формируются в процессе серпентинизации при взаимодействии морской воды с железо-магниевыми силикатными минералами типа оливина. При гидроксилировании оливина высвобождаются серпентин, магнетит и H2. Именно в подобных щелочных гидротермальных вентах с температурой до 200 °С могла зарождаться жизнь.
В древних гидротермальных системах с CO, CO2, N2, H2 и H2O могли синтезироваться обычные пребиотические молекулы формальдегида (HCHO) и циановодорода (HCN), затем молекулы моносахаров из HCHO, пуринов из HCN, а из смесей HCN и HCHO – цитозин, урацил и тимин [16]. В условиях щелочных гидротерм типа «Lost City» из неорганических прекурсоров (CO2, H2, NH3 и H2S), предполагается, осуществлялся и абиогенный синтез аминокислот [17]. Показана возможность пребиотического синтеза Pro и Arg в сети цианосульфидных реакций, катализируемых Cu (I) [18].
Возможности биогенных элементов определять структуру и физико-химические свойства протобиомономеров
Около 99 % массы всего живого построено в основном из четырех легких атомов (H, C, O, N), способных образовывать прочные ковалентные связи и активно реагировать друг с другом [19]. Структуры с гидрофобными атомами и радикалами (S, S-S, Fe-S, Se, I, CH3) более упорядочены и стабильны, но менее растворимы в воде.
Разнообразие органических веществ резко возрастает, если в молекулы кроме углерода и водорода дополнительно входят атомы кислорода: углеводы, карбоновые кислоты, спирты, альдегиды, кетоны, эфиры, жиры и соединения со смешанными функциями (таблица). Монокарбоновая пировиноградная кислота имеет низкую tпл и низкое отношение tпл, °С : M, но неограниченную растворимость в воде. При переходе к дикарбоновым кислотам резко повышаются tпл и отношение tпл: М, но утрачивается неограниченная растворимость в воде. Следует отметить, что могут существенно различаться физико-химические свойства (tпл и растворимость в H2O) у пространственных изомеров органических кислот, углеводов, аминокислот и азотистых оснований. Например, у цис-транс-изомеров дикарбоновых малеиновой и фумаровой кислот повышение tпл в 2,2 раза у фумарового транс-изомера сопровождается падением растворимости в воде в сто с лишним раз. Существенно могут различаться tпл и растворимость в воде у структурных изомеров α, β, γ-аминоксилот в зависимости от взаимного расположения амино- и гидроксильных групп. Напротив, у структурных изомеров α-аминокислот, различающихся порядком расположения углеводородных радикалов –СH2 и –СH3, отличия растворимости в воде и tпл выражены значительно слабее. В свете этих данных представляется вполне оправданным предположение, что норлейцин и норвалин могли быть довольно обычными компонентами протеинов на ранних стадиях клеточной эволюции [20].
Полимерные цепи нуклеиновых кислот построены из четырех гетероциклических азотистых оснований A, C, G, U или T [1]. Четыре основания C, G, U, T состоят из четырех атомов H, C, N и O, но атом кислорода отсутствует в бициклическом аденине C5H5N5. Они характеризуются термостабильностью, близкими значениями отношения tпл к М, низкой растворимостью в воде. Гидрофобность азотистых оснований тесно связана с явлением резонанса, когда каждая молекула плоского гетероцикла описывается наложением (гибридизацией) сразу нескольких валентных структур. Наибольшей энергией резонанса среди оснований обладает сравнительно устойчивая молекула аденина. Столь высокой стабильности, как у аденина, нет у его структурного изомера 2-аминопурина, обладающего способностью к интенсивной флуоресценции. Эволюционный отбор на фотостабильность, обусловленную коротким временем жизни их электронного возбуждения светом, вероятно, прошли при абиогенезе и другие природные азотистые основания нуклеиновых кислот [21].
Физико-химические свойства главных и минорных протобиомономеров
|
Соединение и формула |
М |
tпл, °С |
|
Растворимость в H2O (25 °C) |
|
Пировиноградная кислота C3H4O3 |
88,1 |
13,6 |
0,15 |
∞ |
|
Малеиновая кислота C4H4O4 |
116,1 |
140 |
1,20 |
79 |
|
Фумаровая кислота C4H4O4 |
116,1 |
302 |
2,60 |
0,7 |
|
β-D-Фруктоза C6H12O6 |
180,2 |
105 |
0,58 |
375 |
|
β-D-Галактоза C6H12O6 |
180,2 |
167 |
0,93 |
68 |
|
β-Аланин H2N(CH2)2COOH |
89,1 |
207 |
2,32 |
54,5 |
|
α-Аланин CH3CH(NH2)COOH |
89,1 |
316 |
3,55 |
16,7 |
|
L-Норлейцин CH3(CH2)3CH(NH2)COOH |
131,2 |
301 |
2,29 |
1,5 |
|
L-Лейцин |
131,2 |
295 |
2,25 |
2,4 |
|
L-Изолейцин |
131,2 |
285 |
2,17 |
4,1 |
|
Цитозин C4H5N3O |
111,1 |
224 |
2,02 |
0,77 |
|
Урацил C4H4N2O2 |
112,1 |
283 |
2,52 |
0,36 |
|
5-Метилцитозин C5H7N3O |
125,1 |
221 |
1,77 |
0,45 |
|
Тимин (метилурацил) C5H6N2O2 |
126,1 |
282 |
2,24 |
0,40 |
|
2-Аминопурин C5H5N5 |
135,1 |
282 |
2,09 |
0,12 |
|
Аденин C5H5N5 |
135,1 |
305 |
2,28 |
0,09 |
|
N6-Метиладенин C6H7N5 |
149,2 |
300 |
2,02 |
1,18 |
|
Гипоксантин C5H4N4O |
136,1 |
310 |
2,28 |
0,09 |
|
Гуанин C5H5N5O |
151,1 |
346 |
2,29 |
0,004 |
|
7-Метилгуанин C6H7N5O |
165,2 |
370 |
2,24 |
≤ 0,004 |
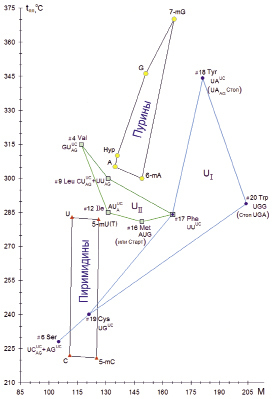
Рис. 1. Диаграмма, отражающая соотношение М и tпл у пуриновых и пиримидиновых оснований, протеиногенных аминокислот, кодируемых кодонами, содержащими урацил в первой (UI) или второй (UII) позициях.
Сокращенное обозначение оснований в кодонах: Y – пиримидины, R – пурины, N – любые, NNY = NNUC; NNR = NNAG ;  =
=  .
.
# – номер появления аминокислот в формируемом коде
Попытки модифицировать главные и минорные основания, например, путем замещения в гетероцикле одного из атомов углерода на атомы азота или дополнительное введение в боковые группы атомов фтора или серы сопровождаются резкими негативными изменениями tпл и особенно растворимостью в воде (таблица).
Влияние молекулярной массы и температуры плавления на взаимосвязи протеиногенных аминокислот и кодонов
Молекулярная масса протеиногенных аминокислот изменяется в более широком интервале (от 75,1 до 204,2), чем у главных азотистых оснований (от 111,1 до 151,1). Однако температуры плавления, при которых их кристаллы и жидкости находятся в равновесии, одинаково высоки и имеют близкие диапазоны изменчивости: у аминокислот от 186 до 344 °С, у оснований от 222 до 346 °С. На диаграмме в координатах M и tпл главные и минорные азотистые основания группируются в два четко обособленных семейства: пуриновые и пиримидиновые (рис. 1). Впервые установлено, что в системе прямоугольных координат tпл и M (рис. 1, 2), при постоянных значениях остальных параметров, канонические аминокислоты вместе с кодирующими их кодонами располагаются довольно закономерно относительно обособленных семейств пуриновых и пиримидиновых оснований. При незначительном повышении M у главных С4-пиримидиновых и С5-пуриновых оснований наблюдается существенный рост их tпл. Однако увеличение M за счет метилирования главных оснований, которые являются важными минорными основаниями, обычно не сопровождается повышением tпл. Причем на диаграммах в координатах M и tпл канонические аминокислоты вместе с кодирующими их кодонами располагаются довольно согласованно относительно семейств пуриновых и пиримидиновых оснований.
Пять аминокислот, кодируемых кодонами с урацилом во второй позиции (UII), располагаются в узком диапазоне M и tпл (между M и tпл семейств пуриновых и пиримидиновых оснований) (рис. 1). Здесь кодоны с UII различаются по степени вырожденности: 1-2-3-4-6. При этом каждая аминокислота кодируется разным количеством триплетов в зависимости от хронологии появления в генетическом коде: #4-9-12-16-17 [13]. Причем однократный кодон AUG может кодировать серусодержащий метионин, но он же является стартовым кодоном, после которого начинается синтез полипептида на рибосоме.
Двукратно вырожденные кодоны с урацилом в первой позиции и пиримидинами UC в третьей позиции (UNUC) кодируют четыре аминокислоты, у которых при сравнительно небольшом повышении M наблюдается резкое повышение tпл (от низших значений у семейств пиримидинов до максимальных у семейств пуринов). В пределе после двукратного кодона UAUC для наиболее термостойкого Tyr следует двукратный стоп-кодон UAAG с пуринами в третьей позиции. Также после однократного кодона UGG с урацилом в первой позиции и с гуанином в третьей позиции для наиболее массивного Trp следует однократный стоп-кодон UGA. В итоге стоп-кодоны, прерывающие биосинтез белка при трансляции на рибосоме в первой позиции, содержат пиримидин урацил, а в третьей позиции лишь бициклические пуриновые основания (UAAG и UGA). Кроме того, урацил в первой и второй позициях послужил для разграничения стоп-кодонов (UI) и старт-кодонов (UII).
На следующей диаграмме (рис. 2) в системе прямоугольных координат tпл и M представлены канонические аминокислоты, кодируемые триплетами оснований с гуанином в первой позиции (GI) и аденином во второй позиции (AII). Там группа кодонов с GI кодирует пять наиболее древних C2–C5 аминокислот (#1–5). Первые три наиболее термостойкие неполярные углеводородные аминокислоты (#1Gly, # 2Ala, #4 Val с tпл, °С:M 3,89–3,59–2,69) кодируются синонимическими квартетами кодонов. Менее термостойкие дикарбоновые полярные аминокислоты (#3 Asp и #5 Glu с tпл, °С:M 2.04 и 1.69) кодируются двукратно вырожденными кодонами (GAUC и GAAG).
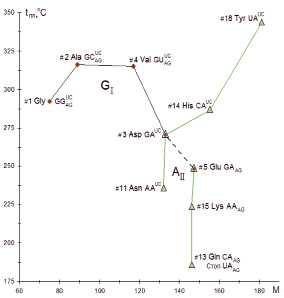
Рис. 2. Влияние M и tпл на последовательность расположения протеиногенных аминокислот и соответствующих им кодонов, содержащих гуанин в первой (GI) или аденин во второй (AII) позициях
Семь аминокислот, кодируемых двукратными триплетами с AII, характеризуются наиболее широким диапазоном tпл от 186 °С у #13 Gln до 344 °С у #18 Tyr с tпл, °С:M от 1,27 до 1,90. Эти аминокислоты в зависимости от содержания в третьей позиции кодонов пиримидинов (NAUC) или пуринов (NAAG) принадлежат двум разным ветвям. Одна ветвь из сравнительно более термостойких аминокислот с tпл 236–344 °С кодируется дублетами кодонов с пиримидинами в третьей позиции NAUC, где N – A, G, C, U отражает закономерную последовательность оснований в первой позиции. Вторая ветвь для двух стоп-кодонов остановки трансляции на рибосоме и трех менее термостойких аминокислот с разной tпл 249–186 °С, но с одинаковой M 146.2–147.1, кодируются кодонами с пуринами в третьей позиции NAAG, где N – G, A, C, U последовательность оснований в первой позиции, завершаемая стоп-кодонами UAAG. Итак, есть основание полагать, что двукратно и однократно вырожденные кодоны с UI фактически завершали формирование генетического кода на ранних стадиях протоклеточной эволюции, включая кодирование #17-22 аминокислот и терминирующих кодонов с пуринами в третьей позиции (UNAG и UGA).
Связь кодонов с путями синтеза аминокислот
В свете теории коэволюции кодонов и путей синтеза протеиногенных аминокислот [5–7] модифицирована схема, отображающая связи последовательных метаболических превращений простых питательных веществ и аминокислот с кодирующими их кодонами. Отмечено два блока синтеза аминокислот. Первый блок связан с фосфорилированием и путями распада глюкозы, которые ведут к C3–соединениям, преимущественно пировиноградной кислоте. Второй блок синтеза аминокислот связан с циклом трикарбоновых кислот с ветвями от щавелевоуксусной и α-кетоглутаровой кислот.
Исключительно важен тот факт, что первое основание кодона неизменно связано с путями синтеза аминокислот и с хронологией их появления в коде. Наиболее древние пять аминокислот кодируются кодонами с гуанином в первом положении (GI). На очередном эволюционном этапе ряд аминокислот образуется в результате превращения других аминокислот, кодируемых кодонами с цитозином в первой позиции. Процесс синтеза аминокислот в первом блоке завершается кодированием кодонами с урацилом в первой позиции (UI), а во втором блоке – с аденином (AI). Учитывая закономерные последовательности синтеза аминокислот в схеме, по-видимому, следует внести коррективы в хронологию их появления в коде по Трифонову [13]. Будет правильнее переставить номера у пар #7 Glu /#5 Pro и #19 Met /#16 Cys на #5 Glu /#7 Pro и #16 Met /#19 Cys.
Отмечено существенное повышение tпл при прямом аминировании кетокислот при замене атома кислорода на NH3. При этом M синтезируемых углеводородных аминокислот увеличивается лишь на 1. Так, превращение пирувата в Ala сопровождается скачкообразным увеличением tпл с 14 до 316 °С, «кетовалина» в Val – с 32 до 315 °С, «кетолейцина» в Leu – с 10 до 295 °С. Для синтеза #2 Ala, #4 Val и #9 Leu характерны низкие энергетические затраты (1–2 АТФ) [9]. Тогда как для биосинтеза #12 Ile (изомера Leu) требуется 11 АТФ, для # 16 Met – 23 АТФ. Они принадлежат разным ветвям биосинтеза и, естественно, отличаются составом кодонов с урацилом или аденином в первой позиции (UI и AI).
Заключение
В проблеме возникновения генетического кода слабо изучены факторы дифференцированного отбора протобиомономеров при абиогенных и начальных биогенных стадиях. Первичный отбор минимального числа биомономеров мог происходить в зависимости от их молекулярной массы, температуры плавления, растворимости в воде, структуры и элементного состава. Отмечено, что очень существенно могут различаться физико-химические свойства изомеров органических кислот, углеводов и азотистых оснований (особенно tпл и растворимость в воде). Эволюционный отбор термостойких протобиомономеров в протоклетках мог происходить путем поэтапного замещения атомов кислорода атомами азота, в частности, от важнейших промежуточных продуктов обмена веществ к аминокислотам.
Впервые показано, что на диаграммах в системе прямоугольных координат tпл и M протеиногенные аминокислоты вместе с кодирующими их кодонами располагаются согласованно с четко обособленными семействами пуриновых и пиримидиновых оснований. Двукратно и однократно вырожденные кодоны, содержащие урацил в первой позиции (UI), фактически завершали формирование генетического кода на ранних стадиях протоклеточной эволюции, включая кодирование #17-22 аминокислот и терминирующих кодонов с пуринами в третьей позиции.
Подтверждена коэволюционная связь кодонов разной степени вырожденности с путями синтеза аминокислот и с хронологией их появления в формируемом генетическом коде. Часть однократно вырожденных триплетов, содержащих урацил в первой (UI) или второй (UII) позициях и лишь один из пуринов в третьей позиции, фактически завершали формирование генетического кода, включая кодирование #16 Met (AUG), #20 Trp (UGG), #21 SeC (UGA) и #22 Pyl (UAG), ряда стоп- (UAAG, UGA) и старт-кодонов (обычно AUG, реже GUG или UUG). Тем самым из состава однократных триплетов был полностью исключен сравнительно легкоплавкий и наиболее растворимый в воде моноциклический цитозин.
Комплекс физико-химических процессов позволил отобрать из хаотического многообразия органических соединений «первичного бульона» минимальное количество протобиомономеров с определенными значениями M и tпл и отношением tпл:M (5 главных азотистых оснований, 20 протеиногенных аминокислот, несколько моносахаридов и жирных кислот). В данной работе впервые указано на tпл в числе детерминирующих факторов отбора специфических протобиомономеров при возникновении и поэтапной самоорганизации генетического кода.
Работа выполнена в рамках государственного задания номер госрегистрации темы: 01201353247.