Винилсульфиды – ценные мономеры и полупродукты для органического синтеза [1, 2]. Способность винилсульфидов к реакциям гетероциклизации, диенового синтеза, гидроксилирования позволяет получать различные функциональные циклические и линейные соединения. Винилсульфиды вступают в реакции электрофильного и радикального присоединения к двойной связи, радикальной и электрофильной полимеризации и сополимеризации, что позволяет использовать их для получения растворимых и нерастворимых полимеров с самыми разнообразными свойствами [3–5]. Такие полимеры используются в качестве сорбентов золота, серебра и платины, для очистки сточных вод химических и химико-металлургических предприятий от ионов ртути, в качестве пленок, покрытий, изоляционных и термостойких высокопрочных материалов [6, 7].
Сообщается об антимикробном, в частности бактерицидном, действии производных винилсульфидов. Известно, что дивинилсульфид и его низшие линейные олигомеры, имеющие в своем составе поливиниленсульфидные блоки, с аллил- и метилсульфоксидными остатками в качестве концевых групп, обладают сильным бактерицидным действием [3, с. 169].
Хинолин привлекает пристальное внимание ученых в области химии и биологии. Хинолин – конденсированный гетероцикл с широким спектром биологической активности. Хинолиновое ядро, являясь ключевым строительным элементом многих природных соединений, играет важную роль при разработке многих синтетических соединений с различными фармакологическими свойствами. Введение хинолинового ядра в органические субстраты определяет их биологическую активность, что делает хинолин очень перспективным соединением для разработки новых лекарственных препаратов. Соединения, полученные на основе хинолина, обладают антибактериальным, противомалярийным, противовоспалительным, анальгетическим, противоопухолевым, гипотензивным и антигельминтным действиями [8–10].
Ниже представлены некоторые производные хинолина, которые активно используются в клинической практике: хинин (жаропонижающее, противомалярийное, обезболивающее, противовоспалительное действие), хлорохин (противомалярийное), амидиахин (противомалярийное и противовоспалительное), саквинавир (антиретровирусное), мефлохин (противотуберкулезное), ворелоксин (противораковое) (Схема 1) [11, 12]:
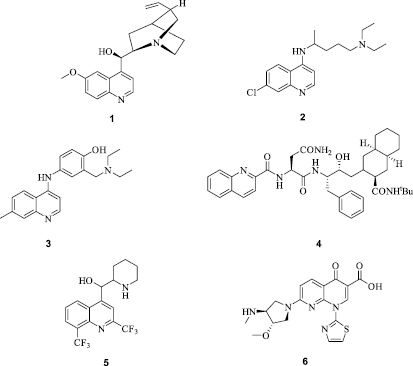
Схема 1. Фармакологические препараты – производные хинолина и его аналогов: хинин (1), хлорохин (2), амидиахин (3), саквинавир (4), мефлохин (5), ворелоксин (6)
В связи с этим производные винилсульфидов, содержащих хинолиновый цикл и сложноэфирные группы с потенциальной биологической активностью, представляют большой интерес.
Такой широкий спектр биологической активности хинолина, в совокупности с его синтетической универсальностью, делает это соединение весьма перспективным для разработки новых фармацевтических препаратов.
Таким образом, синтез новых ранее неизвестных соединений, имеющих в своем составе винилсульфидную группу и фармакофорный хинолиновый цикл, представляется очень актуальной и важной задачей.
Цель исследования: разработка удобных способов получения новых функционализированных винилсульфидов, содержащих сложноэфирные функции и хинолиновый фрагмент, на основе реакции нуклеофильного присоединения 2-меркаптохинолина к диметиловому и диэтиловому эфирам ацетилендикарбоновой кислоты.
Материалы и методы исследования
Диметиловый и диэтиловый эфиры ацетилендикарбоновой кислоты, 2-меркаптохинолин – импортные реактивы (Alfa Aesar).
Спектры ЯМР сняты в дейтерохлороформе на спектрометре Bruker DPX-400 на рабочих частотах 400.1 (спектры 1Н) и 100.6 (спектры 13С). Гексаметилдисилоксан применен как внутренний стандарт. CHNS-анализатор Thermo Scientific Flash 2000 использован для элементного анализа. Температуры плавления определены на приборе Boёtius (PHMK 05 VEB Wagetechnik Rapido).
Диметиловый эфир 2-(хинолин-2-илсульфанил)-2-бутендиовой кислоты (13, 15). Охлажденный на ледяной бане раствор 2-меркаптохинолина (0,161 г, 1 ммоль) в CH2Cl2 (5 мл) добавили по каплям к охлажденному на ледяной бане раствору диметилового эфира ацетилендикарбоновой кислоты (0,11 г, 1 ммоль) в CH2Cl2 (10 мл). Смесь перемешивали 2 ч при 0 °С и 24 ч при комнатной температуре. На роторном испарителе отогнали хлористый метилен, затем сушили продукт в вакууме. Получили диметиловый эфир 2-(2-хинолинилсульфанил)-2-бутендиовой кислоты (13, 15) с количественным выходом в виде порошка светло-желтого цвета. T. пл. 89–91 °С. Соотношение 13 : 15 составляет 5 : 3. Найдено, %: С 59.65; Н 4.49; N 4.81; S 10.89. С15Н13NO4S. Вычислено, %: С 59.39; Н 4.32; N 4.62; S 10.57.
Z-изомер (13). Спектр ЯМР 1Н (DMSO-d6, d, м.д.): 3.76 (с, ОCH3), 3.81 (с, ОCH3), 6.89 (с, =CH), 7.55-7.63 (м, 2Н, C9H8N), 7.76–7.86 (м, 2Н, C9H8N), 7.94–8.01 (м, 1Н, C9H8N), 8.37–8.42 (м, 1Н, C9H8N). Спектр ЯМР 13С (DMSO-d6, d, м.д.): 51.4 (CH3), 51.9 (CH3), 121.1 (C9H8N), 126.3 (C9H8N), 126.7 (C9H8N), 127.3 (C9H8N), 127.9 (=CH), 128.4 (C9H8N), 131.0 (C9H8N), 137.5 (SCH=), 142.3 (C9H8N), 147.7 (C9H8N), 156.6 (=C-S), 164.7 (С=O), 164.8 (С=O).
Е-изомер (15). Спектр ЯМР 1Н (DMSO-d6, d, м.д.): 3.69 (с, ОCH3), 3.83 (кв, ОCH3), 6.89 (с, =CH), 7.59–7.65 (м, 2Н, C9H8N), 7.77–7.87 (м, 2Н, C9H8N), 7.91-8.01 (м, 1Н, C9H8N), 8.43-8.49 (м, 1Н, C9H8N). Спектр ЯМР 13С (DMSO-d6, d, м.д.): 51.6 (CH3), 51.8 (CH3), 121.0 (C9H8N), 126.5 (C9H8N), 126.3 (C9H8N), 127.5 (C9H8N), 128.0 (=CH), 128.5 (C9H8N), 130.9 (C9H8N), 137.7 (SCH=), 142.1 (C9H8N), 147.9 (C9H8N), 156.8 (=C-S), 164.5 (С=O), 165.0 (С=O).
Диэтиловый эфир 2-(2-хинолинил- сульфанил)-2-бутендиовой кислоты (14, 16). Охлажденный на ледяной бане раствор 2-меркаптохинолина (0.161 г, 1 ммоль) в CH2Cl2 (5 мл) добавили по каплям к охлажденному на ледяной бане раствору диэтилового эфира ацетилендикарбоновой кислоты (0,17 г, 1 ммоль) в CH2Cl2 (10 мл). Смесь перемешивали 2 ч при 0 °С и 24 ч при комнатной температуре. На роторном испарителе отогнали хлористый метилен, затем сушили продукт в вакууме. Получили 0,331 г диэтилового эфира 2-(2-хинолинилсульфанил)-2-бутендиовой кислоты (14, 16) в виде порошка светло-желтого цвета с количественным выходом. T. пл. 79–81 °С. Соотношение 14 : 16 составляет 2 : 1. Найдено, %: С 61.34; Н 4.98; N 4.48; S 9.42. С17Н17NO4S. Вычислено, %: С 61.61; Н 5.17; N 4.23; S 9.68.
(Z)-изомер (14). Спектр ЯМР 1Н (400.13 МГц, DMSO-d6,), δ, м. д. (J, Гц): 0.90 (т, CH3), 1.28 (т, CH3), 4.01 (кв, ОCH2), 4.26 (кв, ОCH2), 6.93 (с, =CH), 7.58–7.66 (м, 2Н, C9H8N), 7.78–7.88 (м, 2Н, C9H8N), 7.98-7.04 (м, 1Н, C9H8N), 8.33–8.38 (м, 1Н, C9H8N). Спектр ЯМР 13С (100.61 МГц, DMSO-d6,), δ, м. д. (J, Гц): 13.9 (CH3), 14.2 (CH3), 61.3 (CH2), 62.2 (CH2), 121.3 (C9H8N), 126.5 (C9H8N), 126.8 (C9H8N), 127.2 (C9H8N), 127.6 (=CH), 128.5 (C9H8N), 130.9 (C9H8N), 137.6 (SCH=), 142.2 (C9H8N), 147.7 (C9H8N), 156.5 (=C-S), 164.5 (С=O), 164.7 (С=O).
(Е)-изомер (16). Спектр ЯМР 1Н (400.13 МГц, DMSO-d6,), δ, м. д. (J, Гц): 1.13 (т, CH3), 1.25 (т, CH3), 4.13 (кв, ОCH2), 4.22 (кв, ОCH2), 6.86 (с, =CH), 7.60–7.67 (м, 2Н, C9H8N), 7.80-7.89 (м, 2Н, C9H8N), 7.97-7.03 (м, 1Н, C9H8N), 8.34–8.39 (м, 1Н, C9H8N). Спектр ЯМР 13С (100.61 МГц, DMSO-d6,), δ, м. д. (J, Гц): 14.1 (CH3), 14.4 (CH3), 61.5 (CH2), 62.3 (CH2), 121.4 (C9H8N), 126.6 (C9H8N), 126.9 (C9H8N), 127.1 (C9H8N), 127.8 (=CH), 128.4 (C9H8N), 131.0 (C9H8N), 137.9 (SCH=), 142.4 (C9H8N), 147.6 (C9H8N), 156.6 (=C-S), 164.6 (С=O), 164.9 (С=O).
Результаты исследования и их обсуждение
Ранее нами осуществлена разработка селективного способа получения функциональных винилсульфидов на основе реакции 2-меркаптохинолина с алкилпропиолатами [13]. Были найдены условия регио- и стереоселективного присоединения 2-меркаптохинолина к алкиловым эфирам пропиоловой кислоты. Реакция протекает при комнатной температуре в метаноле. При этом образуются преимущественно (Z)- и (Е)-изомеры метил-3-(хинолин-2-илсульфанил)акрилата (7, 8) и этил-3-(хинолин-2-илсульфанил)акрилата (9, 10) (Схема 2).
В продолжение этих исследований с целью расширения спектра ранее неизвестных функциональных винилсульфидов, имеющих в своем составе хинолиновое кольцо и сложноэфирные фрагменты, нами были изучены реакции 2-меркаптохинолина с диалкиловыми эфирами ацетилендикарбоновой кислоты.
Нуклеофильное присоединение 2-меркаптохинолина к диалкиловым эфирам ацетилендикарбоновой кислоты проводили при охлаждении до 0 °С с последующим перемешиванием при комнатной температуре в хлористом метилене или ацетонитриле. Установлено, что взаимодействие 2-меркаптохинолина с диалкиловыми эфирами ацетилендикарбоновой кислоты в данных условиях протекает стереоселективно, и приводит к (Z)- и (Е)-изомерам диалкиловых эфиров 2-(хинолин-2-илсульфанил)бутендиовой кислоты (13-16) (рис. 2). Винилсульфиды 13-16 ранее в литературе описаны не были.
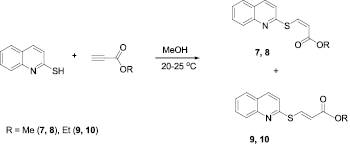
Схема. 2. Взаимодействие 2-меркаптохинолина с алкилпропиолатами
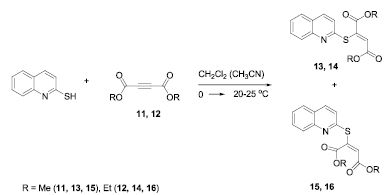
Схема. 3. Синтез диалкиловых эфиров 2-(хинолин-2-илсульфанил)бутендиовой кислоты
Установлено, что взаимодействие 2-меркаптохинолина с диметиловым эфиром ацетилендикарбоновой кислоты (11) в хлористом метилене приводит к образованию двух стереоизомеров (Z)- и (Е)-строения диметилового эфира 2-(хинолин-2-илсульфанил)-2-бутендиовой кислоты 13 и 15 в соотношении 5 : 3. При проведении аналогичной реакции в ацетонитриле доля (Е)-изомера снижается до соотношения 5 : 2. Аналогичная картина наблюдается в случае реакции с соединением (12): соотношение двух стереоизомеров (Z)- и (Е)-строения диэтилового эфира 2-(хинолин-2-илсульфанил)-2-бутендиовой кислоты 14 и 16 в хлористом метилене составляет 10 : 5, в ацетонитриле 10 : 4. Таким образом, увеличение полярности растворителя увеличивает долю (Z)-изомера.
Для доказательства строения синтезированных соединений использован метод спектроскопии ЯМР 1Н и 13С. Аналитические данные элементного анализа подтвердили состав синтезированных соединений. Спектральные и аналитические данные получены на материально-технической базе Байкальского аналитического центра коллективного пользования СО РАН.
Заключение
Таким образом, впервые реализованы реакции нуклеофильного присоединения 2-меркаптохинолина к диалкиловым эфирам ацетилендикарбоновой кислоты (11, 12). На базе полученных результатов разработаны эффективные способы получения новых функциональных винилсульфидов, содержащих хинолиновый цикл и сложноэфирные группы: (Z)- и (Е)-изомеров диалкиловых эфиров 2-(хинолин-2-илсульфанил)-2-бутендиовой кислоты, которые могут быть использованы для органического синтеза и получения новых биологически активных соединений.

