Сахарная свекла – одна из основных технических культур. В мировом земледелии она занимает значительную площадь – 7,913 млн га, в наибольшем количестве сахарная свекла производится в России, за ней следуют Франция и Соединенные Штаты [1]. В то же время урожайность сахарной свеклы в России и Казахстане по сравнению с другими странами низкая. Так, урожайность сахарной свеклы в США составляет 530–650 ц/га, во Франции – 840–910 ц/га, России – 450–470 ц/га, в Казахстане этот показатель составляет всего лишь 153–285 ц/га [2]. Выращивание сахарной свеклы наносит существенный урон почвам, так как с урожаем выносится большое количество питательных элементов, что вызывает сокращение почвенной микробной массы и ее биоразнообразия. Кроме того, многие свеклосеющие хозяйства не применяют ротацию культур и сеют сахарную свеклу на полях до 5–7 лет, что приводит к накоплению фитопатогенов, вызывающих болезни сахарной свеклы. Вследствие этого нередко в почвах хозяйств наблюдается массовое развитие гнилей корнеплодов сахарной свеклы, видовой состав которых представлен лишь 2–3 видами фитопатогенных грибов. Так, потери урожая сахарной свеклы от корневых гнилей в России доходят до 30 %, в Казахстане – до 40 % [3, 4]. Во многих странах мира корневые гнили также наносят существенной урон урожайности сахарной свеклы (до 30–35 %) [5].
Одним из путей решения этой проблемы является биологизация земледелия, достоинствами которой являются: экологичность; снижение затрат и повышение качества продукции. Существенным фактором восстановления плодородия почвы является применение агрономически ценных микроорганизмов. Именно эти микроорганизмы осуществляют в почве процесс гумификации растительных остатков и органических веществ почвы и занимают основное место в обогащении почв гумусом – главного фактора плодородия почвы. В состав ассоциаций, как правило, входят основные группы почвенных микроорганизмов: азотфиксирующие, целлюлолитические, фосфатмобилизующие и силикатные.
Почва является основным природным банком при поиске культур микроорганизмов с любыми необходимыми свойствами. По некоторым данным штаммы, выделенные из ризосферы, активно колонизируют корневую зону растений и синтезируют биологически активные вещества, способствующие их развитию [6, 7]. Также обнаружено, что микроорганизмы синтезируют метаболиты, способные подавлять рост и развитие патогенных для растений микроорганизмов [8].
Нахождение штаммов агрономически ценных микроорганизмов и создание на их основе ассоциаций для сельского хозяйства, положительно влияющих на развитие растений и подавляющих развитие фитопатогенов, вызывающих болезни растений, является весьма актуальной задачей.
Целью данного исследования было выделение и отбор новых высокоактивных штаммов азотфиксирующих, фосфатмобилизующих и целлюлолитических бактерий и создание на их основе ассоциации агрономически ценных микроорганизмов для биоконтроля корневых гнилей сахарной свеклы, стимуляции развития и повышения ее урожайности.
Новизна данного исследования заключается в том, что создана ассоциация агрономически ценных микроорганизмов, на основе новых аборигенных штаммов бактерий, адаптированных к природно-климатическим условиям Казахстана. Созданная ассоциация обладает комплексным действием: стимулирует рост и развитие растений сахарной свеклы и характеризуется высокой антифунгальной активностью по отношению к основным фитопатогенным грибам, вызывающим корневые гнили этой культуры.
Материалы и методы исследования
Объектами исследования служили штаммы азотфиксирующих, фосфатмобилизующих и целлюлолитических бактерий, выделенные из почв Жамбылской области Казахстана в весенний период 2018 г., и ассоциация, созданная на их основе. Сбор образцов почв проводили в соответствии с методикой ГОСТa [9]. Выделение бактерий согласно методике [10]. Целлюлолитические бактерии выделяли на среде Гетчинсона с 1 % Na-КМЦ (водорастворимая Na-карбоксиметилцеллюлоза), азотфиксирующие – на среде Эшби, фосфатмобилизующие микроорганизмы – на среде Муромцева.
Нитрогеназную активность бактерий определяли ацетиленовым методом [11]. Для этого бактерии выращивали на среде Эшби. Ацетилен вводили в сосуды с культурами до концентрации 10 % (по объему). После инкубации культур в течение 1,5 ч в атмосфере ацетилена пробы газа отбирали шприцем по 1 мл из сосуда и определяли наличие этилена на газовом хроматографе «Agilent Technology 7890 B» (США) с пламенно-ионизационным детектором.
Определение способности бактерий к мобилизации фосфатов проводили по модифицированной методике Сэги на среде Муромцева, содержащей нерастворимый трикальцийфосфат в виде мелкодисперсного осадка, придававшего питательной среде равномерную мутность [12]. Фосфатмобилизующую активность бактерий оценивали количественно по диаметру зон «гало» без вычета диаметра лунки и выражали в мм.
Целлюлазную активность (КМЦ-азаная) бактерий определяли по диаметру зон гидролиза твердой среды с 0,1 % Na-КМЦ после окрашивания раствором красителя конго-рот и соответственного пересчета, выражали в ед/мл [13].
Биомассу микроорганизмов определяли нефелометрически на спектрофотометре PD-303 («Apel», Japan) и пересчитывали по калибровочной кривой на вес абсолютно сухой биомассы (АСБ, г/л).
Для изучения ростостимулирующей способности ассоциаций бактерии выращивали на жидких элективных средах при 180 об/мин, 28оС в течение 5–7 суток до концентрации 1x107 кл/мл и смешивали в соотношении 1:1:1. В опытах использовали семена сахарной свеклы сорта «Айсултан». Семена перед посевом обрабатывали суспензией ассоциации в концентрации 1×107 кл/мл на 1 г семян в течение 2 ч при комнатной температуре. В контроле семена замачивали в водопроводной воде. Через 30 дней проводили измерение длины стебля и корней растений и сравнивали их с контрольным вариантом. Эксперименты проводились в климатической камере для выращивания растений («Memmert HPP-750», Германия). Опыты проводили в 3-кратной повторности (12 растений на повторность).
Антифунгальные свойства ассоциации определяли методом агаровых блоков [14]. В расплавленную и остуженную до 40 °С среду картофельно-декстрозный агар (КДА) вносили суспензию конидий грибов (108 КОЕ/мл) из расчета 1 мл на 100 мл среды и разливали в чашки Петри. Бактерии, входящие в состав ассоциации выращивали на жидких элективных средах до концентрации 107 кл/мл и смешивали в соотношении 1:1:1. Затем в среде КДА, предварительно засеянной культурами фитопатогенных грибов, буром (диаметр 7 мм) вырезали лунки, в которые вносили суспензию ассоциаций в количестве 0,5 мл (титр 107 кл/мл), и оставляли на 72 ч при температуре 28 °С. Контролем служили лунки со стерильной водой. Об антифунгальной активности судили по диаметру зоны подавления роста грибов.
Биосовместимость штаммов ассоциации изучали методом перпендикулярных штрихов [15].
Статистическая обработка результатов проводилась с использованием пакета программ «STATISTICA 10.0». В таблице и рисунке представлены средние значения (M) и их стандартные отклонения (±SD) при р < 0,5.
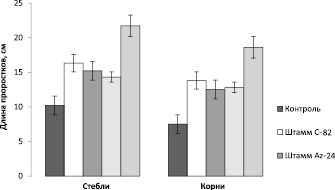
Ростостимуляция проростков сахарной свеклы при инокуляции семян отдельными штаммами и созданной ассоциацией
Результаты исследования и их обсуждение
Выделение бактерий проводили из образцов почв (более 70 образцов), собранных в Жамбылской области Казахстана. В общей сложности было выделено 54 азотфиксирующих, 25 фосфатмобилизующих и 106 культур целлюлолитических бактерий.
Азотфиксирующие бактерии были выделены на среде Эшби. С целью выявления активных штаммов был проведен первичный скрининг культур. Критерием отбора служила величина и размеры колоний при росте на безазотистой среде. При этом исходили из того, что бактерии, способные к активному росту и накоплению биомассы на безазотистых средах, образуют колонии большого диаметра, что свидетельствует об их повышенной способности к фиксации молекулярного азота атмосферы. В результате первичного скрининга для дальнейшей работы было отобрано 10 культур азотфиксирующих бактерий. Для отбора высокоактивных штаммов изучили их нитрогеназную активность и способность к накоплению биомассы. В результате проведенной работы было отобрано два штамма Az-22 и Az-24, характеризующихся повышенным накоплением биомассы и высокой нитрогеназной активностью.
Выделение и первичный скрининг активных штаммов фосфатмобилизующих бактерий проводили на среде Муромцева с нерастворимым фосфатом, придававшего питательной среде равномерную мутность. Отбор культур проводили исходя их того, что активные штаммы образуют большие зоны просветления среды (зоны гало). Исследование способности штаммов к мобилизации фосфатов позволило отобрать два наиболее активных штамма бактерий Ф-11 и Ф-12.
Выделение целлюлолитических бактерий из почвенных образцов проводили на среде Гетчинсона. Первичный отбор активных культур проводили на агаризованной среде Гетчинсона, содержащей в качестве единственного источника углерода и энергии пшеничную солому. Отбор культур проводили исходя из того, что чем больше диаметр колоний, тем эффективнее культура бактерий утилизирует целлюлозу. В результате первичного скрининга было отобрано 20 бактерий. Для отбора высокоактивных штаммов бактерий были проведены опыты по изучению их целлюлазной активности. В результате исследований было отобрано два штамма целлюлолитических бактерий С-21(8) и С-82 с высокой активностью целлюлаз.
Одним из основных факторов, которые необходимо учитывать при создании ассоциации, является биосовместимость штаммов. Изучение биосовместимости штаммов бактерий показало, что штаммы Az-22, Az-24, С-21(8), С-82, Ф-11 и Ф-12 биосовместимы, то есть не подавляют рост и развитие друг друга. На основе этих штаммов была создана ассоциация агрономически ценных микроорганизмов, включающая штаммы целлюлолитических С-82, азотфиксирующих Az-24 и фосфатмобилизующих бактерий Ф-12 (в соотношении 1:1:1).
В лабораторных условиях изучили влияние отдельных штаммов бактерий и созданной ассоциации на развитие растений сахарной свеклы. Полученные данные представлены на рисунке.
Установлено, что отдельные штаммы и ассоциация обладают ростостимулирующей способностью, но ростостимуляция растений в варианте с ассоциацией была выше. Так, инокуляция семян штаммами бактерий увеличила длину стебля в 1,4–1,5 раза, корней – в 1,6–1,8 раза по сравнению с контролем. В то время как при инокуляции семян ассоциацией длина стебля увеличилась в 2,0 раза, корней – 2,5 раза по сравнению с контролем.
Исследование антифунгальной активности штаммов и ассоциации по отношению к основным фитопатогенным грибам, вызывающим корневые гнили, показало, что не все штаммы ассоциации характеризовались антифунгальной активностью (таблица).
Антифунгальная активность штаммов и ассоциации в отношении фитопатогенных грибов, возбудителей корневых гнилей сахарной свеклы (M ± SEM)
|
Штаммы бактерий |
Диаметр зоны подавления роста грибов, мм |
||
|
Alternaria alternata |
Fusarium solani |
Fusarium oxysporum |
|
|
Az-24 |
0 |
0 |
0 |
|
С-82 |
45,6 ± 0,5 |
36,2 ± 0,2 |
28,3 ± 0,1 |
|
Ф-12 |
0 |
0 |
0 |
|
Ассоциация |
48,5 ± 0,7 |
39,7 ± 0,3 |
29,9 ± 0,3 |
|
Контроль |
0 |
0 |
0 |
Установлено, что только штамм С-82 проявлял антифунгальную активность, остальные штаммы ею не обладали. Также показано, что ассоциация обладала более высокой антифунгальной активностью против фитопатогенных грибов. Так, антифунгальная активность ассоциации в отношении грибов F. oxysporum составляла 29,9 мм, F. solani – 39,7 мм и A. alternata – 48,5 мм, в то время как у штамма С-82 диаметр зоны подавления фитопатогенных грибов F. oxysporum составлял 28,3 мм, F. solani – 36,2 мм и A. alternata – 45,6 мм (таблица).
Заключение
Таким образом, из почв Казахстана были выделены новые штаммы агрономически ценных микроорганизмов: азотфиксирующие, фосфатмобилизующие и целлюлолитические бактерии. Изучена их биологическая активность и отобраны штаммы с высокой активностью. Для создания эффективной ассоциации проведено исследование биосовместимости штаммов и подобраны штаммы с отсутствием антагонизма по отношению друг к другу. На основе этих штаммов создана ассоциация агрономически ценных микроорганизмов для сельского хозяйства. Изучение ее ростостимулирующих свойств выявило высокое положительное влияние ассоциации на рост и развитие растений сахарной свеклы. Также проведенные исследования показали, что ассоциация является перспективным агентом для биоконтроля фитопатогенных грибов, так как обладает высокой антифунгальной активностью в отношении основных фитопатогенных грибов родов Fusarium и Alternaria, вызывающих корневые гнили сахарной свеклы.
В дальнейшем практическое применение созданной ассоциации в сельском хозяйстве позволит снизить заболеваемость растений за счет биоконтроля корневых гнилей в почве и стимулировать рост и развитие растений сахарной свеклы, что приведет к повышению ее урожайности. Также, использование ассоциации будет способствовать уменьшению химической нагрузки на почвы и позволит получить экологически чистую продукцию растениеводства.

