Исследование влияния объектов малых размеров (наночастиц) на различные органы и ткани животных является одним из приоритетных направлений развития современной медицинской науки. В настоящее время наибольшей популярностью пользуются наночастицы таких веществ, как медь, золото, диоксид титана, углерод и диоксид кремния. При этом диоксид кремния относится к соединениям, получившим широкое распространение в самых различных областях медицины: диагностике заболеваний, терапии, фармацевтике и других. Во многом такое обширное использование определяется возможностью задания специфических свойств путем модификации структурного построения этого соединения. Исключительные свойства разветвленной поверхности соединений диоксида кремния создают благоприятные условия для взаимодействия с различными биологическими средами. Благодаря этому, данное вещество может выступать как многообещающий биосовместимый и биодеградируемый материал, который способен проникать через гистогематические барьеры организма и может использоваться для целенаправленного транспорта различных лекарственных препаратов и диагностических средств [1]. Однако эти же свойства наночастиц диоксида кремния предполагают и потенциальные риски для организма. Так, в ряде исследований показано, что наночастицы диоксида кремния оказывают токсическое действие на некоторые клетки млекопитающих [2]. Данное обстоятельство указывает на то, что для гарантии безопасного использования в биомедицинских целях уникальных возможностей наночастиц диоксида кремния, а также для нивелирования их токсических эффектов, необходимо продолжение детального изучения взаимодействия этих наночастиц с клетками и тканями in vivo.
В ряде исследований показано выраженное сродство диоксида кремния к тканям респираторного отдела лёгких и при парентеральном, и при ингаляционном введении, что обусловлено морфофункциональными особенностями легочной ткани [3]. Известно, что размеры частиц являются одним из определяющих факторов в степени проявления токсических свойств наночастиц с последующей активацией макрофагов и развитием пневмофиброгенеза [4]. По этим причинам важным моментом остаётся определение схожести реакции тканей лёгкого на парентеральное введение наночастиц диоксида кремния с лёгочным силикозом и поиск оптимального размера частиц, при котором сохраняется «сродство» к лёгочной ткани, но степень токсического воздействия – минимальна. Наш научный интерес определился изучением общих вопросов неспецифических механизмов, связанных с естественными морфофункциональными особенностями лёгкого в ответ на парентеральное введение диоксида кремния и особенностей реактивных изменений, характеризующих степень безопасности для органа-мишени и организма в целом.
Целью настоящей работы явилось изучение реакции макрофагов и тучных клеток респираторного отдела лёгкого крыс в ответ на однократное парентеральное введение наночастиц диоксида кремния (НЧДК) сферической формы размером 12 нм.
Материалы и методы исследования
Исследование проведено на 30 соматически здоровых самцах крыс стока Wistar, массой 220–250 г (ФГУП «ПЛЖ «Рапполово», Россия), содержавшихся в стандартных условиях вивария конвенциональной категории.
Животные были разделены на 2 группы: 1) контроль (n = 15) – с введением 1 мл физиологического раствора (К); 2) экспериментальная группа (n = 15) – с введением 1 мл суспензии НЧДК в физиологическом растворе (Э). Суспензия НЧДК (кремнезем, Аэросил 200, SiO2, частицы сферической формы с размером 12 нм) вводилась однократно в хвостовую вену в объеме 1 мл при концентрации кремнезема 2 мг/мл. Манипуляции с животными проводили в условиях анестезии раствором золетила (6 мг/кг), вводимого внутрибрюшинно. При экспериментальных исследованиях руководствовались «Правилами проведения работ с использованием экспериментальных животных», принципами Европейской конвенции (г. Страсбург, 1986 г.) и Хельсинкской декларацией Всемирной медицинской ассоциации о гуманном обращении с животными, 1996 г.
Выведение из эксперимента и забор материала для исследования осуществляли на 21 сутки, через 2 и 4 месяца после введения НЧДК, по 5 животных в группе. Для гистологического анализа лёгкое в растянутом состоянии фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7,4) в течение суток, затем получали фронтальный срез доли левого лёгкого, с обязательным присутствием долевого и сегментарных бронхов, лёгочных сосудов и альвеолярной ткани, покрытой висцеральной плеврой. Парафиновые блоки изготавливали по стандартной гистологической методике. Для получения сопоставимых результатов от всех животных образцы обрабатывали параллельно и в одинаковых условиях. Срезы толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония) и окрашивали гематоксилином и эозином. Визуализацию тучных клеток (ТК) проводили окрашиванием толуидиновым синим (Биовитрум, Россия). Для иммуногистохимического выявления макрофагов использовали первичные моноклональные мышиные антитела Anti-CD68 antibody (ab 31630) (Abcam, Великобритания). Для выявления связавшихся первичных антител использовали мультимерную безбиотиновую систему детекции Reveal-Biotin-Free Polyvalent DAB (Spring Bioscience Corporation,USA). Препараты докрашивали гематоксилином Майера (Биовитрум, Россия).
Подсчёт альвеолярных, интерстициальных макрофагов (аМФ и иМФ соответственно) и ТК производили на цифровых изображениях срезов респираторного отдела лёгкого, полученных при помощи светового микроскопа Leica DM750 (Leica, Германия) и цифровой фотокамеры ICC50 (Leica, Германия), с помощью прикладной компьютерной программы анализа изображений ImageScope Color (версия M). Для каждого животного на срезе подсчитывали число CD68+ клеток в интерстиции лёгкого и в альвеолах и ТК, располагающихся преимущественно периваскулярно и перибронхиально, в 20 полях зрения, площадью 0,33×0,25 мм каждое поле, при объективе х10, окуляре х40.
Статистическую обработку полученных количественных данных проводили с использованием стандартного пакета программ (Statistica 7.0 Stat.Soft for Windows). Вычисляли среднее арифметическое значение и его стандартную ошибку (M ± m), оценку значимости различий показателей проводили с применением критерия Вилкоксона. Значимость различий определяли при p < 0,05.
Результаты исследования и их обсуждение
У животных во всех контрольных группах макроскопически лёгкие воздушные, розового цвета, мягко-эластичные. Микроскопически архитектоника ткани сохранена, стенка бронхов не утолщена, эпителий бронхов без особенностей, в просвете бронхов содержимого нет, плевра не утолщена. Бронхоассоциированная лимфоидная ткань без особенностей. Отмечается умеренное полнокровие капилляров интерстиция. В интерстиции респираторного отдела содержится полиморфный клеточный пул, включающий в основном компоненты макрофагального (иМФ), лимфоидного ряда, с присутствием эозинофильных лейкоцитов. ТК выявляются перибронхиально вокруг долевого и сегментарных бронхов, и около крупных сосудов (рисунок, а), в интерстиции респираторного отдела встречаются единичные ТК. В альвеолах отмечаются единичные аМФ (рисунок, б).
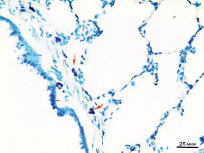
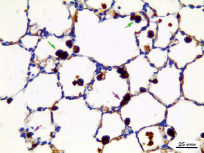
а) б)
Тучные клетки (а) и макрофаги (б) в респираторном отделе лёгкого животного на 4 месяце эксперимента. Красная стрелка – тучная клетка, зеленая стрелка – альвеолярный макрофаг, розовая стрелка – интерстициальный макрофаг. Окраска: толуидиновым синим (а), иммуногистохимическая реакция на CD68 с подкраской гематоксилином (б). Об.40, ок.10
У экспериментальных животных на всех сроках эксперимента макроскопически лёгкие соответствуют контрольным. Микроскопически архитектоника бронхов и респираторного отдела сохранена. На 21 сутки эксперимента визуально межальвеолярные перегородки не утолщены, но число иМФ увеличивается до 180 % и составляет 9 ± 0,8 в поле зрения, что значимо отличается от контрольных значений. В просвете альвеол содержимого нет, но наблюдается незначимое увеличение числа аМФ до 8 ± 0,7 клеток в поле зрения. Число ТК не изменяется по сравнению с контрольными значениями (таблица).
Динамика показателей объектов морфометрии в респираторном отделе лёгкого после введения наночастиц диоксида кремния
|
Клетки |
21 сут. |
2 мес. |
4 мес. |
|||
|
Контр. (физ. р-р) |
НЧК |
Контр. (физ .р-р) |
НЧК |
Контр. (физ. р-р) |
НЧК |
|
|
Макрофаги альвеолярные |
6 ± 0,5 |
8 ± 0,7 |
7 ± 2 |
8 ± 1 |
5 ± 1 |
10 ± 1а p = 0,004942 |
|
Макрофаги интерстициальные |
5 ± 1 |
9 ± 0,8а p = 0,001264 |
7 ± 2 |
9 ± 1 |
4 ± 2 |
6 ± 0,7а p = 0,006777 |
|
Тучные клетки |
2 ± 0,4 |
2 ± 0,3 |
4 ± 0,4 |
1 ± 0,2 |
3 ± 0,8 |
2 ± 0,3 |
Примечание. а – показатели статистически значимо отличаются от группы контроля при р < 0,05.
Через 2 месяца эксперимента визуально перегородки утолщены за счёт умеренного клеточного инфильтрата. Число иМФ и аМФ незначимо повышено по сравнению с показателями в группе К, число ТК незначимо снижается до 1 ± 0,2 клетки в поле зрения (таблица).
Через 4 месяца после введения НЧДК повышается содержание клеток в межальвеолярных перегородках, число иМФ значимо увеличивается до150 % и составляет 6 ± 0,7 клеток в поле зрения. Численность аМФ значимо повышается до 200 % и составляет 10 ± 1 клеток в поле зрения. ТК не реагируют на введение НЧДК, их число остаётся в пределах контрольных значений (таблица).
Проведенное исследование показало увеличение числа макрофагов на 21 сутки эксперимента как в интерстиции, так и в альвеолах, что свидетельствует о распространении гематогенно вводимых НЧДК размером 12 нм за пределы капилляра. Очевидно, что НЧДК пересекают как стенку капилляра, попадая в интерстиций, так и компоненты аэрогематического барьера, оказываясь в просвете альвеол. При этом наблюдаемая макрофагальная реакция свидетельствует об интернализации дисперсных нанообъектов в макрофаги. Логично предположить, что интернализация нанообъектов происходит и в эндотелий, и в фибробласты, и в альвеолоциты. Но только макрофаги, являясь важнейшим звеном в системе местного иммунитета и обеспечивая неспецифический и специфический иммунные ответы, остро реагируют на интернализацию НЧДК, что объясняется необходимостью элиминации инородного материала. Установлено, что инородные тела не остаются в тканях постоянно. В физиологической среде, после распределения НЧДК в тканях, происходит их распад на сроках от 2 недель до 3 месяцев, что зависит от размеров, степени пористости частиц и др. факторов [5].
Механизмы клеточных изменений на молекулярном уровне в ответ на интернализацию НЧДК представлены в современных работах на клеточных культурах. Так, показано, что при гидролизе ортокремниевой кислоты образующиеся ионы H+ и H3SiO4 закисляют внутриклеточную среду, что стимулирует синтез белка криопирина (NLRP3), который, в свою очередь, запускает воспалительную реакцию [6]. Ключевыми медиаторами воспаления при этом являются интерлейкины IL-1β, IL-6, провоспалительный цитокин CXCL8 и фактор транскрипции, контролирующий экспрессию генов иммунного ответа и апоптоза [7]. Появились данные, что развитию/поддержанию реактивного воспаления в ответ на внутриклеточную интернализацию НЧДК способствует повреждение мембранных структур клетки, развивающееся по механизму окислительного стресса [8].
В ходе настоящего исследования in vivo показано увеличение и поддержание численности макрофагального пула в легочной ткани на протяжении 4 месяцев эксперимента. Полученные данные свидетельствуют о хроническом асептическом воспалении, представленном макрофагальной инфильтрацией, вызванной интернализацией НЧДК в макрофаги, биодеградацией НЧДК внутри макрофагов, что, в свою очередь, вероятно, приводит к синтезу криопирина – триггера воспаления.
Согласно литературным данным число иМФ приблизительно соответствует числу аМФ [9]. Результаты настоящего исследования соответствуют этим данным и на всех сроках эксперимента наблюдаются приблизительно одинаковые контрольные значения числа иМФ и аМФ. В группах с внутривенным введением НЧДК на 21 сутки и 2 месяца эксперимента числа иМФ и аМФ возрастают одновременно и также приблизительно равны. Однако через 4 месяца в экспериментальной группе число аМФ значимо выше контрольных значений и превосходит число иМФ. В работе Мильто [10] показано, что после парентерального введения наноразмерных частиц магнетита в лёгких у крыс альвеолярные иммунопозитивные макрофаги доминируют над интерстициальными. Однако полученные данные автор не объясняет. Возможно, активация аМФ на данном сроке эксперимента происходит не без участия компонентов сурфактанта, один из белков которого – сурфактантный белок D (SP-D) – регулирует деятельность аМФ [11].
Под действием провоспалительных и антипатогенных факторов в макрофагах активируется индуцибельная NO-синтаза (iNOS), способствующая образованию окиси азота (NO) и длительному поддержанию его высокой концентрации во внеклеточной среде. При этом NO в высокой концентрации приводит к нитрозилированию сурфактантного белка SP-D и изменению его роли с ингибитора активности аМФ на роль активатора воспалительной реакции [12]. В данном случае наличие хронического асептического воспаления, сохраняющегося на протяжении всего эксперимента (прежде всего в интерстиции респираторного отдела), очевидно, приводит к повышенной продукции NO, что, в свою очередь, ведет к нитрозилированию белка SP-D, повышающего функциональную активность макрофагов в альвеолах, а они, синтезируя провоспалительные цитокины, продолжают привлекать в альвеолы все новые макрофаги. Однако остаётся неизвестным, было ли повышение пула аМФ в период между 2 и 4 месяцами эксперимента.
В ходе настоящего исследования показано, что ТК не реагируют на парентеральное введение НЧДК сферической формы размером 12 нм, не мигрируют в межальвеолярные перегородки и их число перибронхиально и перивазально не увеличивается, что является положительным признаком. Хорошо известно, что именно макрофаги первыми реагируют на экзогенный фактор (в данном случае НЧДК) и становятся инициаторами клеточных реакций, в результате которых происходит перестройка соединительной ткани [13]. Цитокины, прежде всего ИЛ-1, секретируемые макрофагами, провоцируют миграцию ТК и их IgE-независимую дегрануляцию. Показано, что триптаза и химаза гранул ТК стимулируют секреторную активность фибробластов и их пролиферацию [14]. Таким образом, секреторная активность макрофагов и ТК приводит к ремоделированию соединительной ткани в органах. В настоящей работе обнаружено, что ТК нечувствительны к НЧДК, не вовлекаются в межклеточные взаимодействия, и на протяжении 4 месяцев эксперимента не наблюдалось соединительнотканного ремоделирования в интерстиции респираторного отдела и морфологических признаков, характерных для силикоза лёгких. Кроме того, следует отметить, что в реакцию местного иммунитета не вовлекаются и клетки лимфоидного ряда, нейтрофилы и эозинофилы, что также не способствует усилению воспалительного процесса в тканях легких.
По итогам проведенного экспериментального исследования установлено, что внутривенное введение суспензии НЧДК (0,1 мг/кг) сферической формы размером 12 нм приводит к развитию хронического асептического воспаления, проявляющегося в увеличении пула иМФ в межальвеолярных перегородках и аМФ в просвете альвеол на протяжении 4 месяцев эксперимента. Полученные результаты указывают на необходимость дальнейшего изучения влияния НЧДК на популяции макрофагов и тучных клеток в респираторном отделе легких на более длительных сроках.
Работа выполнена в рамках темы госзадания № госрегистрации АААА-А18- 18102590054-0.

