Уголь является наиболее распространенным в мире энергоносителем и может обеспечивать энергетические потребности планеты на протяжении ближайших столетий. В мире ежегодно добывается ~ 5 млрд т каменного угля. Более 40 % производимой в мире электроэнергии вырабатывается путем сжигания угля. При этом на ТЭЦ на один выработанный кВт/ч электроэнергии приходится значительно больше эмиссий парниковых газов в сравнении с другими энергоносителями. Так, при получении 1 ГДж теплоты из угля образуется 90 кг СО2 [1]. В эпоху, когда каждая страна в мире связана обязательствами по сокращению выбросов парниковых газов, неудивительно, что спрос на уголь быстро падает. Несмотря на эти глобальные тенденции, США ищут способы оживить свою умирающую угольную отрасль. Идея состоит в том, чтобы изменить продукт: вместо добычи угля в качестве источника топлива они могли бы добывать уголь ради получения ценных металлов, содержащихся в нем.
Не вдаваясь в детали широкого обсуждения использования угля, как одного из самых дешевых топливных ресурсов, в данной работе внимание акцентировано на вопросе такого нетрадиционного сырьевого источника, как зола, которая получается в результате сжигания угля и вполне может быть использована для дополнительного получения металлов.
Отходы золошлаков и их переработка давно привлекали внимание ученых. Различные химико-технологические аспекты использования золошлаковых отходов для производства строительных материалов и ферросплавов рассмотрены в работах [2, 3]. Золошлаковые массы могут являться уникальным ресурсом и рассматриваться в качестве самостоятельных комплексных рудных месторождений редких, редкоземельных металлов, которые располагаются на поверхности, тем самым не требуя расходов на их извлечение.
В последнее десятилетие, в связи с ростом развития новых и возобновляемых источников энергии, включая водородную энергетику; технологии наноустройств и микросистемной техники; технологии создания ракетно-космической и транспортной техники нового поколения, интерес к этим отходам, накопленные объемы которых сегодня исчисляются десятками миллионов тонн, приобрел особый интерес. Это связано с тем, что создание и развитие новых наукоемких производств высоких переделов (5, 6 и 7 переделы) в первую очередь требует применения редких и редкоземельных металлов, которые вполне могут быть получены из угля или его отходов, в том числе из золошлаков [4, 5].
С другой стороны, возросший интерес к редким и редкоземельным металлам обусловлен особенностями рыночной политики последних нескольких лет. Введение ограничений на экспортные поставки РЗМ Китаем, который отвечает за производство более чем на 90 % мировых редкоземельных металлов, привело к панике на рынке, резкому росту цен и риска потери источника сырья для отдельных отраслей промышленности других стран. К примеру, если бы Китай изменил свое мнение о поставках РЗМ в США, это сделало бы США более уязвимым для внешних угроз.
Китай в прошлом умело использовал свое превосходство в поставках редкоземельных металлов и для политического маневрирования. В 2010 г. Китай заблокировал экспорт редкоземельных металлов в Японию из-за морского спора. Это вызвало резкий рост мировых цен на редкоземельные металлы и показало опасность монополии в сфере критических элементов. После того как спор был улажен, Китай возобновил экспорт. Но тем не менее Япония вынуждена была диверсифицировать поставки редкоземельных металлов, чтобы избежать такой ситуации снова.
В США есть только одно месторождение редкоземельных металлов, в Калифорнии, и оно было закрыто в 2016 г., после того как горнодобывающая компания Molycorp подала на банкротство. Есть, однако, много угольных шахт. Исходя из сложившейся ситуации в 2015 г. Министерство энергетики США выделило 20 млн долларов для проектов, направленных на то, чтобы выяснить, как снизить затраты на восстановление редкоземельных металлов из угля. С тех пор научное сообщество уже достигло определенного прогресса [6–10].
В настоящее время технолого-экономический потенциал отходов угольных предприятий почти не востребован. Единственным редким металлом, который получают из углей и углеотходов в промышленных количествах, является Ge.
На наш взгляд, подход, направленный на извлечение из золошлаков исключительно РЗМ [6–8], не представляется перспективным, так как в этом случае теряется смысл комплексности использования сырья [9, 10]. Учитывая, что основными компонентами золошлаков являются оксиды алюминия, кремнезема и железа, необходимо учитывать возможность извлечения всего спектра металлов. В рассматриваемом ракурсе большой интерес для практики может представлять представленная в работе [11] комплексная, высокоэффективная технология переработки золы с комплексным извлечением кремнезема, оксида алюминия, железа и РЗМ в товарные продукты. Настоящая работа затрагивает теоретические аспекты технологии, касательно селективного извлечения оксида алюминия и кремнезема в товарные продукты.
Цель работы – исследование поведения оксида алюминия, кремнезема и железа в условиях хлорирующего обжига золы от сжигания Экибастузских углей в атмосфере воздуха, применительно к технологии комплексной переработки золы.
Материалы и методы исследования
Оценка вероятного направления реакций, протекающих между компонентами золы и хлоридом кальция, проводилась по изменению термодинамических величин системы. Основное внимание уделено реакциям взаимодействия оксидов алюминия, железа с хлоридом кальция в условиях обжига в воздушной атмосфере.
Термодинамический анализ проведен с учетом зависимости изобарно-изотермических потенциалов (свободная энергия Гиббса) реакций от температуры. Изменение свободной энергии Гиббса (ΔGºT) рассчитывали по формуле
ΔGºT = ΔНºT – ΔSºT * Т, (1)
где ΔНºT, ΔSºT – стандартные значения энтальпии и энтропии системы соответственно;
T – абсолютная температура, К.
При расчетах энергии Гиббса (ΔGºT) искомых реакций за стандартное состояние минералообразующих соединений, присутствующих в золе, а также кварца и оксидов железа приняты твердые их состояния (s). Для газообразных соединений за стандартное состояние приняты газы (g). За стандартное состояние хлорида кальция выбран жидкий хлорид (l). Исходные данные для расчетов получены из работы [12] и веб-сайта NIST-JANAF Thermo chemical Tables.
Термодинамические расчеты реакций, принятые к анализу, проведены с использованием специальной программы, разработанной авторами.
Изменение константы равновесия реакции (Kp) в зависимости от температуры определяли исходя из выражения
ΔGºT = − RT ln Kp = −19,155*Т lg Kp, (2)
где R – универсальная газовая постоянная (R = 8,32*10-3 кДж/град∙моль).
Для проведения термодинамических расчетов использованы результаты по формам нахождения алюминия, кремнезема и железа в исходной золе. Комплексные исследования вещественного состава исходной золы проведены методами элементного, рентгенофазового и кристаллооптического анализа с применением приборов нового поколения. В качестве объекта исследования использованы пробы золы, полученной от сжигания Экибастузских углей.
Элементный состав исходных проб золы определяли методом рентгеноспектрального микроанализа с использованием электронно-зондового микроанализатора Super Рrobe 733 (Jeol, Япония). Анализы элементного состава образцов и фотосъёмку в различных видах излучений выполняли с использованием энергодисперсионного спектрометра Inca Energy (Oxford Instruments, Англия).
Рентгенодифрактометрический анализ проведен на дифрактометре ДРОН-3 с Cu Кa – излучением, β-фильтр. Условия съемки дифрактограмм: U = 35 кВ; I = 20 мА; съемка θ-2θ; детектор 2 град/мин. Рентгенофазовый анализ на полуколичественной основе выполнен по дифрактограммам порошковых проб с применением метода равных навесок и искусственных смесей. Определялись количественные соотношения кристаллических фаз. Интерпретация дифрактограмм проводилась с использованием данных картотеки ICDD: база порошковых дифрактометрических данных PDF2 ( Powder Diffraction File ) и дифрактограмм чистых от примесей минералов.
Расчет рационального состава золы проводился на основании результатов вышеупомянутых комплексных исследований с использованием современных методов металлургических расчетов.
Результаты исследования и их обсуждение
В качестве объектов исследования использованы золы Алматинской ТЭЦ-2, работающей на Экибастузском угле, зольностью 30 %. Объемы накопленных на сегодня золоотходов составляют 20 млн т.
Исследование вещественного состава исходной золы
Для исследования элементного сос- тава исходной золы были приготовлены три порошковые пробы. Характерный спектр исходной золы и результаты элементного состава представлены на рис. 1 и в табл. 1 соответственно.
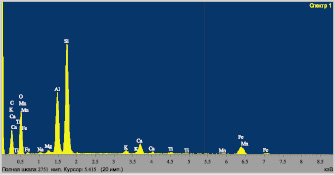
Рис. 1. Спектр исходной золы от сжигания Экибастузского угля
Таблица 1
Результаты элементного состава золы от сжигания Экибастузского угля
|
Элементы |
Al |
Si |
Fe |
Ti |
Mg |
K |
Ca |
Mn |
O |
Na |
|
Содержание, % вес. Спектр 1 |
13,66 |
27,71 |
5,52 |
0,64 |
0,64 |
0,89 |
3,17 |
0,20 |
46,96 |
0,61 |
|
Спектр 2 |
13,83 |
28,20 |
5,49 |
0,71 |
0,58 |
0,85 |
2,36 |
0,13 |
47,50 |
0,35 |
|
Спектр 3 |
14,87 |
28,55 |
4,97 |
0,65 |
0,35 |
0,82 |
2,10 |
0,11 |
46,85 |
0,72 |
|
Среднее |
14,12 |
28,15 |
5,33 |
0,67 |
0,52 |
0,86 |
2,54 |
0,15 |
47,10 |
0,56 |
|
Станд. откл. |
0,66 |
0,42 |
0,31 |
0,04 |
0,15 |
0,04 |
0,56 |
0,05 |
0,35 |
0,19 |
|
Макс. |
14,87 |
28,55 |
5,52 |
0,71 |
0,64 |
0,89 |
3,17 |
0,20 |
47,50 |
0,72 |
|
Мин. |
13,66 |
27,71 |
4,97 |
0,64 |
0,35 |
0,82 |
2,10 |
0,11 |
46,85 |
0,35 |
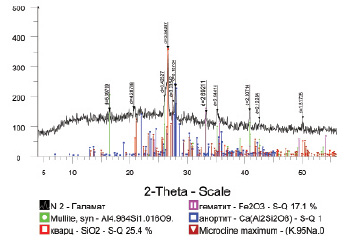
Рис. 2. Штрих-диаграмма исходной золы
Результаты фазового состава исходной золы, полученные расшифровкой штрих-диаграммы рентгенодифрактометрического анализа на дифрактометре ДРОН-3 (рис. 2), приведены в табл. 2.
Таблица 2
Результаты полуколичественного рентгенофазового анализа кристаллических фаз
|
Название фазы |
Формула |
Содержание, % |
|
Муллит |
Al4.984Si1.016O9.508 |
36,2 |
|
Кварц |
SiO2 |
25,4 |
|
Гематит |
Fe2O3 |
17,1 |
|
Анортит ПШ |
Ca(Al2Si2O8) |
12,2 |
|
Microcline КПШ |
(K.95Na.05)AlSi3O8 |
9,1 |
Как показывают результаты фазового анализа, алюминий в исходной золе представлен в основном в виде труднорастворимого муллита (Al4.984Si1.016O9.508) – минерала из класса силикатов и в форме анортита Ca(Al2Si2O8) – минерала из группы полевых шпатов (ПШ), который по составу относится к алюмосиликатам со структурой каркасного типа. Обращает на себя внимание повышенное содержание свободного кварца (25,4 %) и гематита (Fe2O3) – 17,1 %. В незначительном количестве (9,1 %) в исходной золе обнаружена фаза калиевых полевых шпатов (микроклин КПШ).
На основании полученных результатов рассчитан рациональный состав золы (табл. 3), который был принят за основу для проведения термодинамических расчетов.
Таблица 3
Рациональный состав золы от сжигания Экибастузского угля
|
Соединения |
Элементы, % мас. |
|||||||
|
Al |
Si |
Fe |
Ca |
Na |
K |
O |
Всего: |
|
|
Al4.984Si1.016O9.508 |
15,15 |
3,33 |
17,72 |
36,2 |
||||
|
SiO2 |
11,87 |
13,53 |
25,4 |
|||||
|
Fe2O3 |
11,96 |
5,14 |
17,1 |
|||||
|
Ca(Al2Si2O8) |
2,30 |
2,48 |
1,77 |
5,65 |
12,2 |
|||
|
(K.95Na.05)AlSi3O8 |
0,83 |
2,67 |
0,36 |
1,18 |
4,06 |
9,1 |
||
|
Итого: |
18,28 |
20,35 |
11,96 |
1,77 |
0,36 |
1,18 |
46,10 |
100,0 |
Термодинамический анализ реакций взаимодействия компонентов золы с хлоридом кальция в условиях окислительной атмосферы
Основной задачей окислительного обжига является перевод труднорастворимого муллита (Al4.984Si1.016O9.508) в геленит (Ca2Al2SiO7), который при дальнейшем выщелачивании соляной кислотой (HCl) легко переходит в раствор. Это позволит уже в начальной стадии выделить алюминий в раствор и селективно извлечь кварц в виде товарного продукта [11].
При окислительном хлорирующем обжиге золы будут протекать реакции взаимодействия муллита, а также и других соединений золы с хлоридом кальция. Вероятность протекания той или иной реакции можно оценить исходя из изменений термодинамических величин. Рассмотрим механизм взаимодействия соединений золы с хлоридом кальция в зависимости от температуры. Общий химизм процесса обжига можно описать системой реакций:
Al2SiO5 (s) + 2CaCl2 (l) + O2 (g) = = Ca2Al2SiO7 (s) + 2Cl2 (g), (1)
Al2SiO5 (s) + 2CaCl2 (l) + 2H2O (g) = = Ca2Al2SiO7 (s) + 4HCl (g), (2)
Al2SiO5 (s) + SiO2 (s) + CaCl2 (l) + 0.5 O2 (g) = = CaAl2Si2O8 (s) + Cl2 (g), (3)
Al2SiO5 (s) + SiO2 (s) + CaCl2 (l) + H2O (g) = = CaAl2Si2O8 (s) + 2HCl (g), (4)
SiO2 (s) + Al2O3 (s) + 2CaCl2 (l) + O2 (g) = = Ca2Al2SiO7 (s) + 2Cl2 (g), (5)
2SiO2 (s) + Al2O3 (s) + CaCl2 (l) + 0.5 O2 (g) = = CaAl2Si2O8 (s) + Cl2 (g), (6)
Fe3O4 (s) + CaCl2 (l) + 0.5 O2 (g) = = CaFe3O5 (s) + Cl2 (g), (7)
3Fe2O3 (s) + 2CaCl2 (l) + 0.5 O2 (g) = = 2CaFe3O5 (s) + 2Cl2 (g), (8)
2TiO2 (s) + 3CaCl2 (l) + 1.5 O2 (g) = = Ca3Ti2O7 (s) + 3Cl2 (g), (9)
TiO2 (s) + CaCl2 (l) + 0.5 O2 (g) = = CaTiO3 (s) + Cl2 (g). (10)
На рис. 3 показана зависимость изменения величины энергии Гиббса для реакций (1)–(4) в температурном интервале 1073…1373 К характерной для условий окислительного обжига золы совместно с хлоридом кальция.
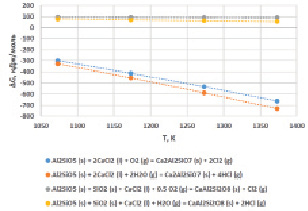
Рис. 3. Зависимость изменения энергии Гиббса реакций (1)–(4) от температуры
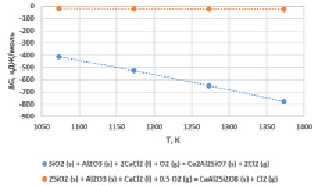
Рис. 4. Зависимость изменения энергии Гиббса реакций (5), (6) от температуры
Видно, что вероятность разложения муллита хлоридом кальция в окислительной атмосфере по реакции (1) достаточно высока и сопровождается образованием геленита и выделением хлора. Энергия Гиббса реакции (1) с повышением температуры растет и во всем исследованном температурном интервале характеризуется высоким отрицательным значением: ∆G1073 K = –298,9 кДж/моль; ∆G1373 K = –663,2 кДж/моль. Эффект разложения муллита в условиях обжига усиливается в присутствии паров воды (реакция 2). Значения энергии Гиббса, по сравнению с реакцией (1), возрастают на порядок и составляют: ∆G1073 K = –326,9 кДж/моль; ∆G1373 K = –732,2 кДж/моль.
Наличие в исходной золе свободного кварца затрудняет процесс разложения муллита хлоридом кальция, как в условиях окислительной атмосферы (реакция 3), так и при использовании паров воды (реакция 4). В температурном интервале 1073…1373 К значения энергии Гиббса указанных реакций характеризуются положительными значениями (рис. 3), что свидетельствует о невозможности образования анортита (CaAl2Si2O8) по реакции (3), (4).
На рис. 4 видно, что образование геленита может сопровождаться в результате совместного взаимодействия свобод- ного кварца и оксида алюминия с хлори- дом кальция (реакция 5). Расчетные значения энергии Гиббса реакции (5) указывают, что в условиях избыточного расхода CaCl2 и кислорода вероятность ее протекания высока. Изменение энергии Гиббса с повышением температуры показывает резкий рост: ∆G1073 K = –411,9 кДж/моль; ∆G1373 K = –778,6 кДж/моль.
Согласно реакции (6) снижение расхода CaCl2 и кислорода в системе резко уменьшает вероятность образования геленита: реакция (6) в этом случае протекает с образованием анортита (CaAl2Si2O8). В этом случае низкие значения энергии Гиббса, хотя и остаются на уровне минимальных отрицательных величин, тем не менее указывают на возможность образования геленита в температурном интервале 1073…1373 К (рис. 4).
Вероятность протекания реакций (7)–(10) с выделением газообразного хлора и образованием ферритов и титанатов кальция практически невозможно, ввиду положительных значений энергии Гиббса в интервале температур 1073…1373 К.
Результаты термодинамических расчетов энергии Гиббса и логарифма константы равновесия реакций (1)–(10) представлены в сводной табл. 4.
Таблица 4
Результаты термодинамических расчетов энергии Гиббса и логарифма константы равновесия реакций (1)–(10)
|
№ п/п |
Реакция |
Температура, K |
Температура, K |
||||||
|
1073 |
1173 |
1273 |
1373 |
1073 |
1173 |
1273 |
1373 |
||
|
Энергия Гиббса, ΔG, кДж/моль |
Lg Kp |
||||||||
|
1 |
Al2SiO5 (s) + 2CaCl2 (l) + O2 (g) = = Ca2Al2SiO7 (s) + 2Cl2 (g) |
–298,9 |
–412,8 |
–534,4 |
–663,2 |
14,54 |
18,37 |
21,92 |
25,22 |
|
2 |
Al2SiO5 (s) + 2CaCl2 (l) + 2H2O (g) = = Ca2Al2SiO7 (s) + 4HCl (g) |
–326,9 |
–454,4 |
–589,7 |
–732,2 |
15,90 |
20,22 |
24,18 |
27,84 |
|
3 |
Al2SiO5 (s) + SiO2 (s) + CaCl2 (l) + + 0.5 O2 (g) = CaAl2Si2O8 (s) + Cl2 (g) |
94,3 |
92,9 |
91,8 |
90,7 |
–4,59 |
–4,13 |
–3,76 |
–3,45 |
|
4 |
Al2SiO5 (s) + SiO2 (s) + CaCl2 (l) + + H2O (g) = CaAl2Si2O8 (s) + 2HCl (g) |
80,3 |
72,1 |
64,1 |
56,3 |
–3,91 |
–3,21 |
–2,63 |
–2,14 |
|
5 |
SiO2 (s) + Al2O3 (s) + 2CaCl2 (l) + + O2 (g) = Ca2Al2SiO7 (s) + 2Cl2 (g) |
–411,9 |
–526,6 |
–649 |
–778,6 |
20,04 |
23,44 |
26,62 |
29,60 |
|
6 |
2SiO2 (s) + Al2O3 (s) + CaCl2 (l) + + 0.5 O2 (g) = CaAl2Si2O8 (s) + Cl2 (g) |
–18,7 |
–20,9 |
–22,8 |
–24,6 |
0,91 |
0,93 |
0,94 |
0,94 |
|
7 |
2TiO2 (s) + 3CaCl2 (l) + 1.5 O2 (g) = = Ca3Ti2O7 (s) + 3Cl2 (g) |
158,7 |
153,5 |
149,1 |
145,4 |
–7,72 |
–6,83 |
–6,11 |
–5,53 |
|
8 |
TiO2 (s) + CaCl2 (l) + 0.5 O2 (g) = = CaTiO3 (s) + Cl2 (g) |
25,7 |
24,1 |
22,7 |
21,6 |
–1,25 |
–1,07 |
–0,93 |
–0,82 |
|
9 |
Fe3O4 (s) + CaCl2 (l) + 0.5 O2 (g) = = CaFe3O5 (s) + Cl2 (g) |
179,3 |
204,7 |
234,7 |
267,1 |
–8,72 |
–9,11 |
–9,63 |
–10,16 |
|
10 |
3Fe2O3 (s) + 2CaCl2 (l) + 0.5 O2 (g) = = 2CaFe3O5 (s) + 2Cl2 (g) |
491,3 |
536,4 |
586,4 |
640,9 |
–23,90 |
–23,87 |
–24,05 |
–24,37 |
Таким образом, из термодинамического анализа следует, что при окислительном обжиге золы совместно с хлоридом кальция в температурном интервале 1073…1373 К вполне возможно разложить труднорастворимый муллит (Al4.984Si1.016O9.508) до легкорастворимого в соляной кислоте геленита (Ca2Al2SiO7) с дальнейшим переводом его в раствор при выщелачивании. Это позволит уже в начальной стадии технологии [11] селективно разделить оксид алюминия и кварц с переводом их в целевые продукты.
Выводы
1. Проведен термодинамический анализ основных реакций взаимодействия соединений алюминия (муллит, анортит), кварца и железа (гематит, магнетит) с хлоридом кальция (CaCl2) и кислородом, характерных для пирометаллургической переработки золы от сжигания угля в интервале температур 1073…1373 К.
2. Установлено, что для разложения трудно растворимого соединения алюминия (муллита) до легкорастворимого геленита целесообразно его предварительно подвергать обжигу совместно с хлоридом кальция в окислительной атмосфере.
3. Предварительная переработка золы обжигом является хорошей предпосылкой для извлечения оксида алюминия и кварца в начальной стадии с высокой эффективностью и уменьшения ущерба, наносимого окружающей среде.

