Согласно общепринятой точке зрения у детей до 6 лет болезнь Пертеса имеет доброкачественное течение, благоприятный прогноз и не требует активного лечения [1]. Однако при значительной степени поражения эпифиза (Catterall III, IV) удельный вес неудовлетворительных результатов возрастает до 31–43 % [2, 3]. И, поскольку взаимосвязь между характером лечения и вероятностью неблагоприятного исхода установить не удается [1, 4, 5], значимость фактора возраста как прогностического критерия снижается.
Основной причиной некроза тканей головки бедренной кости признан тромбоз микроциркуляторного русла на фоне дисплазии сосудов конечности и ангиоспазма [6]. После окклюзии участка сосудистого русла кровообращение в головке бедренной кости стабилизируется, однако аномалия сосудов конечности сохраняется и может быть причиной латентной хронической ишемии, влияющей на регенерацию тканей и развитие компонентов тазобедренного сустава.
Известно, что пульсовая волна позволяет получить представление о состоянии кровообращения и тонусе стенок сосудов [7]. Был разработан способ введения спиц в костные компоненты тазобедренного сустава, обеспечивающий возможность регистрировать пульсовую волну кровенаполнения во внутрикостных тканях с помощью реовазографии [8].
Цель исследования: выявить особенности пульсового кровенаполнения в компонентах тазобедренных суставов у детей до 6 лет при болезни Пертеса.
Материалы и методы исследования
Исследование выполнено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации с поправками МЗ РФ при информированном письменном согласии родителей пациентов на проведение исследования без идентификации личности. Регистрировали пульсовые волны кровенаполнения в компонентах тазобедренного сустава 64 пациентов с болезнью Пертеса возраста 4–12 лет и определяли их количественные характеристики. Затем результаты исследований 14 пациентов возраста 4–6 лет сопоставляли с совокупностью данных всех пациентов. Критерии включения: II стадия по Waldenstrom, III–IV группы по Catterall, группы В/С, С по Herring.
Регистрацию параметров пульсовой волны проводили в условиях операционной перед фиксацией аппарата Илизарова для декомпрессии в тазобедренном суставе при сохраняющейся мобильности пациента. Электродами служили спицы диаметром 1,8 мм, которые вводили с помощью электродрели (рисунок).
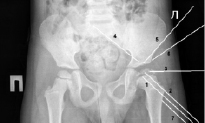
Рентгенограмма пациента 7 лет с болезнью Пертеса со спицами
Регистрировали импеданс и пульсовые волны кровенаполнения с помощью спиц 1 и 3 в полостях губчатой кости снаружи от проксимальной метаэпифизарной зоны роста бедренной кости, спиц 2 и 3 – в головке бедренной кости, спиц 4 и 5 – в крыше вертлужной впадины, спиц 4 и 6 – в параоссальных тканях над крышей вертлужной впадины, спиц 3 и 7 – в параоссальных тканях над проксимальным отделом бедренной кости. К внутрикостным тканям относили содержимое полостей губчатой кости, к параоссальным тканям – мягкие ткани над костью между участками спиц.
Исследования проводили с помощью полианализатора РГПА-6/12 «РЕАН-ПОЛИ» (МЕДИКОМ-МТД, Россия, г. Таганрог). Регистрировали одновременно электрокардиограмму (ЭКГ) во II стандартном отведении, базовый импеданс, объемные реовазограммы (РВГ) внутрикостных и параоссальных тканей и их первые производные. Сила тока 1,5 мА, частота 56 Гц, калибровочный сигнал 0,1 Ом.
В цифровом выражении выводили следующие параметры пульсовой волны [8]: 1) RR – длительность сердечного цикла; 2) БИ – базовый импеданс (эквивалент кровенаполнения); 3) ВБКН – время быстрого кровенаполнения пульсовой волны (раскрытия органной артерии). Чем выше тонус стенок, тем больше времени требуется для увеличения просвета артерии под пульсовым давлением крови; 4) ВМКН – время медленного кровенаполнения пульсовой волны (раскрытия внутриорганных артерий); 5) ВМСН – время максимального систолического кровенаполнения пульсовой волны (сумма ВБКН и ВМКН); 6) АБКН – амплитуда быстрого кровенаполнения пульсовой волны (эквивалент кровенаполнения органных артерий); 7) АМКН – амплитуда медленного кровенаполнения пульсовой волны (эквивалент кровенаполнения внутриорганных артерий); 8) РИ – реографический индекс (эквивалент кровенаполнения участка сосудистого русла); 9) ООП – относительный объемный пульс (эквивалент порции крови, обеспечивающей пульсовое кровенаполнение, РИ/БИ*1000); 10) СсБКН – средняя скорость быстрого кровенаполнения органных артерий, АБКН/ВБКН; 11) СсМКН – средняя скорость медленного кровенаполнения внутриорганных артерий, АМКН/ВМКН; 12) СсКН – средняя скорость кровенаполнения всех артерий участка тканей, РИ/ВМСН; 13) ППСС – показатель периферического сосудистого сопротивления (отношение амплитуды нижней точки инцизуры к АБКН); 14) ДКИ – показатель тонуса резистивных сосудов (отношение амплитуды нижней точки инцизуры к РИ); 15) ДСИ – диастолический индекс (показатель преобладания притока над оттоком крови, тонуса вен; отношение амплитуды дикротической волны к РИ).
Из количественных данных составляли невзвешенные вариационные ряды. Вычисляли М – среднее арифметическое значение вариационного ряда; σ – среднеквадратичное отклонение; m – ошибку среднего значения на основании n – количества наблюдений. Об отклонениях судили на основании статистически достоверных различий между средними, которые определяли с помощью непараметрического критерия Вилкоксона–Манна–Уитни для независимых выборок. Анализ проводили с помощью Мicrosoft Exсel 2013. Трактовка результатов осуществлялась на основании общепринятой методики расшифровки реовазограмм [9].
Результаты исследования и их обсуждение
У всех пациентов базовый импеданс (БИ) внутрикостных тканей всегда был меньше БИ параоссальных тканей (табл. 1).
Сопоставления не выявили статистически достоверных различий между параметрами пульсовой волны во внутрикостных тканях крыши вертлужной впадины и головки бедренной кости, головки бедренной кости и снаружи от метаэпифизарной зоны роста бедренной кости. В остальных случаях статистически достоверные различия между отдельными параметрами пульсовой волны имелись (табл. 2).
У детей до 6 лет, в отличие от всех пациентов, во внутрикостных тканях головки бедренных костей АБКН составляла 0,0059 ± 0,0012 Ом (57 %, p < 0,05), АМКН – 0,0079 ± 0,0022 Ом (56 %, p < 0,05), РИ – 0,0138 ± 0,0034 Ом (56 %, p < 0,05), СсБКН – 0,1155 ± 0,0286 Ом/с (57 %, p < 0,05), СсМКН – 0,1258 ± 0,0232 Ом/с (49 %, p < 0,05), СсКН – 0,1203 ± 0,0254 Ом/с (53 %, p < 0,05), ППСС – 107,0 ± 5,9 % (143 %, p < 0,05). В крыше вертлужных впадин ВМКН составляло 0,0425 ± 0,0023 с (85 %, p < 0,05), в параоссальных тканях крыши вертлужных впадин ДСИ составлял 26,9 ± 3,7 % (57 %, p < 0,05).
У детей к трехлетнему возрасту происходит регресс сосудистой системы хряща головки бедренной кости – восходящих метафизарных сосудов, дорсомедиальных эпифизарных сосудов и сосудов круглой связки [10]. Кровообращение в головке бедренной кости обеспечивают дорсолатеральные эпифизарные сосуды, кровоток по которым у пациентов с болезнью Пертеса нарушен [11, 12]. По данным I. Battory, причиной нарушений кровотока служит гипоплазия эпифизарных сосудов, следствием которой является латентная (клинически не проявляющаяся) недостаточность кровообращения [13]. Кроме гипоплазии сосудов, ограничению кровообращения способствуют аномалии сосудов конечности и ангиоспазм, выявленные с помощью селективной ангиографии, КТ и МРТ [6]. По мнению L.N. Craveiro, латентная ишемия растущего тазобедренного сустава – это отдельная патология, реализующаяся в остеохондропатию тазобедренного сустава [14].
Обследовали пациентов, у которых окклюзия участка сосудистого русла уже произошла и кровообращение в головке бедренной кости «стабилизировалось». Однако аномалия сосудов конечности осталась и поддерживала условия латентной ишемии. И, так как возможны разные аномалии сосудов, сравнивали результаты исследований пациентов определенного возраста или варианта патологии с совокупностью данных всех пациентов.
Таблица 1
Параметры пульсового кровенаполнения в компонентах тазобедренных суставов (n = 54)
|
№ |
Параметры |
Крыша вертлужной впадины |
Бедренная кость |
|||||||||||||
|
Внутрикостные ткани |
Параоссальные ткани |
Внутрикостные ткани головки |
Внутрикостные ткани зоны роста |
Параоссальные ткани |
||||||||||||
|
1 |
2 |
3 |
4 |
5 |
||||||||||||
|
1 |
БИ, Ом |
58,9 |
± |
5,9 |
90,1 |
± |
9,1 |
68,7 |
± |
5,6 |
70,8 |
± |
4,9 |
101,1 |
± |
5,3 |
|
2 |
RR, с |
0,5403 |
± |
0,0123 |
0,5403 |
± |
0,0123 |
0,5419 |
± |
0,0117 |
0,5497 |
± |
0,0108 |
0,5497 |
± |
0,0082 |
|
3 |
ВБКН, с |
0,0491 |
± |
0,0008 |
0,0497 |
± |
0,0008 |
0,0505 |
± |
0,0010 |
0,0518 |
± |
0,0009 |
0,0537 |
± |
0,0012 |
|
4 |
ВМКН, с |
0,0498 |
± |
0,0020 |
0,0471 |
± |
0,0016 |
0,0566 |
± |
0,0032 |
0,0598 |
± |
0,0020 |
0,0616 |
± |
0,0018 |
|
5 |
ВМСН, с |
0,0990 |
± |
0,0023 |
0,0968 |
± |
0,0019 |
0,1071 |
± |
0,0038 |
0,1116 |
± |
0,0025 |
0,1153 |
± |
0,0024 |
|
6 |
АБКН, Ом |
0,0105 |
± |
0,0015 |
0,0185 |
± |
0,0029 |
0,0104 |
± |
0,0017 |
0,0130 |
± |
0,0022 |
0,0161 |
± |
0,0013 |
|
7 |
АМКН, Ом |
0,0141 |
± |
0,0016 |
0,0181 |
± |
0,0024 |
0,0140 |
± |
0,0019 |
0,0154 |
± |
0,0017 |
0,0230 |
± |
0,0020 |
|
8 |
РИ, Ом |
0,0246 |
± |
0,0030 |
0,0366 |
± |
0,0048 |
0,0245 |
± |
0,0035 |
0,0284 |
± |
0,0034 |
0,0391 |
± |
0,0029 |
|
9 |
ООП, Ом |
0,5022 |
± |
0,0543 |
0,4046 |
± |
0,0436 |
0,3687 |
± |
0,0657 |
0,4059 |
± |
0,0381 |
0,4060 |
± |
0,0324 |
|
10 |
СсБКН, Ом/с |
0,2122 |
± |
0,0299 |
0,3848 |
± |
0,0640 |
0,2026 |
± |
0,0317 |
0,2514 |
± |
0,0425 |
0,2955 |
± |
0,0219 |
|
11 |
СсМКН, Ом/с |
0,2819 |
± |
0,0289 |
0,3940 |
± |
0,0543 |
0,2567 |
± |
0,0372 |
0,2676 |
± |
0,0370 |
0,3922 |
± |
0,0394 |
|
11 |
СсКН, Ом/с |
0,2440 |
± |
0,0271 |
0,3877 |
± |
0,0537 |
0,2291 |
± |
0,0335 |
0,2579 |
± |
0,0323 |
0,3032 |
± |
0,0258 |
|
13 |
ППСС, % |
78,1 |
± |
5,5 |
77,4 |
± |
9,7 |
74,6 |
± |
7,3 |
89,1 |
± |
2,5 |
74,3 |
± |
2,7 |
|
14 |
ДКИ, % |
55,7 |
± |
8,2 |
40,6 |
± |
6,0 |
46,1 |
± |
6,2 |
52,0 |
± |
3,6 |
49,2 |
± |
4,3 |
|
14 |
ДСИ, % |
51,7 |
± |
4,9 |
47,5 |
± |
7,2 |
58,6 |
± |
5,8 |
65,5 |
± |
4,7 |
56,5 |
± |
6,2 |
Таблица 2
Уровень статистической значимости различий между параметрами пульсового кровенаполнения у совокупности пациентов с болезнью Пертеса
|
№ |
Параметры |
Внутрикостные ткани зоны роста / крыши вертлужной впадины |
Крыша вертлужной впадины, внутрикостные/ параоссальные ткани |
Головка бедренной ости, внутрикостные / параоссальные ткани |
Зона роста бедренной кости, внутрикостные / параоссальные ткани |
Параоссальные ткани бедренной кости / крыши вертлужной впадины |
|||||
|
1 |
2 |
3 |
4 |
5 |
|||||||
|
p< |
% |
p< |
% |
p< |
% |
p< |
% |
p< |
% |
||
|
1 |
БИ, Ом |
120 |
0,01 |
65 |
0,001 |
68 |
70 |
112 |
|||
|
2 |
RR, с |
102 |
100 |
99 |
100 |
102 |
|||||
|
3 |
ВБКН, с |
0,05 |
105 |
99 |
0,05 |
94 |
96 |
0,01 |
108 |
||
|
4 |
ВМКН, с |
0,001 |
120 |
106 |
92 |
97 |
0,01 |
131 |
|||
|
5 |
ВМСН, с |
0,001 |
113 |
102 |
93 |
97 |
0,01 |
119 |
|||
|
6 |
АБКН, Ом |
124 |
0,05 |
57 |
0,01 |
65 |
81 |
87 |
|||
|
7 |
АМКН, Ом |
109 |
78 |
0,01 |
61 |
0,05 |
67 |
127 |
|||
|
8 |
РИ, Ом |
116 |
0,05 |
67 |
0,01 |
63 |
0,05 |
73 |
107 |
||
|
9 |
ООП, 1/000 |
81 |
124 |
91 |
100 |
100 |
|||||
|
10 |
СсБКН, Ом/с |
118 |
0,05 |
55 |
0,05 |
69 |
85 |
77 |
|||
|
11 |
СсМКН, м/с |
95 |
72 |
0,05 |
65 |
0,05 |
68 |
100 |
|||
|
12 |
СсКН, Ом/с |
106 |
0,05 |
63 |
0,05 |
67 |
0,05 |
75 |
89 |
||
|
13 |
ППСС, % |
0,01 |
124 |
93 |
100 |
0,001 |
120 |
96 |
|||
|
14 |
ДКИ, % |
93 |
137 |
94 |
106 |
121 |
|||||
|
15 |
ДСИ, % |
0,01 |
127 |
109 |
104 |
116 |
119 |
||||
Условия наркоза исключали перераспределение кровообращения вследствие функциональных нагрузок, поэтому доверительные интервалы считали диапазоном изменений параметров пульсовой волны в покое. Пульсовые волны регистрировали одновременно в параоссальных и внутрикостных тканях, вследствие чего статистически достоверные различия между их величинами относили к показателю различия пульсового кровенаполнения.
Зондирующий электрический ток замыкается от спицы к гематоме вокруг спицы, далее по крови (электролиту), наполняющей микроциркуляторное русло и внутриорганные артерии, к просвету органной артерии и в обратном порядке – ко второй спице. Замыкание происходит преимущественно по сосудам, оказывающим наименьшее сопротивление зондирующему току, – наиболее наполненным кровью. Поэтому необходимым условием проведения исследований внутрикостных тканей было снижение сопротивления их сосудов электрическому току, что создавали уменьшением расстояния между концами спиц в кости и подтверждали снижением базового импеданса (БИ) внутрикостных тканей относительно БИ параоссальных тканей.
У совокупности пациентов тонус органной и внутриорганных артерий параоссальных тканей проксимального отдела бедренных костей был выше, чем параоссальных тканей крыши вертлужных впадин. Однако параметры пульсового кровенаполнения тканей не имели статистически достоверных различий. Статистически достоверное повышение тонуса стенок артерии оценивали как показатель окклюзии артерии. Вероятно, были окклюзированы органная (ветвь магистральной артерии) и часть внутриорганных артерий параоссальных тканей проксимального отдела бедренных костей при компенсации недостаточности кровообращения за счет сосудистых взаимосвязей – путей коллатерального тока крови.
Не выявлены статистически достоверные различия между параметрами пульсовой волны во внутрикостных тканях крыши вертлужной впадины и головки бедренных костей, головки бедренных костей и снаружи от метаэпифизарной зоны роста бедренных костей. Однако во внутрикостных тканях снаружи от метаэпифизарной зоны роста бедренных костей тонус стенок органной и внутриорганных артерий, а также периферическое сосудистое сопротивление были выше и отток крови затруднен относительно величин во внутрикостных тканях крыши вертлужной впадины. Вероятно, из-за окклюзии артерий параоссальных тканей проксимального отдела бедренных костей приток крови к внутрикостным тканям снаружи от метаэпифизарной зоны роста бедренных костей был снижен. Из этого следует, что из-за окклюзии/аномалии сосудов вероятность возрастных изменений проксимального отдела бедренных костей выше, чем крыши вертлужных впадин.
У всех пациентов во всех компонентах тазобедренных суставов выявлено статистически достоверное снижение пульсового кровенаполнения (РИ) и скорости пульсового кровенаполнения (СсКН) во внутрикостных тканях относительно соответствующих параоссальных тканей. Однако во внутрикостных тканях крыши вертлужных впадин причиной было ограничение пульсового кровенаполнения в органной артерии, во внутрикостных тканях снаружи от метаэпифизарной зоны роста – внутриорганных артерий одновременно с повышением периферического сосудистого сопротивления, в головке бедренных костей – органных и внутриорганных артерий. Вероятно, причинами были аномалии сосудистого русла конечности, продолжающие оказывать влияние на кровообращение в компонентах тазобедренных суставов.
Таким образом, при болезни Пертеса после появления изменений в головке бедренных костей аномалия сосудов конечности продолжает оказывать влияние на пульсовое кровенаполнение тканей компонентов тазобедренного сустава.
У пациентов до 6 лет относительно совокупных данных всех пациентов выявлено снижение пульсового кровенаполнения, а также скорости пульсового кровенаполнения только во внутрикостных тканях головки бедренных костей. Выявлены также снижение тонуса стенок внутриорганных артерий внутрикостных тканей крыши вертлужных впадин и сопротивление оттоку крови в параоссальных тканях вертлужных впадин.
На основании снижения тонуса стенок внутриорганных артерий приток крови к внутрикостным тканям крыши вертлужных впадин был увеличен, но отток крови от этих тканей в вены параоссальных тканей снижен. Из этого следует, что у пациентов функционировали артерии круглой связки головки бедренной кости и кровь из внутриорганных артерий внутрикостных тканей крыши вертлужных впадин поступала в головку бедренных костей.
На основании снижения пульсового кровенаполнения в головке бедренных костей можно заключить, что, вероятно, у пациентов этой возрастной группы аномалии сосудов конечности оказывали влияние только на кровообращение в головке бедренных костей. Из этого следует, что в данной возрастной группе пациентов вероятны ограничения интенсивности регенерации тканей только в головке бедренных костей, изменения проксимального отдела бедренных костей маловероятны.
Заключение
Исследования показали, что при болезни Пертеса после окклюзии участка сосудистого русла головки бедренных костей аномалии сосудистого русла конечности, являющиеся одной из причин развития заболевания, продолжают оказывать влияние и ограничивают кровообращение в компонентах тазобедренного сустава. У детей до 6 лет артерии круглой связки головки бедренных костей могут участвовать в компенсации недостаточности кровообращения в головке бедренных костей. В возрастной группе детей до 6 лет влияние аномалии сосудистого русла конечности ограничивается головкой бедренной кости, выражается ишемией внутрикостных тканей, вследствие которой возможны ограничения интенсивности регенерации тканей.

