Снижение спонтанной активности у пациентов с поражениями головного мозга в значительной степени затрудняет процесс их реабилитации, вплоть до полной блокировки восстановительного процесса. На фоне выраженной аспонтанности пациент может выполнить движение, непроизвольно повторив его вслед за инструктором, однако не имеет собственного побудительного механизма для произвольного совершения движения.
Произвольные движения человека реализуются благодаря взаимодействию различных структур мозга, которые вносят свой специфический вклад в построение движения. Поражение любой из мозговых структур, объединенных в сложную функциональную систему, приводит к нарушению нормальной организации двигательного акта.
При исследовании функции произвольного движения наиболее эффективными являются анализ генерализованных и длительных изменений биоэлектрической активности мозга по данным суммарной ЭЭГ [1, 2] и сопоставление их с параметрами фМРТ при выполнении двигательной задачи [3, 4], а также анализ кратковременных сдвигов биопотенциалов, возникающих в мозге человека за несколько секунд до начала движения и непосредственно в момент его реализации – потенциалы мозга, связанные с движением [5] (или «связанные с движением потенциалы мозга» – СДПМ).
В структуре потенциалов мозга, связанных с движением (movement-related cortical potentials), еще в 1964 г. Kornhuber Н. и Deecke L. была описана медленно развивающаяся негативная волна, максимально представленная в центральных и теменных областях мозга перед началом произвольного движения – потенциал готовности (ПГ) или Bereitschaftpotential (BP). Позже выявлен комплекс негативно-позитивных колебаний, которые предшествуют движению – ранние преддвигательные компоненты (преддвигательная позитивность, моторный потенциал) и постдвигательные компоненты, возникающие в процессе реализации движения (негативный фронтальный пик, постдвигательная позитивность, потенциал реафферентации) [5, 6]. Компоненты СДПМ являются электрографическими маркерами корково-подкоркового взаимодействия мозговых структур в процессе подготовки и реализации движения [7–9].
Потенциал готовности, формирующийся за несколько секунд до начала выполнения произвольного движения, является электрографическим эквивалентом процесса формирования моторной программы и исследуется в комплексе с анализом ЭЭГ и ЭМГ активности предшествующей движению [10, 11]. Уровень мотивации, готовность к произвольному выполнению движения, скорость движения [6, 12, 13], сложность реализации моторной задачи [14] отражаются в амплитудно-временных параметрах ПГ. Можно предположить, что, в совокупности с другими преддвигательными компонентами СДПМ, он может рассматриваться как электрофизиологический коррелят спонтанности при выполнении двигательной задачи.
Основываясь на том положении, что в компонентах СДПМ отражаются разные фазы как подготовительных процессов, так и процессов, связанных с реализацией двигательных команд и последующей корректировкой моторной задачи, естественно предположить, что нарушение эфферентного или афферентного звена в системе организации произвольного движения отражается в изменениях формы и фаз СДПМ.
Цель настоящего исследования состояла в выявлении особенностей СДПМ при поражении коркового уровня двигательного анализатора у больных с односторонним поражением (опухоль) теменных и центральных областей мозга, сопровождавшимся клиническими признаками нарушения эфферентной или афферентной составляющих движения.
Материалы и методы исследования
Методика исследования была описана в нашей публикации [8]. Регистрация СДПМ проводилась от теменных (Р3, Р4) и центральных (С3, С4) областей мозга. Расположение электродов согласно международной системе 10–20 %, референтные электроды – на мочках ушей. Записывались СДПМ при ритмичном сжимании эспандера в произвольном темпе, но не чаще 1 раза в 5–6 с, одновременно регистрировалась ЭМГ-активность от мышц руки, сжимающей эспандер. Осуществлялась суммация и усреднение СДПМ и ЭМГ «работающей» руки, эпоха анализа 5 с (3 с до и 2 с после запускающего стимула, которым служило замыкание контакта при сжимании эспандера). Время появления компонентов СДПМ вычислялось относительно пика усредненной ЭМГ. Амплитуда первого негативного компонента (N1) – потенциала готовности определялась от момента стабильного подъема до его максимума, амплитуда остальных компонентов подсчитывалась от пика до пика. Анализу подвергались преддвигательные компоненты СДПМ, возникающие до пика усредненной ЭМГ (N1, Р1, N2), которые являются электрофизиологическими коррелятами процесса подготовки (формирование моторной задачи) и запуска движения, а также постдвигательные компоненты, возникающие после пика усредненной ЭМГ (P2 и N3), являющиеся электрофизиологическими коррелятами процесса реализации и завершения движения.
СДПМ исследовались у 25 здоровых испытуемых (добровольцев) в возрасте 26–47 лет (средний возраст 36 лет) и у 34 больных с опухолью мозга теменно-центральной локализации (16 мужчин и 18 женщин в возрасте 28–67 лет, средний возраст – 47,5 лет). У 27 человек опухоль располагалась конвекситально и у 7 пациентов – внутримозговое расположение патологического процесса, у 14 больных опухоль располагалась в правом и у 20 больных – в левом полушарии. Локализация патологического процесса верифицирована на операции. Регистрация СДПМ у больных проводилась на этапе дооперационного обследования. По данным неврологического осмотра у всех пациентов выявлены нарушения в двигательной сфере: у 18 больных (1-я группа) определялся симптомокомплекс характерный для нарушения эфферентного, и у 16 больных (2-я группа) – афферентного звена двигательной системы.
Результаты исследования и их обсуждение
У здоровых испытуемых в центральных и теменных областях обоих полушарий, как правило, симметрично регистрируется медленное негативное колебание, начинающееся за 900–1400 мс до пика ЭМГ, амплитудой 9–12 мкВ – потенциал готовности (компонент N1) (рис. 1).
В период нарастания мышечной активности за 150–160 мс до пика ЭМГ регистрируется низкоамплитудное позитивное колебание (Р1) и за 120–130 мс начинает формироваться негативный компонент N2, достигающий максимума примерно за 40–90 мс до пика ЭМГ, имеющий амплитуду 5–7 мкВ. Компоненты Р1 и N2 регистрируются билатерально с преобладанием по амплитуде в полушарии контралатеральном по отношению к «работающей» руке. На фоне снижения амплитуды усредненной ЭМГ возникает позитивное колебание Р2, амплитудой 10–13,5 мкВ, достигающее максимума через 200–400 мс после пика усредненной ЭМГ. Зарегистрирован также медленный негативный компонент N3, появляющийся через 600–800 мс после пика усредненной ЭМГ и достигающий максимума (10–14 мкВ) после завершения ЭМГ-активности. Значимые межполушарные различия компонентов СДПМ в полушарии контралатеральном и ипсилатеральном по отношению к «работающей» руке не выявлены.
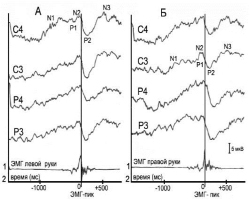
Рис. 1. СДПМ здорового испытуемого, зарегистрированные от теменных (Р4, Р3) и центральных (С4, С3) областей мозга при сжимании эспандера левой (А) и правой (Б) рукой; 1 – усредненная ЭМГ «работающей» руки; 2 – время возникновения компонентов вызванного ответа в мс; N1, P1, N2 – преддвигательные компоненты СДПМ; Р2, N 3 – постдвигательные компоненты
Компонентный состав и амплитудно-временные параметры потенциалов мозга, возникающие при совершении произвольного движения, описаны в литературе достаточно четко, несмотря на некоторые отличия в терминологии, вариативности параметров и интерпретации данных, что, по-видимому, обусловлено различием методик исследования. Показано, что в преддвигательных компонентах потенциалов мозга, связанных с движением, находят отражение процессы формирования моторной программы, подготовки и запуска движения [6, 13]. Учитывая зависимость параметров ПГ от уровня мотивации, готовности к выполнению произвольного действия, скорости выполнения движения [6, 12, 13], в нашем исследовании был сделан акцент на анализе ранних преддвигательных компонентов СДПМ (N1 и N2) для оценки возможности использовать данные электрографические феномены в качестве электрофизиологических коррелятов спонтанности. Мы рассматриваем компоненты N1 и N2 как раннюю и позднюю фазы одной волны – потенциала готовности, отражающие процессы, происходящие на разных уровнях мозга в период подготовки движения. Мы полагаем, что генез компонента N2 связан с активностью коры. Для исследования данного предположения мы провели исследование СДПМ у пациентов с поражением коркового уровня двигательного анализатора.
У пациентов с эфферентными нарушениями в двигательной сфере (18 человек – группа 1) отмечены резкие, по сравнению с нормой, нарушения СДПМ, особенно на стороне патологического процесса при движении контралатеральной рукой. Это выражалось в снижении амплитуды (на 2,8–4,5 мкВ) и увеличении времени до пика усредненной ЭМГ (на 300–400 мс) компонента N1. Компонент N2 у 12 больных отсутствовал, а в остальных случаях (6 пациентов) отмечалось резкое снижение его амплитуды (на 2,0–3,7 мкВ) (рис. 2).
Постдвигательные компоненты СДПМ также были значительно изменены: выявлялось снижение амплитуды компонента Р2 на 2,5–4,0 мкВ и компонента N3 на 2,0–5,0 мкВ и увеличение времени после пика усредненной ЭМГ до достижения максимума компонента Р2 на 100–250 мс и N3 на 150–350 мс. У пациентов данной группы при неврологическом обследовании было отмечено повышение мышечного тонуса в руке, контралатеральной патологическому процессу, что электрографически выражалось увеличением длительности усредненной ЭМГ до и после пика и коррелировало с увеличением временных параметров компонентов N1, Р2 и N3.
СДПМ, зарегистрированные на стороне патологического процесса при движении ипсилатеральной рукой, отличались значительным снижением амплитуды компонентов N1 (на 2,5–3 мкВ) и N2 (на 1,7–3,5 мкВ), амплитудно-временные параметры остальных компонентов двигательного ответа были близки к норме. СДПМ, зарегистрированные в интактном полушарии, практически не изменены.
У пациентов с афферентными нарушениями в двигательной сфере (16 человек – группа 2) отмечены менее выраженные изменения СДПМ. Амплитудно-временные параметры компонентов двигательного ответа на стороне патологического процесса при движении контралатеральной рукой хотя и отличаются от нормативных данных, однако в значительно меньшей степени выражены, чем у больных 1-й группы (рис. 3).
По сравнению с нормой амплитуда компонента N1 в среднем снижена на 1,4–2,7 мкВ, а время до пика усредненной ЭМГ увеличено на 150–270 мс; амплитуда компонента N2 снижена на 2,0–3,5 мкВ. Время после пика усредненной ЭМГ до достижения максимума компонента Р2 увеличено на 30–120 мс и N3 на 80–200 мс, амплитуды компонентов Р2 и N3 снижены соответственно на 1,5–2,5 мкВ и 1,2–3,3 мкВ.
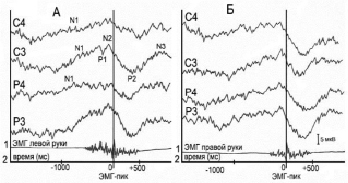
Рис. 2. СДПМ пациента П. Ds.: менингеома заднелобной области правого полушария, по данным неврологического осмотра эфферентные нарушения в двигательной сфере (группа пациентов 1). Обозначения те же, что на рис. 1
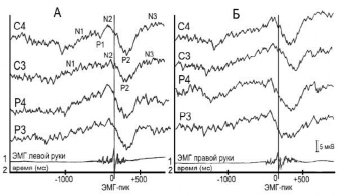
Рис. 3. СДПМ пациента В. Ds.: менингеома теменно-височной области левого полушария, по данным неврологического осмотра афферентные нарушения в двигательной сфере (группа пациентов 2). Обозначения те же, что на рис. 1
На стороне локализации опухоли, при движении ипсилатеральной рукой, отмечено преимущественное снижение амплитуды компонента N2, амплитудно-временные параметры остальных компонентов двигательного ответа были близки к норме. СДПМ, зарегистрированные в интактном полушарии, не отличались от нормативных данных.
Таким образом, у больных с очаговыми поражениями мозга теменно-центральной локализации отмечалось асимметричное нарушение двигательных потенциалов, наиболее выраженные изменения СДПМ выявлялись на стороне патологического процесса при движении контралатеральной рукой. Сходные по характеру изменения амплитудно-временных параметров компонента N2 у пациентов обеих групп, особенно отсутствие данного компонента в 2/3 случаев у пациентов 1-й группы, подтверждают положение о том, что его генез связан с активностью коры. Это также согласуется с данными, полученными нами ранее [15] – в структуре СДПМ при регистрации ответов с помощью электродов, имплантированных в ядра таламуса и мозжечка у пациентов с нарушением функции подкорковых двигательных структур (паркинсонизм) и ДЦП, компонент N2 отсутствовал. Относительно генеза ПГ имеются достаточно убедительные литературные данные о наличии не только корковых, но и субкортикальных его генераторов (заднелатеральное ядро таламуса, бледный шар, скорлупа, головка хвостатого ядра [7, 9, 15]. В исследованиях H. Shibasaki, M. Hallett [6] было показано разделение ПГ на раннюю и позднюю фазы. Формирование ранней фазы сопровождалось билатеральной активацией первичной двигательной, латеральной премоторной и дополнительной моторной коры. При формировании поздней фазы выявлялась активация первичной двигательной и премоторной коры преимущественно на стороне контралатеральной двигающейся конечности. Нарушение параметров компонентов N1 (ранней фазы ПГ) и N2 (поздней фазы ПГ) у обследованных нами больных обеих групп отражает изменение функционального состояния соответствующих структур коры головного мозга и согласуется с данными вышеуказанных исследований о генераторах преддвигательных компонентов СДПМ.
Выводы
1. При очаговых поражениях мозга теменно-центральной локализации выявляются асимметричные нарушения СДПМ; наиболее измененные ответы регистрируются на стороне патологического процесса при движении контралатеральной рукой.
2. Изменения СДПМ зависят от характера нарушения двигательной функции с большей выраженностью при поражении эфферентного звена двигательной системы.
3. Наиболее грубые изменения параметров компонента N2, вплоть до полной его редукции, при очаговых поражениях мозга теменно-центральной локализации подтверждают положение о том, что его генез обусловлен активностью коры.
4. При очаговых поражениях мозга теменно-центральной локализации выявляются изменения преддвигательных компонентов СДПМ (N1 – ранняя и N2 – поздняя фаза потенциала готовности), являющихся электрофизиологическим отражением процессов подготовки (формирование моторной программы) и запуска движения.
5. Преддвигательные компоненты СДПМ, как электрофизиологический эквивалент формирования моторной программы при совершении произвольного движения, могут рассматриваться в качестве электрографических коррелятов спонтанности.
Работа выполнена при поддержке гранта РФФИ 19-29-01002 мк.

