Регенерация тканей является предметом изучения исследователей теоретических и клинических дисциплин, которые внесли значительный вклад в понимание механизмов восстановления тканей после повреждения. Большой вклад в изучение проблемы регенерации тканей с гистогенетических позиций внесли профессора А.А. Заварзин, Н.Г. Хлопин, С.И. Щелкунов, А.А. Клишов и другие.
Фундаментальные работы профессоров Н.Н. Аничкова, И.В. Давыдовского, С.С. Гирголава, Д.С. Саркисова, И.А. Ерюхина, Ю.Г. Шапошникова и других являются настольными книгами для исследователей, занимающихся проблемами регенерации тканей.
Несмотря на имеющиеся достижения, остаются недостаточно изученными теоретические вопросы посттравматического гистогенеза тканей кожи при различных видах механического повреждения, в том числе и огнестрельном ранении [1].
Огнестрельное повреждение включает разные факторы воздействия: механическое, термическое, химическое действие пороховых газов, микробное обсеменение и др. Каждый из этих факторов вносит свой вклад в общую картину огнестрельного повреждения тканей [1].
При этом представляет интерес исследование влияния каждого из перечисленных факторов в отдельности, в последние годы большое внимание уделяется кинетической составляющей повреждающего агента. Это связано с тем, что при огнестрельном ранении кинетическая составляющая формирует зону «молекулярного сотрясения».
Особенность гистологической картины в зоне «молекулярного сотрясения» заключается в индивидуальном характере клеточных и тканевых реакций, возникновении различных форм гибели клеток, которые наблюдаются даже при заживлении ран, резкие расстройства гемомикроциркуляции, изменение клеточного состава в процессе заживления ран вследствие формирования органо-тканевого комплекса – грануляционной ткани.
Диагностика распространения зоны «молекулярного сотрясения» необходима для выбора методов хирургической обработки и предотвращения отсроченной гибели тканевых элементов, приводящей к осложнению в раневом процессе.
Цель исследования: выявить морфофункциональные свойства клеток и тканей на этапах заживления кожной раны в зоне «молекулярного сотрясения» с позиции концепции о функциональных гистионах.
Материалы и методы исследования
На первом этапе исследования была разработана экспериментальная модель повреждения, стандартизированная по исполнению для получения репрезентативных данных. Это необходимо для количественной оценки гистологических изменений в тканевых элементах [1–3].
В 1-й серии экспериментов были использованы белые мыши массой 20–30 граммов. В межлопаточную область спины животным наносили сквозное ранение кожи пробойником диаметром 3 мм. Кинетическая энергия, прикладываемая к нему, соответствовала энергии, возникающей при выстреле из пневматической винтовки.
Во 2-й серии экспериментов были использованы белые беспородные крысы массой 200–300 граммов. Для нанесения механической травмы была использована установка по передаче кинетической энергии окружающим раневой канал тканям. Подопытным животным в область голени наносили механическую травму, эквивалентную по энергии удару пули калибром 5,6 мм.
Материалом для исследования регенерационных процессов явились ткани различного генеза кожи крыс и мышей. Сроки фиксации были выбраны с учетом ранее изученных гистологических изменений при нанесении различных видов повреждений подопытным животным (через 6 часов, 24 часа, на 3, 6, 15 и 25-е сутки после повреждения).
Для характеристики реактивных изменений клеток и тканей был использован следующий комплекс гистологических исследований: световая и электронная микроскопии; процессы пролиферации регистрировали методом одноволновой цитоспектрофотометрии с помощью прибора, созданного на кафедре. Процессы дифференциации и синтеза биологически активных веществ выявляли цитохимическими методами. Иммуногистохимически выявляли антиген ядерной пролиферации, позволяющий идентифицировать клетки в синтетическом периоде митотического цикла. Морфометрическими методами регистрировали количественные и качественные изменения гистологических элементов, проводили статистическую обработку результатов, а также применяли математическое моделирование для описания индивидуального характера течения клеточных реакций в процессе заживления ран [1].
Гистогенетический подход предполагает изучение состояния тканей в норме, т.е. до нанесения повреждения, считая это «нулевой» фазой регенерации [1].
Указанный комплекс гистологических исследований для изучения каждой фазы регенерации тканей кожи позволит оценить гетероморфию клеточных элементов: внутридифферонную и междифферонную. Междифферонная гетероморфия определяется на межтканевом уровне взаимодействии при регенерации органа, формируется т.н. функциональный гистион [1].
Результаты исследования и их обсуждение
Оценка фазности течения регенерационного процесса и характеристика реактивных изменений клеток и тканей в раневом процессе основывались на установленных гистогенетических закономерностях «нулевой» фазы регенерации.
После нанесения повреждения кожи, в 1-е сутки, отмечаются изменения в нейтрофильных лейкоцитах периферической крови в количественном и качественном эквиваленте. Данные изменения наблюдаются в процессах дифференциации и синтеза биологически активных веществ – неферментативных катионных белков. Это свидетельствует о фазе воспалительной реакции в разворачивающемся регенерационном процессе (рис. 1).
К концу первых суток эксперимента устанавливается гетероморфия в популяции нейтрофилов по активности катионных белков. Отмечается повышение количества нейтрофилов периферической крови с высокой активностью катионных белков и понижение числа клеток со слабой и умеренной активностью катионных белков. Отмечается снижение концентрации катионных белков в нейтрофильных гранулоцитах к 3-м суткам опыта и дальнейшее нарастание концентрации катионного белка к 25-м суткам регенерации, что отражает снижение внутридифферонной гетероморфии.
У экспериментальных животных после нанесения механической травмы с передачей кинетической энергии, эквивалентной огнестрельному ранению, формировалась «зона молекулярного сотрясения». Особенность гистологической картины в зоне «молекулярного сотрясения» заключается в индивидуальном характере клеточных и тканевых реакций, возникновении различных форм гибели клеток, которые наблюдаются даже при заживлении ран, в резких расстройствах гемомикроциркуляции, изменении клеточного состава в процессе заживления раны вследствие формирования органо-тканевого комплекса – грануляционной ткани.
К 3-м суткам эксперимента появляются реактивные изменения в виде мгновенной и ранней отсроченной гибели клеток практически всех тканевых элементов кожи, что обуславливает снижение внутри- и междифферонной гетероморфии. Это сигнализирует о начале фазы ранних посттравматических изменений.
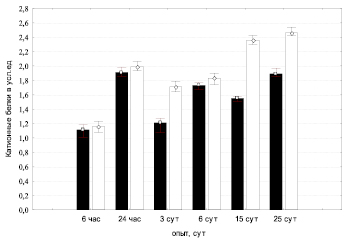
Рис. 1. Профиль катионных белков периферической крови в нейтрофильных лейкоцитах. Обозначения: белый – палочкоядерные нейтрофилы; черный – сегментоядерные нейтрофилы
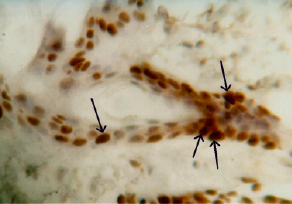
Рис. 2. Реакция на PCNA в ядрах эпителиоцитов волосяного фолликула. 3-и сутки. X 252
Миграция гематогенных клеточных элементов (лейкоцитов, тканевых базофилов, макрофагов) в «зону молекулярного сотрясения» как следствие начала формирования лейкоцитарного вала и постепенного увеличения междифферонной гетероморфии. Однако с междифферонной гетероморфией можно наблюдать и внутридифферонную гетероморфию при формировании функционального гистиона воспаления, представляющего собой кооперацию эндотелиоцитов, нейтрофильных лейкоцитов, тканевых базофилов. Появление макрофагов является дальнейшим развитием грануляционной ткани.
Гистологическим маркером перехода от фазы воспаления к фазе регенерации является увеличение клеток, экспрессирующих ген ядерной пролиферации (PCNA). Ведущими гистологическими элементами с 3-х суток эксперимента становятся клетки, вступающие в митотический цикл. В эпителиальной ткани кожи это не только кератиноциты росткового слоя эпидермиса, но и кератиноциты наружных волосяных влагалищ, сохранивших жизнеспособность (рис. 2).
Иммуногистохимически выявлен антиген ядерной пролиферации в составе эпителиального регенерата. В соединительных тканях кожи активация пролиферации отмечается в: периваскулярных клетках, фибробластах дермы и эндомизии подкожной мышцы.
Индекс пролиферации с 3-х по 15-е сутки в «зоне молекулярного сотрясения» снижается, что доказывается изменением количественного содержания ДНК в ядрах фибробластов при исследовании методом цитоспектрофотометрии.
В фазе дифференцировки тканевых элементов происходит постепенное образование регенерата, являющегося очередной фазой регенерационного гистогенеза. Гистологическим критерием этой фазы является формирование особой органо-тканевой структуры – грануляционной ткани. Отмечается увеличение степени междифферонной гетероморфии, с преобладанием клеточных элементов рыхлой волокнистой соединительной ткани и дифферона эндотелиоцитов.
Гистологическим показателем фазы дифференцировки является возрастание внутридифферонной и междифферонной гетероморфии тканевых элементов в соединительных тканях кожи. В регенерационном гистионе ведущими гистологическими элементами являются фибробласты, эндотелиоциты и макрофаги.
К 25-м суткам эксперимента междифферонная гетероморфия регенерата снижается медленно и длительное время остается на достаточно высоком уровне. В гистионе адаптивной фазы регенерационного гистогенеза гистологическими ведущими элементами являются фиброциты.
Характеристика изменения клеточного состава функциональных гистионов служит надежным диагностическим критерием и является показателем последовательности течения регенерационного процесса. На основе гистологического исследования клеточного состава функциональных гистионов с целью математического моделирования формирования функциональных гистионов грануляционной ткани были включены клетки пяти клеточных дифферонов: нейтрофильные лейкоциты, тканевые базофилы, макрофаги, клетки фибробластического дифферона и эндотелиоциты. Выстроенная математическая модель регенерационного процесса тканей кожи выявляет временные особенности индивидуального изменения клеточного состава функциональных гистионов регенерата.
Заключение
Реактивные изменения клеток и тканей в раневом процессе базируются на закономерностях эмбрионального и постэмбрионального гистогенеза. Эти характеристики включают активацию и пролиферацию малодифференцированных клеток, их дифференциацию и взаимодействие с последующей адаптивной перестройкой регенерата [4; 5]. Для каждой фазы регенерации тканей кожи характерна гетероморфия клеточных элементов: внутридифферонная и междифферонная. Междифферонная гетероморфия определяется на межтканевом уровне взаимодействии при регенерации органа, формируется т.н. функциональный гистион. На основе гистологического исследования клеточного состава функциональных гистионов с целью математического моделирования формирования функциональных гистионов грануляционной ткани были включены клетки пяти клеточных дифферонов: нейтрофильные лейкоциты, тканевые базофилы, макрофаги, клетки фибробластического дифферона и эндотелиоциы [5]. Диагностика распространения зоны «молекулярного сотрясения» необходима для выбора методов хирургической обработки и предотвращения отсроченной гибели тканевых элементов, приводящей к осложнению в раневом процессе [1; 2; 5].

