Молекулярные свойства все больше привлекают к себе внимание при диагностике новообразований, постепенно переходя из разряда фундаментально-научных изысканий в практическую плоскость. Непосредственным отражением данного процесса являются современные классификации ВОЗ опухолей различных локализаций, в том числе опухолей центральной нервной системы (ЦНС). В частности, это касается и одной из самых часто встречающихся категорий новообразований данной области – диффузных глиальных опухолей [1]. В рамках существующей классификации 2016 г. выделен ряд молекулярных факторов, имеющих принципиальное диагностическое значение и включенных в названия и определения нозологических форм [2].
В предшествующих работах нами проведено исследование по участию атипических изоформ протеинкиназы C, в частности протеинкиназы Mζ (ПК Mζ) и протеинкиназа С iota (ПК Ci), в патогенезе диффузных глиом. Более того, мы также охарактеризовали особенности влияния данных факторов на прогноз пациентов с данными нозологиями [3]. Данные протеинкиназы характеризуются тем, что не требуют для своей активации ни Ca2+, ни диацилглицерола [4]. Притом рассматриваемые протеинкиназы характеризуются более высокой каталитической активностью, являются абсолютно мозгоспецифичными и обладают свойством самоподдержания собственной активности, что дает возможность автономного функционирования данных протеинкиназ [5].
Ранее мы подробно охарактеризовали экспрессию ПК Mζ и ПК Ci в диффузных астроцитомах (ДА), анапластических астроцитомах (АА) и глиобластомах (ГБ), установив взаимосвязь с наличием одного из ключевых молекулярно-генетических событий в данных новообразованиях в виде мутации в генах IDH1 и IDH2. Тем не менее помимо мутаций в генах IDH1 и IDH2 существуют и другие важные молекулярные события в диффузных глиомах, которые либо включены в классификацию ВОЗ, либо упоминаются в ней и обладают выраженной прогностической ценностью, в частности ко-делеция 1p/19q и метилирование промотера гена MGMT. Ко-делеция участков хромосом 1p/19q является своего рода диагностическим маркером, указывающим на две родственные в гистогенетическом плане формы новообразований, получивших название олигодендроглиомы и анапластические олигодендроглиомы. Наличие указанного молекулярного события является важнейшим признаком данных опухолей и определяет более благоприятный прогноз в сравнении с аналогичными глиомами астроцитарного гистопатологического ряда [6].
Важным прогностическим значением обладает также и статус метилирования промотера гена MGMT, который наряду с мутацией в генах IDH1 и IDH2 входит в диагностический минимум молекулярного обследования диффузных глиальных опухолей. Наличие метилирования промотера гена MGMT ассоциировано с рядом молекулярных особенностей данных опухолей. Кроме того, рассматриваемая молекулярная модификация сопровождается существенно лучшей выживаемостью пациентов, а также лучшим ответом на химиотерапию [6]. В рамках настоящей работы мы решили проанализировать взаимосвязь данных молекулярных факторов с продукцией ПК Mζ и ПК Ci.
Целью настоящей работы явилось изучение взаимосвязи активности экспрессии ПК Mζ и ПК Ci со статусом метилирования промотера гена MGMT и ко-делецией 1p/19q в диффузных глиомах.
Материалы и методы исследования
Группа для исследования
В рамках данной работы были сформированы несколько групп пациентов, при этом все пациенты подвергались хирургическому вмешательству в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко в 2016–2018 гг. Для изучения влияния метилирования промотера гена MGMT были сформированы шесть групп, которые сравнивались попарно друг с другом, группы формировались по принципу патогистологического и молекулярного родства опухолей и включали в себя группу ДА и АА с наличием метилирования промотера гена MGMT (ДА и АА MGMT-meth), группу ДА и АА без метилирования промотера гена MGMT (ДА и АА MGMT-unmeth), ГБ с наличием метилирования промотера гена MGMT (ГБ MGMT-meth), ГБ без метилирования промотера гена MGMT (ГБ MGMT-unmeth), олигодендроглиомы и анапластические олигодендроглиомы с наличием метилирования промотера гена MGMT (олигодендроглиомы MGMT-meth), олигодендроглиомы и анапластические олигодендроглиомы без метилирования промотера гена MGMT (Олигодендроглиомы MGMT-unmeth), в состав каждой из групп вошло по 30 образцов пациентов, причем в группах с двумя видами опухолей количество образцов между ними распределялось поровну. Диагноз был подтвержден при проведении патогистологического и молекулярно-генетического исследований тремя опытными патологами. Для определения статуса метилирования применялся метод метил-специфической ПЦР. Для исследования значимости ко-делеции 1p/19q были сформированы дополнительные две группы по 30 пациентов, в первую группу включались образцы пациентов с диагнозом олигодендроглиома и анапластическая олигодендроглиома с наличием ко-делеции 1p/19q, во вторую группу – пациенты с аналогичными диагнозами без ко-делеции 1p/19q. Наличие ко-делеции 1p/19q устанавливали с помощью исследования копийности данных хромосом с использованием метода флуоресцентной гибридизации in situ, полученные препараты анализировались патологами с опытом работы с флуоресцентыми препаратами.
Проведение иммуногистохимического исследования
При проведении иммуногистохимического исследования из парафиновых блоков с фиксированными в них образцами опухолей изготавливали срезы толщиной 3 мкм, далее депарафинировали данные образцы с использованием ксилола и повторно гидратировали с помощью различных концентраций этанола, затем срезы высушивали в термостате при 45 °C. После того проводили инкубацию с кроличьими моноклональными антителами против антигена ПК Mζ (Abcam, Великобритания), ПК Сi человека (Abcam, Великобритания) и конъюгировали с антикроличьими мышиными IgG антителом против пероксидазы хрена (Cell Marque, «Sigma-Aldrich», США). Визуализацию сайтов связывания антител проводили с помощью тетрагидрохлорида 3,3'-диаминобензидина («Ventana Medical Systems», США), ядра клеток окрашивали гематоксилином.
Проведение анализа
Все полученные препараты были проанализированы на предмет того, насколько высока в них активность экспрессии ПК Mζ (АЭ ПК Mζ) и ПК Ci (АЭ ПК Ci). Для данной цели применялся полуколичественный метод подсчета параметра, учитывавший количество позитивных клеток и интенсивность экспрессии маркеров в каждой клетке. Для этого препараты оцифровывались с помощью сканера Aperio 3T (Leica Biosystems, GmbH). Далее полуавтоматическим методом под контролем оператора проводилось определение процента клеток, в которых экспрессируется данный маркер, а также средней цветности всех позитивных меток в процентах. После чего полученные показатели складывались и усреднялись.
Статистический анализ
Для проведения статистического процессинга и анализа использовалось программное обеспечение SPSS Statistics 22 (IBM, США). Сравнение средних двух выборок производилось с использованием U-теста Манна – Уитни. Значения p < 0,05 считались статистически значимыми.
Результаты исследования и их обсуждение
Результаты сравнительного анализа ПК Mζ и ПК Ci в ДА и АА
При проведении сравнительного анализа активности экспрессии ПК Mζ и ПК Ci в ДА и АА с наличием и отсутствием метилирования промотера гена MGMT был выявлен ряд закономерностей. В частности, нам удалось показать, что АЭ ПК Mζ в среднем в ДА и АА MGMT-meth составляет 64,26 ± 2,42 %, при этом в ДА и АА MGMT-unmeth данный параметр больше и составляет 68,52 ± 2,86 %. При этом различия между группами носили статистически значимый характер (p = 0,004268). В то же время АЭ ПК Ci в среднем в ДА и АА MGMT-meth составила 62,76 ± 4,24 %, в ДА и АА MGMT-unmeth данный показатель равнялся 64,68 ± 4,32 %. При том различия не были значимыми (p = 0,064244) (рис. 1).
Сравнительный анализ ПК Mζ и ПК Ci в ГБ
В рамках проведенного сравнительного анализа в образцах ГБ было выявлено, что АЭ ПК Mζ в среднем в ГБ MGMT-meth составляет 80,22 ± 2,28 %, в то время как в ГБ MGMT-unmeth данный параметр был выше и равнялся 84,46 ± 4,42 %. При этом различия между группами были статистически значимыми (p = 0,002648). Также было показано, что АЭ ПК Ci была ниже в ГБ MGMT-meth и составила 80,34 ± 4,72, в ГБ MGMT-unmeth данный параметр составил 84,62 ± 2,28 %, различия были статистически значимыми (p = 0,004284).
Результаты сравнительного анализа ПК Mζ и ПК Ci в олигодендроглиомах
При сравнении показателей средних значений АЭ ПК Mζ и АЭ ПК Ci в олигодендроглиомах было выявлено, что АЭ ПК Mζ в среднем в олигодендроглиомах, MGMT-meth составила 60,42 ± 2,76 %, в то время как данный параметр в олигодендроглиомах, MGMT-unmeth равнялся 64,22 ± 4,72 %. При этом различия между группами носили статистически значимый характер (p = 0,004228). В то же время АЭ ПК Ci в олигодендроглиомах, MGMT-meth составила 62,38 ± 6,18 %, в олигодендроглиомах, MGMT-unmeth данный параметр составил 64,48 ± 2,36 %, различия не были статистически достоверными (p = 0,246488) (рисунок).
Данный параметр изучался в диффузных астроцитомах и анапластических астроцитомах с отсутствием метилирования промотера гена MGMT (ДА и АА MGMT-unmeth) и наличием метилирования промотера гена MGMT (ДА и АА MGMT-meth), глиобластомах с отсутствием метилирования промотера гена MGMT (ГБ MGMT-unmeth) и наличием метилирования промотера гена MGMT (ГБ MGMT-meth), олигодендроглиомах и анапластических олигодендроглиомах с отсутствием метилирования промотера гена MGMT (олиг, MGMT-unmeth) и наличием метилирования промотера гена MGMT (олиг, MGMT-meth).
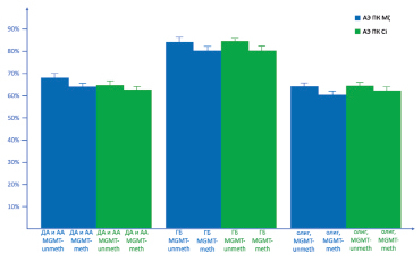
Взаимосвязь молекулярных модификаций с активностью экспрессии ПК Mζ (АЭ ПК Mζ) и ПК Ci (АЭ ПК Ci)
Сравнительный анализ протеинкиназ при модификации 1p/19q
При рассмотрении вопроса взаимосвязи количественных изменений фрагментов хромосом 1p/19q с АЭ ПК Mζ было выявлено, что данный параметр в олигодендроглиомах с наличием сочетанной делеции 1p/19q составил 62,43 ± 4,64 %, в то время как в олигодендроглиомах без делеции данный параметр составил 64,35 ± 2,68 %. Различия между группами не были статистически значимыми (p = 0,260846). В то же время АЭ ПК Ci в аналогичных группах составила в среднем 60,37 ± 4,27 % и 62,59 ± 4,38 % соответственно. При этом различия между данными группами не носили статистически значимого характера (p = 0,068244).
Результаты в рамках данного сравнительного анализа дают основания для крайне любопытных выводов. Необходимо заметить, что ПК Mζ достоверно активнее в диффузных глиомах без наличия метилирования промотера гена MGMT, то есть во всех гистологических видах глиом метилирование промотера гена MGMT взаимосвязано со снижением продукции ПК Mζ. Данная закономерность хорошо согласуется с ранее установленными особенностями участия ПК Mζ в патогенезе диффузных глиом. В частности, нами было показано, что рассматриваемая протеинкиназа становится значимо активнее при повышении степени злокачественности опухоли. То есть рост агрессивности онкологического процесса сопровождается повышением продукции ПК Mζ, что находит свое отражение и в клинической плоскости: активность экспрессии ПК Mζ влияет на выживаемость пациентов с диффузными глиомами.
В данном исследовании указанная закономерность находит свое дополнительное подтверждение. Хорошо известно, что, как уже указывалось выше, метилирование промотера гена MGMT сопровождается лучшим прогнозом для пациентов и лучшим ответом на лечение. Более того, метилирование промотера данного гена ведет к снижению злокачественных потенций диффузной глиомы [7]. Таким образом, активность ПК Mζ варьирует во взаимосвязи не только со злокачественным потенциалом опухоли в целом, но и с важными отдельными его маркерами и компонентами, в частности с метилированием промотера гена MGMT.
В то же время ПК Ci не демонстрирует такой же однозначной корреляции с типичными метиляционными чертами диффузных глиом. Данная протеинкиназа не изменяет свою активность в зависимости от наличия или отсутствия метилирования промотера гена MGMT в ДА и АА, а также в олигодендроглиомах, но активность ПК Ci повышается при метилировании промотера данного гена в ГБ. Представленные результаты также хорошо согласуются с нашими предыдущими исследованиями, которые демонстрируют значимую роль ПК Ci именно в патогенезе ГБ, причем в клинической плоскости прогноз пациентов с ГБ также взаимосвязан с продукцией данной протеинкиназы.
В вопросе взаимосвязи ко-делеции 1p/19q с активностью ПК M? и ПК Ci ситуация обстоит иначе, значимых различий данное генетическое событие не вызывает. В целом подобная картина может объясняться особенностями происхождения и развития глиом, возникающих из клеток со стволовыми свойствами. В ходе этого процесса ПК Mζ, по-видимому, выступает в качестве ключевого эффектора, через который реализуются злокачественные потенции опухоли и поддерживаются в гиперактивном состоянии многие ключевые функции клеток. В то же время ко-делеция 1p/19q, по-видимому, в большей степени ассоциирована не столько с функциональными особенностями клеток, сколько с гистогенетическими характеристиками, в результате чего данный параметр не взаимосвязан с активностью ПК Mζ [8]. Возможно также, что существуют и другие факторы, не связанные с ПК Mζ, которые включатся в процесс обеспечения злокачественного потенцирования опухоли в олигодендроглиомах. Тем не менее ряд вопросов взаимосвязи рассматриваемого генетического параметра с активностью ПК Mζ требует дополнительного анализа в разных моделях.
Заключение
В рамках данного исследования мы подтвердили наши предшествующие выводы о роли ПК Mζ и ПК Ci в прогрессировании и реализации злокачественного потенциала диффузных глиом. Более того, нам удалось расширить понимание механизмов взаимодействия данных протеинкиназ с важнейшими молекулярными факторами в патогенезе глиом, в частности метилированием промотера гена MGMT и модификацией фрагментов хромосом 1p/19q в различных гистологических видах глиом. Данные результаты позволяют сформировать более комплексное понимание роли рассматриваемых протеинкиназ в прогрессировании и развитии диффузных глиом. Кроме того, полученные данные усиливают имеющуюся научную базу для создания принципиально новых персонализированных подходов к диагностике и лечению глиальных новообразований.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01034 мк.

