Использование СО2 в качестве сырья для конверсии в CO реальная, но в то же время серьезная технологическая проблема [1]. Электрохимическое восстановление CO2 считается одним из самых привлекательных способов хранения возобновляемых источников энергии с получением газообразного CO или жидкого топлива: муравьиная кислота, метиловый спирт и углеводороды, технология переработки которых хорошо развита. В пользу развития данного направления указывают значительные выбросы парниковых газов в атмосферу.
Восстановление CO2 из водных и/или неводных растворов детально исследовано в работах [2–4]. Практическое осуществление электрохимического восстановления CO2 при высоких температурах с сокращением его выбросов включает два совершенно разных подхода: а) использование твердофазного электролиза [5, 6] и б) электролиз расплавленного карбоната [7, 8]. Преимущество ячеек для карбонатного электролиза состоит в том, что исходный материал CO2 и продукты, получаемые при электролизе (CO и O2), не смешиваются. Однако электролиз расплавленных карбонатов имеет серьезные проблемы с подбором износоустойчивых материалов к агрессивной карбонатной среде.
Привлекательной альтернативой представляется использование в качестве источника СО2 дымовых газов ТЭС и металлургических предприятий, работающих на сжигании угля. Концентрация SO2 в дымовых газах составляет несколько десятых долей процента. Поскольку загрязнение серой является серьезной проблемой для всех способов конверсии СО2 в СО [5–9], разработка метода, устойчивого по отношению к SO2, вызывает большой интерес к проведению научных исследований.
Физико-химические процессы, протекающие при электролизе сульфатно-карбонатных расплавов, изучены в работах [10, 11]. Авторами показано, что механизм процесса электролиза сульфатно-карбонатных расплавов более сложный, чем механизм процесса электролиза чистых карбонатных расплавов, ввиду протекания значительного количества побочных реакций между сульфатами и карбонатами с образованием различных продуктов. Так, согласно результатам работы [11], электролиз смеси Na2CO3/Na2SO4 при 820–860 °C приводит к протеканию электрохимических реакций с образованием сульфида натрия, и получением CO на катоде и кислорода на аноде. При этом восстановление ионов карбоната предшествует восстановлению сульфида.
В настоящей работе приведены результаты исследований процесса непрерывного электролиза расплавленного Li2CO3 при 900 °C с получением СО при значении плотности тока на обоих электродах более 100 мА/см2.
Материалы и методы исследования
Электрохимические измерения в расплавах Li2CO3 и Li2CO3/Li2SO4 проводились методом циклической вольтамперометрии.
В опытах использовался модельный синтетический газ, имитирующий реальные топочные газы, трех различных составов, % (об.): 5 SO2, 15 CO2, 3 O2, остальное N2; тот же состав, но без кислорода; и тот же состав, но без SO2.
Общий объем титановой ячейки – 980 см3. Площадь поперечного сечения, определяющая площадь контакта расплава с газом – 20 см2.
Содержание серы в расплаве после процесса определяли путем отбора пробы (~200 мг) холодным плоским титановым стержнем, который далее подвергали анализу методом энергодисперсионной рентгенофлуоресцентной спектроскопии (EDS, Leo Supra SEM).
Измерения циклической вольтамперометрии расплавленного Li2CO3 при 50 мВ/с проведены при температурах 850 и 900 °C на приборе VersaSTAT3–200 (Princeton Applied Research, макс. 2,5 А). Для электролиза использован титановый катод, графитовый анод и платиновый псевдоэлектрод. Ток подавался источником питания Kepco Power (Модель поставки KLP 20-120-1200).
Состав выделяемых газов определяли методом газовой хроматографии (серия GOWMAC 350). Отметим, что при 900 °C расплав Li2CO3/Li2O может содержать до 19 % Li2O. При 15 % СО2 в исходном газе равновесная концентрация Li2O составляет от 1 до 2 % моль.
Результаты исследования и их обсуждение
Электрохимическое производство CO из расплава Li2CO3
Опыты проводились с использованием ячейки, изготовленной из сварного титана, устойчивого к расплавленному карбонату Li2CO3 и смеси Li2CO3/Li2SO4.
Общий вид электролизной ячейки показан на рис. 1.

Рис. 1. Общий вид электролизной ячейки

а) б)
в)
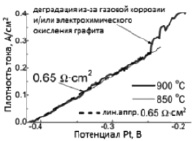
Рис. 2. Результаты циклической вольтамперометрии: а) циклическая вольтамперометрия расплава Li2CO3; б) циклическая вольтамперометрия расплава Li2CO3 двух циклов при 900 °C; в) вольтамперная кривая расплава Li2CO3 при 850 °C и 900 °C для графитового анода
Результаты исследований циклической вольтамперометрии расплава Li2CO3 на титановом катоде показаны на рис. 2.
На рис. 2, а, видно, что единственная реакция, выделяющая газообразный продукт, протекает на катоде. Одинаковый характер вольтамперных характеристик в прямом и обратном направлениях указывает, что газ в катодном пространстве не накапливается. При этом в диапазоне 1–50 мВ/с циклическая вольтамперометрия не зависит от скорости сканирования.
При скорости сканирования 10 мВ/с циклическая вольтамперометрия подвергается сильному положительному смещению после первого цикла (рис. 2, б). Применение положительного смещения относительно равновесного потенциала к Ti электроду приводит к образованию изоляционного слоя, что делает работу графитового анода неэффективной. Высокий положительный электрохимический потенциал приводит к быстрому разрушению электрода из-за газовой коррозии за счет окисления графита. Плотность тока 200 мА/см2 требует перенапряжения ~2 В, что в 10 раз больше, чем для графитового анода (рис. 2, в). Приведенные данные свидетельствуют о том, что диапазон стабильности титанового катода при 900 °С находится в пределах изменения границ напряжения от 3 до 0 В по отношению к равновесному электрохимическому потенциалу, с катодной плотностью тока более 3 А/см2.
В результате исследования вольтамперных характеристик графитового анода в стационарном режиме с отклонением от равновесного электрохимического потенциала 200 мВ установлена максимальная плотность тока, равная 270 мА/см2. Линейная зависимость плотности тока от напряжения при 850 и 900 °C показывает, что ее значение сильно ограничивается сопротивлением графита (рис. 2, в). Плотность анодного тока выше катодного (200 мА/см2), что вызывает быстрое увеличение количества получаемого газа и механическое разрушение графитового анода, причиной которого может быть либо газовая коррозия, либо электрохимическое окисление графита. Даже небольшой катодный ток 30 мА/см2 приводит к быстрому набуханию и механическому разрушению графитового электрода из-за его восстановления и интеркаляции графита с литием. Это свидетельствует о том, что графит имеет относительно небольшой диапазон стабильности электродного потенциала: от 0 В до +200 мВ по отношению к равновесному потенциалу. Однако он может поддерживать текущие плотности более 200 мА/см2. Попытки провести хронометраж вольтамперных характеристик для титанового катода и графитового анода не увенчались успехом, ввиду достижения системой постоянного тока менее чем за 3 с.
Электролиз и циклическая вольтамперометрия расплава Li2CO3/Li2O/Li2SO4
Исследование влияния присутствия в расплаве сульфата лития на катодные реакции при электролизе расплава Li2CO3/Li2O при 900 °C проводили при концентрации Li2SO4 в расплаве 1,45 мол. %. Исходный газ не содержал SO2.
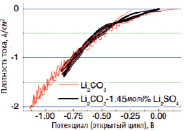
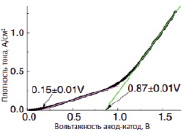
В качестве электрода сравнения использовался анод, площадь катода должна была быть значительно меньше площади анода (стенки контейнера). Результаты циклической вольтамперометрии (при 50 мВ/сек), выполненные в ячейке с титановым катодом площадью 1,13 см2, и титановым анодом площадью 260 см2 для расплава Li2CO3/Li2O/Li2SO4 показаны на рис. 3.
а) б)
Рис. 3. Кривые циклической (а) и линейной (б) вольтамперометрии смеси Li2CO3/Li2O при Т = 900 °C
На рис. 3 отсутствуют фрагменты, показывающие выделение пузырьков CO. Это свидетельствует о том, что количество произведенного газа значительно меньше, по-видимому, за счет протекания побочной реакции восстановления сульфата лития, основным продуктом которой является газообразная сера. За счет выделения сульфата лития из расплава накопления продукта реакции не происходит, вследствие чего кривые, как с сульфатом лития, так и без него, практически ложатся на одну линию (рис. 3, а).
Механизм разложения сульфата лития в условиях электролиза смеси Li2CO3/Li2O/Li2SO4 можно описать системой следующих реакций:
Li2SO4 → Li2O + SO2↑ + 1/2О2↑, (1)
Li2SO4 → Li2S + 2О2↑, (2)
Li2SO4 → Li2O + 1/2S2↑ + 3/2О2↑. (3)
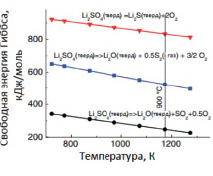
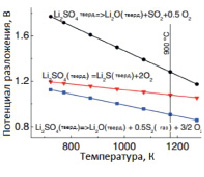
Принимая за стандартное состояние Li2SO4тв., Li2Oтв., Li2Sтв. по данным работы [12], нами проведен расчет свободной энергии Гиббса и значений электрохимического потенциала разложения сульфата лития по трем вышеуказанным механизмам в интервале температур 600–1400 К. Зависимость свободной энергии Гиббса и электрохимического потенциала разложения сульфата лития от температуры показана на рис. 4.
а) б)
Рис. 4. Зависимость свободной энергии Гиббса (а) и электрохимического потенциала разложения сульфата лития (б) от температуры
Минимальный электрохимический потенциал разложения сульфата лития получен для реакции (3) (рис. 4, б). Согласно данным авторов [11], следовало бы ожидать преобладания образования сульфида лития по реакции (2).
В нашем случае при 900 °C прогнозируемое значение электрохимического потенциала реакции (2) составляет ~1,1 В, что практически на 1,0 В выше значения, наблюдаемого на рис. 4, б.
Прогнозируемое значение электрохимического потенциала реакции (3) составляет ~0,9 В, что тоже практически на 0,75 В выше наблюдаемого значения на рис. 4, б. Это расхождение нельзя объяснить только тем, что расчеты для исходных и полученных твердых продуктов не учитывают энергию взаимодействия Li2O с расплавом.
Расчетное значение свободной энергии Гиббса растворения Li2O в расплаве Li2CO3 при 900 °С составляет ∆G ≈ 55 кДж/моль×К, что вполне объясняет уменьшение электрохимического потенциала разложения всего на 0,1 В. Возможность того, что окисление титанового контейнера, служащего анодом, может повлиять на значение измеренного электрохимического потенциала разложения Li2SO4, можно не учитывать. Максимальная плотность анодного тока во время эксперимента составляет ~13 мА/см2. Это не приведет к сдвигу электрохимического потенциала более чем на 50 мВ. В каждой точке кривой на рис. 4, б, было достигнуто устойчивое состояние, и полученная кривая легко воспроизводится анодным электродом. Это означает, что непрерывного окисления титана с образованием TiO2 на поверхности анода не происходит. Следовательно, убедительное объяснение низкого электрохимического потенциала разложения Li2SO4 пока отсутствует.
Полученные результаты предполагают, что разложение Li2SO4 требует значительной энергии. Чтобы убедиться, что реакция (3) действительно доминирует, был проведен продолжительный электролиз при 900 °C расплава Li2CO3/Li2O (объем 160 ± 5 см3), который изначально содержал 1,45 мол. % Li2SO4. В исходном газе SO2 отсутствовал. Пробы электролита периодически отбирались и подвергались анализу методом EDS.
Площадь катода составляла 7,5 см2, площадь анода – 250 см2. Катодная плотность тока составляла 1,47 А/см2 (при такой плотности тока процесс преобразования СО2 в СО осуществляется), плотность анодного тока – 44 мА/см2. После 11 часов электролиза получаемый из катодной камеры газ содержал твердый осадок, идентифицированный EDS-анализом как чистая элементная сера.
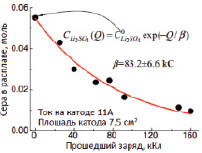
Содержание серы экспоненциально снижается с увеличением количества заряда, потраченного на электролиз (рис. 5, а).
а) б)
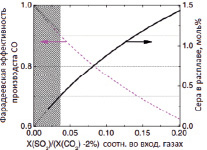
Рис. 5. (а) зависимость содержания серы в расплаве от электрического заряда; (б) зависимость эффективности Фарадея производства CO и равновесного содержания серы в расплаве от отношения SO2/CO2 в исходном газе
Дифференцирование кривой зависимости содержания серы в расплаве от количества прошедшего заряда (рис. 5, а) позволяет рассчитать эффективность процесса выделения серы – (ηS (Cs)), и получения CO – (1 – ηS (Cs)):
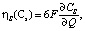 (4)
(4)
где Cs – содержание серы в расплаве (моль),
Q – количество заряда (кулон),
F – постоянная Фарадея.
Для определения эффективности электролиза в промышленных условиях необходимо знать эффективность процесса производства CO, определяемую как функция от количества серы в газах. Расход подаваемого газа должен быть отрегулирован для достижения равновесного давления CO2 при 900 °C. При этом должно выполняться условие:
X(SO2)/(XСO2) < 2), где X – парциальное давление, % (об.). В процессе электролиза должно соблюдаться следующее соотношение:
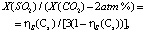 (5)
(5)
где Cs – равновесная концентрация серы в расплаве,
ηs – эффективность процесса восстановления Li2SO4.
Постоянный стехиометрический коэффициент 3, в знаменателе правой части уравнения (5) – это соотношение заряда, необходимого на восстановление сульфата и карбоната. Правая часть уравнения (5) оценивается для различных значений Cs с помощью рис. 5, a, и уравнения (4), которая далее позволяет определить отношение парциальных давлений газов в левой части уравнения (5).
График эффективности процесса получения CO (1 – ηS (Cs)) и серы (Cs) как функции изменения от отношения SO2 к CO2 в дымовых газах показан на рис. 5, б. Для типичного газа, содержащего ~15 % CO2 и <0,5 % SO2 (заштрихованная область на рис. 5, б), равновесное содержание серы в расплаве не превышает ~0,3 % (моль.). При этом эффективность производства CO выше 90 %.
Выводы
1. Электролиз расплавленного карбоната лития обеспечивает легкодоступный источник CO и может использоваться как недорогой метод очистки отходящих газов ТЭС от CO2, содержащего SO2.
2. Значительное поглощение SO2 карбонатом лития при 900 °C требует некоторого количества кислорода, в присутствии которого поглощение SO2 почти полностью завершается и приводит к образованию Li2SO4. Электролиз расплава Li2CO3/Li2O, содержащий <2 % (мол.) Li2SO4, позволяет получать при 900 °C в катодном пространстве CO и элементную серу.
3. Потенциал разложения Li2SO4 составляет 0,15 В, а при катодной плотности тока выше 1 А/см2 ток восстановления серы ограничивается диффузией. Поскольку сера постоянно удаляется из катодного пространства электролизера, преобразование CO2 в CO при электролизе расплавленного карбоната лития может использовать загрязненные серой источники СО2.
Исследования проводились в рамках грантового финансирования Комитета науки Министерства образования и науки Республики Казахстан на 2020–2022 годы по приоритетному направлению «Рациональное использование природных ресурсов, в том числе водных ресурсов, геологии, переработки, новых материалов и технологий, безопасных изделий и конструкций» проекта № AP08856384 ««Разработка новой высокотехнологичной технологии утилизации SO2 и CO2 из отходящих газов ТЭЦ и металлургических предприятий с получением товарных продуктов».

