Исследование координационных соединений редкоземельных металлов с аминокислотами вызывает большой интерес ученых в связи с биохимическими процессами, протекающими в живых организмах [1, 2].
Выяснение возможностей комплексоообразования, установления состава, концентрационных пределов синтеза в насыщенных водных растворах, свойств новых координационных соединений хлорида гольмия с глицином является основной целью настоящей работы.
Тройная система хлорид гольмия – глицин – вода исследована методом растворимости при 25 °С. Исходными веществами являлись предварительно очищенные путем перекристаллизации в водной среде хлорид гольмия и глицин марки «ч.д.а.». Момент установления равновесия в системе контролировали сходимостью результатов химического анализа последних двух проб в жидкой фазе. Содержание ионов гольмия определяли трилонометрическим титрованием [3, с. 19], а азот глицина – методом Къельдаля [4, с. 16]. Идентификацию твердых фаз (в мас. %) проводили методом «остатков» Скрейнемакерса.
Система хлорид гольмия – глицин – вода при 25 °С
Как видно из экспериментальных данных (рис. 1, табл. 1), диаграмма растворимости исследуемой системы при 25 °С состоит из трех областей кристаллизации. Первая и третья области отвечают кристаллизации исходных солей. Средняя ветвь кривой ликвидуса указывает на комплексообразование в насыщенных водных растворах координационного соединения с соотношением соли:глицина:воды 1:3:3.
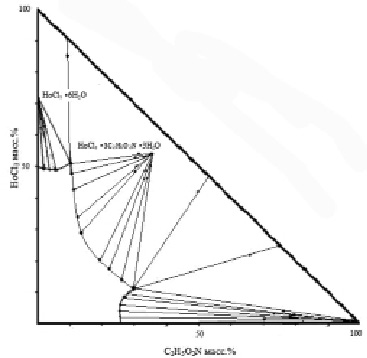
Рис. 1. Диаграмма растворимости системы хлорид гольмия – глицин – вода при 25 °С
Таблица 1
Растворимость и состав твердых фаз в системе НоCl3-C2H5O2N-H2O при 25 °С
|
№ |
Состав жидкой фазы, |
Состав твердого «остатка», |
Кристаллизующаяся фаза |
||
|
мас. % |
мас. % |
||||
|
HoCl3 |
C2H5O2N |
HoCl3 |
C2H5O2N |
||
|
1 |
– |
25,80 |
– |
– |
|
|
2 |
1,97 |
25,57 |
0,55 |
80,00 |
|
|
3 |
3,98 |
25,50 |
1,88 |
69,96 |
|
|
4 |
5,40 |
25,31 |
1,93 |
78,40 |
|
|
5 |
8,10 |
26,49 |
2,97 |
75,43 |
C2H5O2N |
|
6 |
9,61 |
27,53 |
3,11 |
79,26 |
|
|
7 |
11,88 |
29,39 |
4,13 |
74,59 |
|
|
8 |
24,68 |
66,27 |
24,68 |
66,27 |
C2H5O2N + HoCl3•3C2H5O2N•3H2O |
|
9 |
42,21 |
51,44 |
42,21 |
51,44 |
|
|
10 |
11,88 |
29,39 |
51,78 |
34,00 |
|
|
11 |
13,62 |
25,90 |
48,97 |
32,29 |
|
|
12 |
17,9 |
20,10 |
49,11 |
31,41 |
|
|
HoCl3•3C2H5O2N•3H2O |
|||||
|
13 |
19,19 |
17,29 |
50,71 |
32,00 |
|
|
14 |
28,01 |
10,38 |
50,00 |
29,97 |
|
|
15 |
33,49 |
6,13 |
51,98 |
30,33 |
|
|
16 |
43,11 |
5,87 |
53,70 |
31,86 |
|
|
17 |
48,64 |
9,93 |
53,48 |
29,21 |
|
|
18 |
51,22 |
10,13 |
54,33 |
29,99 |
|
|
19 |
51,22 |
10,13 |
86,60 |
9,21 |
HoCl3•3C2H5O2N•3H2O + HoCI3•6H2O |
|
20 |
51,22 |
10,13 |
68,58 |
1,91 |
|
|
HoCl3•6H2O |
|||||
|
21 |
49,79 |
6,86 |
64,65 |
1,96 |
|
|
22 |
49,65 |
4,77 |
65,87 |
1,99 |
|
|
23 |
50,00 |
2,19 |
64,68 |
0,94 |
|
|
24 |
50,71 |
– |
71,54 |
– |
|
Полученное соединение занимает довольно обширные концентрационные пределы образования и является конгруэнтно растворимым в воде. Исходя из таких условий, твердая фаза легко выделяется из водной среды в виде кристаллов светло-желтого цвета. Пересчет массовых долей на молекулярные соответствует формуле с соотношением компонентов HoCl3•3C2H5O2N•3H2O.
Индивидуальность установленного по ди- аграмме растворимости соединения подтверждена изучением ИК-спектров поглощения, термогравиграмм (рис. 2) и дифрактограмм (рис. 4).
C целью выяснения природы координационной связи глицина с ионом гольмия в комплексе, изучены смещения полос поглощения лигандов в области 400–4000 см-1 на спектрометре Nicolet-IR-1200 в виде таблеток с бромистым калием (табл. 2).
Таблица 2
Основные колебательные частоты (см-1) в ИК-спектрах глицина и комплексного соединения
|
С2Н5О2N |
HoCI3•3C2H5O2N•3H2O |
Отнесение |
|
504 |
510 |
t (NH3+) |
|
607,7 |
591 |
(NH2); π (СОО-) |
|
698,3 |
678 |
w(COO-) |
|
892,8; 910,9 |
907 |
νs(CCN) r(CH2) |
|
1033,5 |
1037,7 |
νas(CCN) |
|
1112,2; 1131,8 |
1106 |
ρr(NH3+) |
|
1333,7 |
1333,8 |
w(CH2) |
|
1412,9; 1443,7 |
1415; 1480,4 |
νs(COO-) |
|
1502; 1512; 1530 |
1527,2 |
δs(NH3+) |
|
1611,6; 1619,7 |
1574; 1616,6 |
νas(COO-) |
|
3007,6; 3168,1 |
– |
ν(NH2) |
|
– |
3402,9 |
ν(ОН) |
Сравнение ИК-спектров свободного глицина и соединения HoCl3•3C2H5O2N•3H2O показывает сходный контур кривых поглощения и указывает на сохранение цвиттер-ионной формы аминокислоты [5, с. 103].
Частоты антисимметричных валентных колебаний νasCOO- группы свободного лиганда в области 1611,6 см-1 при образовании соединения уменьшаются до 1574 см-1, а симметричные валентные колебания νsCOO- смещаются в высокочастотную область (с 1443,7 по 1480,4 см-1), т.е. атомы кислорода карбоксилат-иона участвуют в донорно-акцепторном взаимодействии. Величина δ(СОО-) = νas COO-) – νs(COO-) = = 94 см-1, что также указывает на вхождение молекул глицина во внутреннюю сферу. В спектре некоординированного глицина полосы при 3007,6 и 3168,1 см-1 отвечают колебаниям ν(NH2). В спектре комплекса эти полосы перекрываются полосами валентных колебаний координированных молекул воды и проявляются в виде широкой полосы с нечетко выраженным максимумом при 3402,9 см-1. Наложение полос деформационного колебания НОН и антисимметричных валентных колебаний карбоксилат-иона в области 1630–1600 см-1 препятствует их идентификации.
Термические свойства HoCI3·3C2H5O2N·3Н2О изучены методом дериватографии. На термограмме наблюдаются четыре термических эффекта (рис. 2, табл. 3). В результате нагревания происходит дегидратация соединения при 90 °С с потерей трех молекул воды, что составляет 2,75 % от исходной массы.
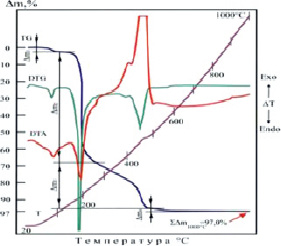
Рис. 2. Термогравиграмма соединения HoCl3•3C2H5O2N•3H2O
Таблица 3
Экспериментальыне данные термического анализа соединения HoCI3·3C2H5O2N·3Н2О
|
Соединение |
Температура |
Убыль |
Процессы, происходящие в веществе |
|
термоэффекта, |
массы, % |
при нагревании |
|
|
°С |
|||
|
20–105 |
2,75 |
Выход механически |
|
|
HoCI3·3C2H5O2N·3Н2О |
связанной воды |
||
|
105–260 |
65,25 |
Разложение органической |
|
|
части молекулы |
|||
|
260–490 |
27,00 |
Удаление оксидов CO2, |
|
|
NO2 |
|||
|
490–1000 |
2,00 |
Окисление и |
|
|
термодеструкция |
|||
|
неорганической соли |
В интервале температур 105–160 °С происходит распад молекул аминокислоты с образованием оксидов углерода и азота. Глубокий пик, выполненный на DTA- и DTG-кривых при 200 °C обусловлен развитием интенсивного выброса в атмосферу атомов водорода, азота и их оксидов. При этой реакции масса образца в промежутке 105–260 °C снижается на величину m2 = 65,25 %. На отрезке DTA-кривой в диапазоне 260–490 °C происходит выброс продуктов обжига и при этом потеря массы составляет m3 = 27,0 %. С повышением температуры в интервале 490–1000 °C происходит окисление хлорида гольмия и его термодеструкция. Термическая диссоциация его вызывает слабый эндотермический эффект при 500 °C и некоторый провал DTG-линии в промежутке 490–600 °C. TG-кривая указанного процесса определила потерю веса, соответствующей значению m4 = 2,0 %. Общая потеря массы при 1000 °С по ТG составляет 97,0 %.
На основе полученных экспериментальных данных можно предположить следующее строение комплекса (рис. 3).
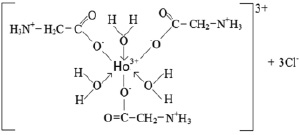
Рис. 3. Предполагаемое строение соединения НоCl3∙3C2H5O2N∙3H2O
Таким образом, координация глицина к центральному иону осуществляется через атомы кислорода ионизированной карбоксильной группы за счет вытеснения трех молекул воды из внутренней сферы аквакомплекса хлорида гольмия.
Рентгенодифрактометрический анализ соединения (рис. 4, табл. 4) проведен на автоматизированном дифрактометре ДРОН-3 ( излучение, β фильтр).
излучение, β фильтр).
Таблица 4
Рентгенографические данные комплексного соединения HoCI3•3C2H5O2N•3H2O
|
№ |
2Ө |
I ( %) |
Ө |
D (эксп.) |
Δ± |
h |
k |
l |
Сингония |
|
1 |
11,71 |
3,0 |
5,855 |
7,5539 |
0,0322 |
1 |
0 |
0 |
Моноклиннаая a = 7,9836 Å b = 8,1832 Å c = 7,0920 Å β = 109,5740 |
|
2 |
13,20 |
3,0 |
6,6 |
6,7015 |
0,0253 |
0 |
0 |
1 |
|
|
3 |
14,47 |
5,9 |
7,235 |
6,1161 |
0,0210 |
-1 |
0 |
1 |
|
|
4 |
17,09 |
2,3 |
8,545 |
5,1839 |
0,0151 |
0 |
1 |
1 |
|
|
5 |
19,09 |
2,9 |
9,545 |
4,6451 |
0,0121 |
0 |
0 |
0 |
|
|
6 |
20,13 |
2,8 |
10,065 |
4,4074 |
0,0108 |
0 |
0 |
0 |
|
|
7 |
21,76 |
10,02 |
10,88 |
4,0808 |
0,0093 |
0 |
2 |
0 |
|
|
8 |
25,27 |
100,0 |
12,635 |
3,5213 |
0,0069 |
-1 |
0 |
2 |
|
|
9 |
25,92 |
3,6 |
12,96 |
3,4345 |
0,0065 |
2 |
1 |
0 |
|
|
10 |
28,75 |
3,2 |
14,375 |
3,1025 |
0,0053 |
0 |
1 |
2 |
|
|
11 |
29,27 |
17,5 |
14,635 |
3,0486 |
0,0051 |
-2 |
0 |
2 |
|
|
12 |
30,15 |
3,6 |
15,075 |
2,9616 |
0,0048 |
1 |
2 |
1 |
|
|
13 |
35,89 |
5,7 |
17,945 |
2,5000 |
0,0034 |
-1 |
3 |
1 |
|
|
14 |
39,07 |
15,7 |
19,535 |
2,3035 |
0,0028 |
1 |
3 |
1 |
|
|
15 |
42,55 |
21,275 |
23,40 |
2,1230 |
0,0024 |
3 |
0 |
1 |
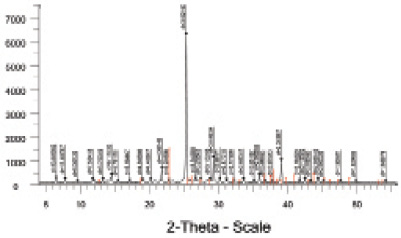
Рис. 4. Рентгенограмма cоединения НоCl3∙3C2H5O2N∙3H2O
Рентгенограмма данного соединения содержит новые линии, которые ни по интенсивности, ни по значениям межплоскостных расстояний не совпадают с набором линий исходных компонентов и свидетельствуют об индивидуальности установленного нами нового соединения.
Выводы
1. Изотерическим методом при 25 °С изучено взаимодействие хлорида гольмия с глицином и установлено образование одного комплексного соединения НоCl3∙3C2H5O2N∙3H2O.
2. Индивидуальность полученного соеди- нения доказана методом ИК-спектроскопии и дифференциально-термическим, рентгенографическим анализами.
3. На основании анализа колебательных спектров глицина и исследуемого соединения показано, что глицин координирован к иону гольмия через атомы кислорода ионизированной карбоксильной группы.

