Сульфонилазотсодержащие гетероциклы и ациклические соединения характеризуются высокой биологической активностью, широким спектром бактерицидного и фунгицидного действия, что обусловливает их применение в борьбе с патологическими микроорганизмами, болезнями растений и человека [1–3]. При этом синтезы подобных веществ сопряжены с использованием токсичных и дорогостоящих реагентов (сульфонилизоцианаты, арилсульфохлориды, замещенные сульфонилбензоаты и т.д.), неорганических и органических катализаторов (соли тяжелых металлов, циклические мостиковые амины, такие как 1,8–диазабицикло[5;4;0]–7-ундецен (DBU); 1,5-диазабицикло[4;3;0]нон-5-ен (DBN); 1,4–диазабицикло[2;2;2]октан (DBO) и др.).
Теоретически видится целесообразным конструирование сульфонилазотсодержащих структур путем непосредственного взаимодействия SO3 и соединений, содержащих цианогруппу (нитрилов, тиоцианатов, цианоамидов). Однако известно, что таким способом направленные синтезы сульфонилазотсодержащих продуктов заданного строения и состава осуществить затруднительно из-за низкой селективности реакций. В силу практической значимости сульфонилазотсодержащих препаратов поиск простых и эффективных путей их синтеза является актуальной задачей органической химии.
Исследования доказали, что связывание триоксида серы в комплексы и гетероциклические аддукты с нитрилами позволяет расширить синтетические возможности системы и избирательность превращений [4, 5].
Высокая биологическая активность, обусловленная специфическим действием отдельных структурных фрагментов природных и синтетических веществ, всегда представляет интерес для направленных путей синтеза соединений с заданными свойствами. Многообещающими структурами оказались в этом отношении 2,6-дизамещенные 1,4,3,5-оксатиадиазин-4,4-диоксиды (I). Ранее были показаны разнообразные и неожиданные пути их реагирования [4].
Поскольку бактерицидный эффект сульфониламидной, сульфониламидиновой групп неоднократно подтверждался [1–3], представляется интересным получение этих структур с заместителями, также обладающими потенциальной биологической активностью. Наиболее часто в природных и синтетических биологически активных соединениях встречается пиперидиновый, морфолиновый, пиперазиновый циклы, этим был обусловлен выбор реагентов для направленно получаемых веществ.
Цель исследования – изучение синтетических возможностей 2,6-дизамещенных 1,4,3,5-оксатиадиазин-4,4-диоксидов (I) с целью получения биологически активных сульфонилазотсодержащих структур простым и удобным способом.
Материалы и методы исследования
В роли субстратов рассмотрен ряд 1,4,3,5-оксатиадиазин-4,4-диоксидов, имеющих пиперидиновый или морфолиновый заместитель в гетероцикле (R1 = C6F5, CCl3, CBr3; NR2 = N(CH2)5, N(CH2)4O). В качестве реагентов для получения сульфонилмочевин и сульфониламидинов рассмотрены нуклеофилы – вода и амины (пиперидин, морфолин).
Индивидуальность полученных соединений и контроль степени протекания реакции контролировались методом тонкослойной хроматографии на пластинках Silufol UV-254, элюент – ацетон-гексан, 1:1 (об.), проявление – парами йода.
Строение и состав полученных в работе соединений установлены с помощью ИК-спектроскопии и элементного анализа. ИК-спектры продуктов записаны на спектрофотометре Specord 80-M в масле.
Результаты исследования и их обсуждение
Дефицит электронной плотности при атоме углерода, связанном с электроноакцепторным заместителем R1 в 1,4,3,5-оксатиадиазиновом цикле (I), делает возможным его превращения в реакциях с нуклеофильными реагентами.
Взаимодействие асимметричных диоксидов (I, а-д) с сильноакцепторным заместителем R1 (R1 = CCl3, CBr3, C6F5) и пиперидиновым или морфолиновым заместителем R2 (R2 = N(CH2)5, N(CH2)4О) с водой и аминами протекает с раскрытием 1,4,3,5-оксатиадиазинового цикла исходного субстрата и образованием N, N’-дизамещенных сульфонилмочевин (II, а-д) и N, N-диалкил-N’- (N’’,N’’-диалкиламидиносульфонил)мочевин (III, а-в), соответственно.
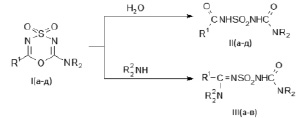
I, R1 = CCl3; NR2 = N(CH2)5 (а); R1 = CCl3; NR2 = N(CH2)4О (б); R1 = CBr3; NR2 = N(CH2)5 (в);
R1 = CBr3; NR2 = N(CH2)4О (г); R1 = C6F5; NR2 = N(CH2)5 (д);
II, R1 = CCl3; NR2 = N(CH2)5 (а); R1 = CCl3; NR2 = N(CH2)4О (б); R1 = CBr3; NR2 = N(CH2)5 (в);
R1 = CBr3; NR2 = N(CH2)4О (г); R1 = C6F5; NR2 = N(CH2)5 (д);
III, R1 = CCl3; NR2 = N(CH2)5; NR22 = N(CH2)5 (а); R1 = CBr3; NR2 = N(CH2)5; NR22 = N(CH2)5 (б); R1 = CCl3; NR2 = N(CH2)4О; NR22 = N(CH2)4О (в).
Гидролиз катализировался основаниями, причем диоксиды (Iа) и (Iб), имеющие более акцепторный заместитель R1, гидролизовались легче, в более мягких условиях. Гидролитическое раскрытие указанных гетероциклов количественно протекает при комнатной температуре (20 °С) в 10 %-ном водном растворе Na2CO3. Образовавшиеся сульфонилмочевины переводились в Н-форму и высаживались из водного раствора серной кислотой. Осадок отделялся фильтрованием и обрабатывался водой до нейтральной реакции.
Снижение акцепторных свойств заместителя R1 в гетероцикле (I) требует более жестких условий для его раскрытия. Так, полный гидролиз диоксидов (Iв) и (Iг) до соответствующих N, N’-дизамещенных сульфонилмочевин (IIв) и (IIг) возможен при кратковременном нагревании до 50–60 °С в 30 %-ном водном растворе NaOH. Диоксид (Iд) вследствие некоторого донорного мезомерного эффекта заместителя R1 = C6F5 удалось гидролизовать, повысив концентрацию водного раствора NaOH до 40 % и нагревая реакционную массу до 60 °С.
Выделение сульфонилмочевин (II, в-д) проводилось аналогично высаждением из водного раствора серной кислотой, отделением продукта на фильтре с промыванием водой до нейтральной реакции.
Вследствие прикладного интереса к сульфониламидинным структурам следующей частью работы выбрано взаимодействие диоксидов (I) с аминами. Сообразно поставленной цели исследования – введение в структуру фрагментов, характеризующихся биологической активностью – в качестве аминных реагентов выбраны пиперидин и морфолин.
Нуклеофильные свойства пиперидина и морфолина значительно выше в сравнении с нуклеофильностью молекул воды, поэтому аминолиз 1,4,3,5-оксатиадиазинового цикла успешно проходит в интервале температур -20–20 °С с количественными выходами N, N-диалкил-N’- (N’’, N’’-диалкиламидиносульфонил)мочевин (III). Реакционная способность диоксидов (I) в реакциях с аминами проявлялась аналогично гидролизу: диоксиды с более акцепторным заместителем R1 = CCl3 участвовали в аминолизе очень активно и для контролируемого проведения реакции требовалось охлаждение реакционной массы (-20–15 °С). Более стабильные диоксиды (Iв-д) реагировали с пиперидином и морфолином при комнатной температуре (20 °С).
Аминные реагенты брались для реакции в диоксидами (I) в эквимольных количествах и добавлялись к раствору диоксидов (I) в СН2Cl2 постепенным прикапыванием в атмосфере осушенного аргона для исключения побочного гидролитического разложения исходных гетероциклов. Продолжительность реакции, проводимой при охлаждении, составляла 60–65 минут и 30–35 минут – при комнатной температуре. По истечении реакции растворитель отгонялся, остаток обрабатывался гексаном.
Проведенные в ОБИ ННГУ (г. Нижний Новгород) предварительные испытания биологической активности образца N, N-пентаметилен-N’-трихлорацетамидосульфонилмочевины (IIа) выявили ее высокую бактерицидную активность.
Там же испытывался образец N,N-пентаметилен-N’-(N’’, N’’-пентаметилен- трибром-ацетамидиносульфонил)мочевины (IIIб). Показано, что образец проявляет высокую бактерицидную и фунгицидную активность, эффективно подавляет развитие возбудителей мучнистой росы, фитофтороза томатов и серой гнили бобовых культур.
Характеристики полученных соединений (II, а-д) и (III, а-в) приведены в табл. 1, данные элементного анализа – в табл. 2.
Таблица 1
Выходы, температуры плавления и ИК-спектры N,N’-дизамещенных сульфонилмочевин (II, а-д) и N, N-диалкил-N’- (N’’, N’’-диалкиламидиносульфонил)мочевин (III, а-в)
|
№ соединения |
Выход, % |
Т. пл., °C |
ИК-спектр, v, см-1 |
|||
|
SO2 |
C=N |
С=О |
N-H |
|||
|
IIа |
98 |
121 |
1185, 1395 |
– |
1690, 1750 |
3040, 3315 |
|
IIб |
96 |
147 |
1185, 1390 |
– |
1695, 1760 |
3035, 3290 |
|
IIв |
96 |
124 |
1165, 1375 |
– |
1695, 1750 |
3095, 3225 |
|
IIг |
97 |
129 |
1190, 1370 |
– |
1700, 1760 |
3100, 3300 |
|
IIд |
99 |
126 |
1175, 1375 |
– |
1700, 1755 |
3070, 3285 |
|
IIIа |
99 |
67 |
1145, 1370 |
1625 |
1695 |
3200 |
|
IIIб |
99 |
65 |
1135, 1360 |
1615 |
1685 |
3185 |
|
IIIв |
99 |
141 |
1150, 1380 |
1630 |
1695 |
3225 |
Таблица 2
Данные элементного анализа N,N’-дизамещенных сульфонилмочевин (II, а-д) и N, N-диалкил-N’- (N’’, N’’-диалкиламидиносульфонил)мочевин (III, а-в)
|
№ сое- динения |
Найдено/вычислено, % |
Формула |
|||||
|
Эквивалент нейтрализации |
С |
Н |
Hlg |
N |
S |
||
|
IIа |
349,7 352,5 |
27,30 27,26 |
4,49 3,43 |
30,20 30,17 |
11,80 11,91 |
9,09 9,10 |
C8H12Cl3N3O4S |
|
IIб |
355,5 354,5 |
23,75 23,79 |
2,80 2,84 |
29,91 29,98 |
11,74 11,85 |
9,02 9,05 |
C7H10Cl3N3O5S |
|
IIв |
487,5 485,8 |
19,74 19,78 |
2,45 2,49 |
49,39 49,35 |
8,63 8,65 |
6,31 6,60 |
C8H12Br3N3O4S |
|
IIг |
488,75 487,7 |
17,29 17,24 |
2,12 2,07 |
49,20 49,15 |
8,53 8,62 |
6,59 6,57 |
C7H10Br3N3O5S |
|
IIд |
403,0 402,0 |
38,96 38,93 |
3,05 3,02 |
23,65 23,69 |
10,44 10,48 |
7,97 8,00 |
C13H12F5N3O4S |
|
IIIа |
– |
37,11 37,22 |
5,09 5,05 |
25,29 25,35 |
13,18 13,36 |
7,66 7,64 |
C13H21Cl3N4O3S |
|
IIIб |
– |
28,28 28,25 |
3,88 3,83 |
43,30 43,37 |
10,19 10,14 |
5,77 5,80 |
C13H21Br3N4O3S |
|
IIIв |
– |
31,17 31,20 |
4,10 4,05 |
25,19 25,11 |
13,20 13,23 |
7,59 7,57 |
C11H17Cl3N4O5S |
Заключение
Работа является продолжением изучения синтетических возможностей 2,6-дизамещенных 1,4,3,5-оксатиадиазин-4,4-диоксидов с целью получения биологически активных продуктов. Исследованы реакции диоксидов (I), содержащих пиперидиновый или морфолиновый заместитель в гетероцикле, с нуклеофильными реагентами – водой и аминами (пиперидин, морфолин). Найдены простые и эффективные пути синтеза N, N’-дизамещенных сульфонилмочевин (II) и N, N-диалкил-N’- (N’’, N’’-диалкиламидиносульфонил)мочевин (III).
Установлено, что с повышением акцепторных свойств одного из заместителей (R1) в исходном диоксиде (I) гидролиз протекает существенно легче, а аминолиз – даже бурно, что требует проведения синтеза при умеренном охлаждении. С учетом влияния электронных свойств заместителя R1 в работе опытным путем выявлены оптимальные условия проведения описанных превращений для серии диоксидов (I).
Синтетическая значимость разработанных методов получения сульфонилмочевин и амидиносульфонилмочевин с пиперидиновыми и морфолиновыми заместителями, кроме простоты проведения процессов синтеза и очистки полученных соединений, увеличивается вследствие высокой избирательности реакций. Продукты выделены с выходами, близкими к количественным.
Предварительные исследования образцов N, N-пентаметилен-N’-трихлорацетамидосульфонилмочевины и N,N-пентаметилен-N’-(N’’, N’’-пентаметилентрибромацетамидиносульфонил)мочевины показали высокую бактерицидную активность первого соединения и бактерицидную, а также высокую фунгицидную активность второй структуры. Полученные результаты представляют практическую значимость и являются основанием для продолжения работ в выбранном направлении.

