Проблема стабилизации и улучшения качества окружающей среды, обеспечения экологической безопасности населения от деятельности металлургических предприятий и ТЭЦ приобретает острый характер и требует незамедлительного решения [1]. В этой связи разработка новых технологий, позволяющих проводить глубокую очистку отходящих газов от SO2 с дальнейшей полной утилизацией парникового газа (СО2) из очищенных от серы газов ТЭЦ и металлургических предприятий, становится значимой не только в национальном, но и в международном масштабе.
Электрохимическое восстановление CO2 считается одним из самых привлекательных способов хранения возобновляемых источников энергии, так как количество CO2 может быть уменьшено до газообразного CO или жидкого топлива: муравьиная кислота, метанол и углеводороды, технология переработки которых хорошо развита [2–4]. Поскольку скорость электродных реакций быстро увеличивается при нагревании, в настоящее время процессу электрохимического восстановления CO2 до CO при высоких температурах уделяется особое внимание [5–7]. Высокотемпературный электролиз расплавленных карбонатов требует поиска решений, ввиду наличия серьезных проблем, связанных с материальной устойчивостью электролизера к агрессивным средам. В работах [8–10] показано, что механизм процесса электролиза сульфатно-карбонатных расплавов более сложный, чем механизм процесса электролиза чистых карбонатных расплавов, ввиду протекания значительного количества побочных реакций между сульфатами и карбонатами с образованием различных продуктов.
В настоящей работе приведены результаты технологических опытов по утилизации парниковых газов путем электролиза жидкого карбоната лития с получением чистого СО и кислорода.
Материалы и методы исследования
Технологические опыты проводили в сварной ячейке, изготовленной из титана.
Выбор и обоснование конструкции электролизера, электродов и методика проведения опытов базировалась на результатах термодинамического и электрохимического анализа и технологических опытов электролиза карбоната лития с получением СО, изложенных в работе [11].
Опыты проводились с рабочими электродами из титана и графита при 850 и 900 °C с использованием прибора VersaSTAT3–200 Princeton Applied Research (макс. 2,5 A) со скоростью сканирования 1–50 мВ/с. Для расчетов использовался программный пакет V3-Studio. Длительный электролиз проводился при плотности катодного тока – 132 мА/см2 и плотности анодного тока – 92 мА/см2.
Во всех опытах в качестве противоэлектрода служила графитовая пластина размером 40×20×10 мм. Соотношение плотности тока между рабочими электродами и противоэлектродом составляло 1:5.
Исходная масса Li2CO3 в ячейке – 2,52 ± ± 0,05 кг, глубина расплава – 100 ± 5 мм.
Свободный объем катодного и анодного пространства над расплавом – 900 ± 100 см3.
Анализ состава газа проводился с использованием хроматографа GOW-MAC серии 350 с детектором теплопроводности и двумя колонками: молекулярные сита (0,5 нм) и Porapaq Q. Типичный объем пробы составлял 5 см3. Точность определения состава газа +/- 0,5 %. Термогравиметрический анализ разложения Li2CO3 был проведен с использованием прибора TGA SDT Q600 V8.3.
Во время опыта электролит контактировал с СО2, который поглощался через поверхность. Скорость поглощения CO2 увеличивалась постепенно от начала электролиза, а через 10 ч была постоянной. Электролиз проводили в течение 120 ч непрерывно. За 700 ч общего времени работы изменения в плотности тока в сумме составляли 5 %. Это указывает на достижение равновесия между электрохимическим восстановлением карбонатного иона CO32– и поглощением расплавом газообразного СО2.
Титановый корпус ячейки, титановый катод и часть графитового анода, погруженного в расплав, во всех проведенных опытах признаков коррозии не показали.
Результаты исследования и их обсуждение
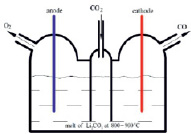
Конструкция электролизера и его общий вид показан на рис. 1.

а) б)
Рис. 1. Конструкция (а) и общий вид (б) электролизера
Ячейка изготовлена из сварных титановых пластин. Конструктивные размеры рабочего отсека (ширина × длина × высота): 120 × 110 × 260 мм. Ячейка внутри разделена стенками из титана на три секции – анодную, катодную и газопоглощающуюся.
Часть расплава контактировала в отдельном отсеке с чистым газом СО2 99,9 % при атмосферном давлении (рис. 1). В качестве электрода сравнения использовалась платиновая проволока или емкость с титаном. Из-за медленной коррозии Pt проволоки в расплаве каждый эксперимент с Pt проволокой проводился со свежим электролитом. Для каждого опыта использовался свежий Ti-электрод.
Составы газовой фазы, выделяющиеся в катодном и анодном пространстве, показаны на рис. 2.
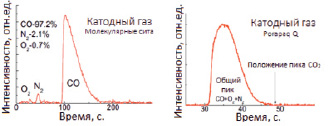
а) б)
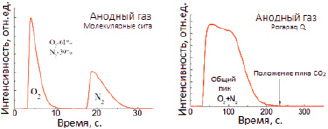
в) г)
Рис. 2. Результаты составов газовой фазы, выделяющихся в катодном и анодном пространстве: а) катодный газ на колонке с молекулярными ситами; б) катодный газ на колонке Porapaq Q (СО2 отсутствует);в) анодный газ на колонке с молекулярными ситами; г) анодный газ на колонке Porapaq Q (СО2 отсутствует)
Катодный газ содержал не менее 97 % CO (рис. 2, а). Концентрация CO2 была ниже предела обнаружения 0,5 %, (рис. 2, б). Анодный газ в установившемся режиме составил не менее 97 % O2 (рис. 2, в). Концентрация CO2 – ниже предела обнаружения (рис. 2, г).
Достигнута высокая эффективность электролиза, которая составила не менее 96 %.
Экспериментально измеренный методом линейной аппроксимации электрохимический потенциал разложения Li2CO3 при 800 и 900 °С, составил Ud = 0,866 ± 0,014 В (рис. 3), что соответствует эффективности электролиза 86 ± 5 % в условиях проведенных опытов.
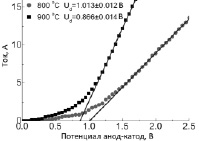
Рис. 3. Электрохимический потенциал разложения Li2CO3
Можно предположить существование двух возможных источников снижения эффективности электролиза. Во-первых, перенапряжение катодной реакции при 132 мА/см2 составила ~80 мВ, которая в условиях эксперимента была эквивалентна более половины общего перенапряжения равного 135 мВ. Во-вторых, немаловажный вклад в снижение эффективности процесса вносит омическое сопротивление графитового анода – 60 мВ.
Стабильность электролита
При нагревании на воздухе, Li2CO3 разлагается с образованием оксида лития и газа СО2, скорость которого зависит от парциального давления СО2 над расплавом.
Согласно результатам работы [12], равновесное давление CO2 над чистым Li2CO3 при 900 °C составляет 36 Торр, что намного выше парциального давления СО2 в атмосфере (0,24 Торр). Авторы работы [13] показали, что при парциальном давлении СО2, РCO2 = 1 атм. и температуре 1000 °C, карбонат лития сохраняет свою стабильность. Для проверки этих предположений были проведены экспериментальные исследования с использованием термогравиметрического анализа Li2CO3.
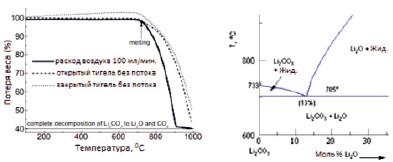
Количество исходной навески – 10 мг, подвергали термической обработке со скоростью нагрева 10 °C/мин. Установлено, что термическое разложение Li2CO3 увеличивается с ростом парциального давления CO2 над расплавом (рис. 4, а).
а) б)
Рис. 4. Термогравиметрический анализ разложения Li2CO3: а) зависимость потери веса Li2CO3 от температуры; б) фазовая диаграмма состояния Li2CO3 – Li2O [14]
Разложение всей навески Li2CO3 достигнуто при температуре 900 °C при подаче непрерывного потока воздуха, который удалял CO2 по мере его производства в закрытом тигле. Установленный факт легко интерпретируется исходя из фазовой диаграммы состояния Li2CO3 – Li2O [14]. Согласно фазовой диаграмме Li2CO3 – Li2O (рис. 4, б), предел растворимости Li2O в Li2CO3 при 900 °C составляет 24 % (моль.). Следовательно, в результате плавления Li2CO3 образуется раствор, представляющий растворенный в Li2CO3 оксид лития.
Если электролиз проводится при 900 °C без внешнего источника CO2, то Li2O накапливается в расплаве, и в конечном итоге суспензия мелких кристаллов Li2O размером 0,1 мм образуется у поверхности электролита.
Когда электролиз проводится при 900 °C с внешним источником СО2, расплав электролита находится в устойчивом состоянии в течение сотен часов и образования кристаллов не наблюдается. Кроме того, как упоминалось выше, концентрация CO2, в катодном и анодном пространстве электролизера ниже 0,5 %, то есть 3,8 Торр, хотя на аноде должен выделяться CO2. Это означает, что парциальное давление СО2, находящегося в равновесии с расплавом в электролизной ячейке, ниже 3,8 Торр. Поэтому СО2 газ, образующийся в результате анодной реакции и термического разложения, полностью поглощается расплавом.
Попытка измерить концентрацию Li2O в расплаве во время стационарного электролиза не увенчалась успехом, поскольку при охлаждении и последующем извлечении электролита он активно поглощает CO2 из атмосферы. Однако, в зависимости от количества переданного заряда и количества газообразных продуктов, комбинированных анодных и катодных реакций, концентрацию Li2O в расплаве при электролизе можно оценить следующим образом. Количество Li2O в расплаве Li2CO3 при стационарном режиме зависит как от процесса электролитического разложения Li2CO3, так и от его термического разложения. За 10 ч электролиза расплава в количестве 2,52 кг до достижения установившегося равновесного состояния, при токе 18 А, общий переносимый заряд 6,48×105 производит 3,36 моль кислорода при эффективности Фарадея 100 %. Если не учитывать поступающий извне CO2, который может взаимодействовать с оксидным ионом в расплаве с образованием карбоната, молярное отношение этого количества оксид-иона к карбонату составляет 0,1 (2,52 кг Li2CO3 составляет приблизительно 34 моля). Принимая во внимание количество CO2, поступающее извне, можно предположить, что установленное отношение будет ниже. Уравнение термического разложения Li2CO3 при 900 °C приводит к равновесному давлению CO2 над расплавом, РСО2= 37 Торр [12]. В случае, если объем анодного или катодного пространства электролизера (рис. 4) менее 1 л, то РСО2 = 37 Торр будет соответствовать 8×10-4 молей СО2. Тогда равное молярное количество кислорода будет присутствовать в расплаве. Это связано с тем, что давление газа CO2 над расплавом в катодном или анодном пространстве меньше, чем 3,8 Торр. Следовательно, количество ионов оксида лития в расплаве, образующееся в результате термического разложения карбоната лития, будет незначительным. При этом верхняя граница молярного отношения оксида лития к его карбонату в равновесном расплаве будет равна 0,1.
Полученные результаты по равновесному давлению CO2 над расплавом Li2O – Li2CO3 позволяют сделать важный вывод для практики. Поскольку равновесное давление СО2 в электродных отсеках электролизера составляет 3,8 Торр (0,5 % атм), расплав может абсорбировать CO2 из любой газовой смеси, содержащей парциальное давление CO2 выше 3,8 Торр. На практике это означает, что отходящие газы, содержащие 75–80 % N2, 15–20 % CO2, являются подходящим источником CO2 для электрохимического процесса, описанного выше.
Заключение
1. Установлено, что электролиз расплавленного Li2CO3 с Ti-катодом и графитовым анодом – эффективный метод для электрохимического восстановления CO2 до CO. Показано, что в течение длительного электролиза (сотни часов), эффективность процесса при 900 °C близка к 100 %.
2. Показано, что термодинамический КПД электролиза при 100 мА/см2 составляет не менее 85 %. Установлено, что, несмотря на некоторое разложение Li2CO3 до Li2O, концентрация Li2O в расплаве не достигает предела растворимости.
3. Установлено, что электролиз может осуществляться непрерывно до тех пор, пока есть источник газа с хотя бы несколькими процентами СО2.
Исследования проводились в рамках грантового финансирования Комитета науки Министерства образования и науки Республики Казахстан на 2020–2022 гг. по приоритетному направлению «Рациональное использование природных ресурсов, в том числе водных ресурсов, геологии, переработки, новых материалов и технологий, безопасных изделий и конструкций» проекта № AP08856384 «Разработка новой высокотехнологичной технологии утилизации SO2 и CO2 из отходящих газов ТЭЦ и металлургических предприятий с получением товарных продуктов».

