Рак молочной железы (РМЖ) является одним из основных онкологических заболеваний женщин во всем мире. Применение цитостатических препаратов позволило увеличить продолжительность жизни пациентов с РМЖ, тем не менее смертность остаётся высокой и только в России составляет более 20 000 чел. в год [1]. Основная причина прогрессирования заболевания – это развитие резистентности, поэтому поиск адъювантов, способных повысить чувствительность клеток опухоли к химиотерапевтическим препаратам, является актуальной проблемой современной онкологии. Одним из перспективных направлений исследований является изучение веществ, способных воздействовать на энергетический фенотип опухолевых клеток. Быстро делящимся клеткам рака необходимо большое количество энергии в виде АТФ для обеспечения своих нужд, и воздействие химиотерапевтических препаратов усиливает потребность опухолевых клеток в энергии. Поэтому снижение энергетических резервов клеток рака может существенно понизить их способность сопротивляться цитостатическому действию таких препаратов, как доксорубицин, циклофосфамид и паклитаксел, чаще всего применяемых в терапии РМЖ.
Берберин является природным соединением, добываемым из корней растений рода Berberis sp. и нашедшим широкое применение в качестве противомикробного и антидиарейного препарата в традиционной медицине. На современном же этапе развития фармакологии, благодаря многочисленным исследованиям, был раскрыт потенциал берберина для применения в разных областях терапии, в том числе, в качестве перспективного противоракового агента при лечении РМЖ [2]. Известно, что берберин способен подавлять пролиферацию и миграционную способность, а также вызывать апоптоз клеток рака in vitro [3]. Тем не менее эффективность берберина в качестве противоопухолевого монопрепарата является низкой [4], более перспективным представляется применение этого соединения в качестве адъюванта в сочетании с традиционными химиопрепаратами для лечения РМЖ [5–7]. Известно, что берберин обладает способностью снижать уровень сахара в крови за счёт подавления клеточного дыхания [8], тем не менее влияние этого соединения на энергетический фенотип клеток РМЖ остаётся слабо изученным. Понимание особенностей взаимодействия берберина и энергетического метаболизма опухолевых клеток может способствовать разработке более эффективных схем адъювантной терапии РМЖ.
Цель исследования: изучить влияние берберина на энергетический фенотип клеток рака молочной железы.
Материалы и методы исследования
Материалом для исследования послужили культуры клеток рака молочной железы BT20, BT474 и MDA-MB-453. Клетки выращивали в питательной среде DMEM (Gibco, США) с добавлением 10 % фетальной сыворотки коров (ФСК) (HyClone, США) при 37 °С и 5 % СО2. Исследование энергетического фенотипа проводили на анализаторе внеклеточных потоков Seahorse XFp Analyzer (Agilent, США) с использованием набора Seahorse XFp Cell Energy Phenotype Test (Agilent, США) согласно протоколу производителя. За день до проведения теста клетки исследуемых линий высаживали в количестве 2×104 на лунку в планшеты Seahorse XFp Analyzer в питательной среде DMEM с добавлением 10 % ФСК, в опытные лунки добавляли берберин до конечной концентрации 2,5 мкМ или 10 мкМ. Планшеты с клетками культивировали 24 ч при 37 °С и 5 % СО2, после чего среду культивирования заменяли на среду для анализа, представляющую собой низкобуферную питательную среду DMEM (Gibco, США) без фенола с добавлением глюкозы (5,5 мМ), пирувата (1 мМ) и глутамата (2 мМ). Далее клетки культивировали 1 ч при 37 °С и атмосферном содержании СО2, после чего проводили тест на Seahorse XFp Analyzer с введением в среду культивирования смеси метаболических ядов – олигомицина (1 мкМ) и карбонилцианид-4-(трифторометокси)-фенилгидразона (Carbonyl cyanide-4 (trifluoromethoxy) phenylhydrazone – FCCP) (2 мкМ). Исследование энергетического фенотипа клеток базировалось на измерении скорости поглощения кислорода (oxygen consumption rate – OCR) клетками и скорости закисления среды (extracellular acidification rate – ECAR), являющейся показателем интенсивности гликолиза, в фоне и при воздействии смеси метаболических ядов. Олигомицин блокирует АТФ-синтазу, что приводит к подавлению окислительного фосфорилирования и вызывает компенсаторное усиление гликолиза, о чём можно судить по росту скорости закисления среды. Величина превышения ECAR над фоном служит показателем гликолитического резерва клетки и её способности быстро задействовать его в ответ на стресс любой природы. Карбонилцианид-4-(трифторометокси)-фенилгидразон вызывает разобщение перехода протона через мембрану с синтезом АТФ, вследствие чего происходит рост скорости потребления кислорода, по уровню которого судят о целостности электронной транспортной цепочки и функциональной способности митохондрий. Совокупность фоновых значений и функционального резерва гликолиза и дыхания и составляет энергетический фенотип клеток.
Для оценки влияния берберина на жизнеспособность исследуемых культур ставили параллельный опыт с теми же условиями культивирования на культуральных флаконах с площадью поверхности 25 см2 (Т25), в которые пассировали по 2×106 клеток. Каждый вариант опыта был заложен в трех экспериментальных повторах. Через 24 ч клетки снимали 0,1 % раствором трипсина и определяли долю живых клеток на автоматическом счётчике Eve (NanoEnTek Inc, Корея) с применением окрашивания 0,4 % трипановым синим.
Сравнение средних значений измеряемых параметров контрольных и опытных образцов проводили с применением t-критерия Стьюдента. Принятый в исследовании уровень значимости α = 0,05.
Результаты исследования и их обсуждение
По результатам исследования было установлено, что культивирование с берберином в течение 24 ч не привело к существенным изменениям жизнеспособности клеток – во всех образцах доля живых клеток была выше 95 % и достоверно не отличалась в опыте и контроле по результатам трёх измерений.
Тем не менее культивирование с берберином оказало значительное воздействие на энергетический метаболизм клеток исследуемых линий. Во-первых, во всех клеточных линиях наблюдалось достоверное снижение фонового уровня потребления кислорода в опытных образцах по сравнению с контрольными, которое зависело от дозы берберина (рисунок, а). Так, для культуры MDA-MB-453 разница значения OCR между опытом и контролем (ΔOCR) составила ΔOCR2,5мкМ = 83,5 пмоль/мин (t2,5мкМ = 15,85, df = 8, р < 0,05) и ΔOCR10мкМ = 136,6 пмоль/мин (t10мкМ = 26,1, df = 8, р < 0,05), для культуры ВТ20 ΔOCR2,5мкМ = 88,2 пмоль/мин (t2,5мкМ = 12,6, df = 8, р < 0,05) и ΔOCR10мкМ = = 176,5 пмоль/мин (t10мкМ = 26,9, df = 8, р < 0,05) и для культуры ВТ474 ΔOCR2,5мкМ = = 131,01 пмоль/мин (t2,5мкМ = 22,7, df = 8, р < 0,05) и ΔOCR10мкМ = 210,5 пмоль/мин (t10мкМ = 37,5, df = 8, р < 0,05). Таким образом, клеточное дыхание оказалось наиболее чувствительным к действию берберина в линии ВТ474, так как здесь разница значения OCR между опытом и контролем оказалась наибольшей для обеих концентраций берберина.
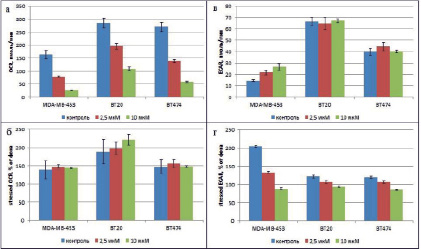
Показатели энергетического фенотипа клеточных линий РМЖ BT20, BT474 и MDA-MB-453 после инкубации в течение 24 ч в присутствии берберина: а – фоновое значение скорости потребления кислорода; б – значение скорости потребления кислорода при воздействии смеси метаболических ядов; в – фоновое значение скорости закисления среды; г – значение скорости закисления среды при воздействии смеси метаболических ядов. Значения на графиках представлены в виде среднее ± 95 % доверительный интервал по результатам 9 измерений для фоновых значений и 15 измерений для значений под нагрузкой
Воздействие FCCP во время проведения стресс-теста привело к росту скорости потребления кислорода до максимально возможного уровня, который определяется общим количеством работоспособных белков электрон-транспортной цепи в митохондриях клеток исследуемых клеточных линий РМЖ. При этом относительный рост OCR над фоновыми значениями при добавлении FCCP (так называемый резерв дыхания) во всех культурах клеток достоверно не отличался в контрольных и опытных образцах с добавлением берберина и составил около 50 % для линий ВТ474 и MDA-MB-453 и около 100 % в культуре ВТ20 (рисунок, б).
В отличие от скорости потребления кислорода, фоновое значение скорости закисления среды, являющееся показателем уровня гликолиза в покое, обнаружило различную реакцию на добавление берберина в трёх исследуемых культурах. В культуре клеточной линии MDA-MB-453 наблюдалось достоверное увеличение фонового значения ECAR в опытных образцах по сравнению с контролем (ΔECAR), которое было пропорционально дозе берберина и составило ΔECAR2,5мкМ = 7.01 мрН/мин (t2,5мкМ = 10,3, df = 8, р < 0,05) и ΔECAR10мкМ = 12.2 мрН/мин (t10мкМ = 13,1, df = 8, р < 0,05). В культурах же клеточных линий ВТ20 и ВТ474 фоновые значения ECAR достоверно не отличались между контрольными образцами и обоими вариантами опыта (рисунок, в).
Подавление митохондриальной АТФ-синтазы олигомицином привело к ожидаемому росту уровня гликолиза в образцах без добавления берберина во всех исследованных клеточных линиях. Причём в линии MDA-MB-453 новое значение ECAR (sECAR) в процентах от фона составило sECAR = 205 ± 2,3 %, в линии ВТ20 sECAR = 121,7 ± 3,8 % и в линии ВТ474 sECAR = 119,4 ± 3,2 %. Добавление же берберина привело к достоверному дозо-зависимому снижению резерва гликолиза во всех исследованных клеточных линиях, причём берберин в дозе 10 мкМ приводил к падению уровня sECAR ниже 100 % (рисунок, г). Для линии MDA-MB-453 разница значения sECAR между опытом и контролем (ΔsECAR) составила ΔsECAR2,5мкМ = 72 % (t2,5мкМ = 65,8, df = 14, р < 0.05) и ΔsECAR10мкМ = 205,04 % (t10мкМ = 122,4, df = 14, р < 0,05), для ВТ20 ΔsECAR2,5мкМ = 15 % (t2,5мкМ = 8,07, df = 14, р < 0,05) и ΔsECAR10мкМ = 28,3 % (t10мкМ = 19,8, df = 14, р < 0,05) и для ВТ474 ΔsECAR2,5мкМ = 12,8 % (t2,5мкМ = 8,6, df = 14, р < 0,05) и ΔsECAR10мкМ = 33,9 % (t10мкМ = 30,3, df = 14, р < 0,05). Таким образом, резерв гликолиза оказался наиболее чувствительным к действию берберина в культуре клеток MDA-MB-453, насколько можно судить по разнице между контрольными и опытными значениями sECAR для обеих доз берберина.
Угнетающее действие берберина на митохондриальное дыхание было показано в целом ряде работ, в том числе на клетках рака [9]. Предположительным механизмом действия является подавление дыхательного комплекса I [10]. Тот факт, что мишенью берберина в митохондриях являются именно белки электрон-транспортной цепи, косвенно подтверждается и в нашей работе. Мы обнаружили, что разница между стрессовым и фоновым значениями OCR (резерв дыхания) оказалась неизменной при добавлении берберина, что объясняется снижением максимальных значений OCR под действием FCCP пропорционально снижению базовых значений данного параметра. Такая реакция говорит об устойчивом «выключении» некоторого количества белков электрон-транспортной цепи под действием берберина.
Известно, что уменьшение количества АТФ, вызванное нарушением окислительного фосфорилирования, оказывает ряд эффектов, которые вносят вклад в противоопухолевую активность берберина. Так, снижение уровня АТФ относительно АМФ приводит к активации 5’АМФ-активируемой протеинкиназы (АМРК) [8], которая является центральным событием в цепи сигнальных взаимодействий, обуславливающих цитотоксическое действие берберина на клеточные культуры рака мозга [11], поджелудочной железы [9] и РМЖ [6]. В частности, на клетках РМЖ MCF-7 было показано, что низкие дозы берберина (менее 20 мкМ) через активацию АМРК приводят к подавлению синтеза транспортера P-gp по сигнальному пути AMPK-HIF-1α-P-gp, что усиливает чувствительность клеток к доксорубицину, однако без добавления цитостатика такие дозы берберина не сказываются на жизнеспособности клеток. Высокие же дозы берберина (более 20 мкМ) сами по себе вызывают апоптоз, связанный с активацией пути AMPK-p53 [6]. В своей работе мы также не наблюдали выраженного цитотоксического действия 2,5 мкМ и 10 мкМ берберина при культивировании в течение 24 ч на клетки РМЖ BT20, BT474 и MDA-MB-453. Для оценки же последствий вызванного берберином снижения соотношения АТФ/АМФ в этих линиях потребуются дальнейшие исследования АМРК зависимой сигнализации.
Известно, что подавление окислительного фосфорилирования приводит к компенсаторному усилению гликолиза, на чём, в частности, основан стресс-тест с добавлением олигомицина, который мы используем в данной работе. Эффект усиления гликолиза в ответ на подавление дыхания под действием берберина был описан для ряда нормальных клеток мыши и крысы [8], что породило интерес к берберину как перспективному антидиабетическому агенту, усиливающему поглощение глюкозы через усиление гликолиза. Также известны данные, подтверждающие усиление гликолиза в ответ на воздействие берберина для злокачественных клеток человека – культуре клеток гепатоцеллюлярной карциномы HepG2 [10]. Однако, как показал ряд исследований, действие берберина на гликолиз неоднозначно и в зависимости от биологических особенностей клеточной линии и условий культивирования берберин может не только стимулировать, но и подавлять гликолиз, как это было показано в культурах клеток рака яичника [12] и колоректального рака [13]. Полученные нами данные также говорят о противоречивом влиянии берберина на гликолиз в клетках РМЖ – дозозависимое усиление фонового уровня гликолиза в культуре клеток MDA-MB-453 было не характерно для линий BT20 и ВТ474. Возможным объяснением данного явления может быть изначально высокий уровень гликолиза в клетках культур BT20 и ВТ474, на фоне которого добавление берберина и отравление клеточного дыхания не вызвало дополнительно существенных изменений. Это предположение подкрепляется также тем фактом, что значение гликолитического резерва в этих культурах оказалось намного ниже, чем в культуре MDA-MB-453, даже в контрольных образцах. Добавление берберина привело к дальнейшему снижению резерва гликолиза во всех исследованных культурах, причём этот эффект был дозозависимым. Интересно отметить, что инкубация с берберином в дозе 10 мкМ, по-видимому, приводила к полному истощению энергетических резервов клетки, так как в ответ на добавление олигомицина наблюдался не рост гликолиза, как ожидалось, а, напротив, его угнетение. Подавление продукции лактата в данном случае можно связать с резким падением уровня АТФ, вызванным блокированием АТФ-синтазы во время стресс-теста, что привело, в свою очередь, к блокированию АТФ-зависимых стадий транспорта и метаболизма глюкозы.
Известные работы, в которых докладывают об успехах совместного применения берберина и химиотерапии при лечении рака молочной железы, описывают различные механизмы усиления чувствительности клеток к химиотерапии, такие как подавление экспрессии транспортера ксенобиотиков MDR1/P-gp [6], увеличение продукции активных форм кислорода [5], снижения активности XRCC1-опосредованной репарации ДНК [7] и др. Учитывая, что метаболизм клеток злокачественных новообразований часто зависит от аэробного гликолиза (так называемый эффект Варбурга) [12], можно сказать, что снижение гликолитических резервов клетки, обнаруженное в нашем исследовании, открывает новые возможности для изучения берберина в качестве перспективного адъюванта для химиотерапии.
Заключение
По результатам работы впервые было обнаружено, что помимо угнетения клеточного дыхания берберин вызывает снижение гликолитического резерва клеток рака молочной железы. Таким образом, берберин способствует формированию низкоэнергетического фенотипа с пониженной способностью сопротивляться стрессовым воздействиям, что делает это соединение перспективным адъювантом в химиотерапии рака молочной железы.

