Одним из научных направлений в экспериментальной гистологии является изучение закономерностей посттравматической регенерации тканей и регуляции их восстановительных потенций [1]. В ранее проведенных исследованиях показано, что имеются структурно-функциональные корреляции между клетками в воспалительной и регенерационной фазе раневого процесса. На всех этапах регенерации постоянно происходят изменения клеточного состава регенерата, которые характеризуются временными, качественными и количественными параметрами [1, 2]. При травме кожи с передачей кинетической энергии снаряда повреждаемым тканям регистрируется характерное для раневого процесса изменение клеточно-дифферонного состава соединительной ткани перинекротической области. Активация пролиферативной активности фибробластов на третьи сутки опыта в равной мере регистрируется как в рыхлой волокнистой, так и плотной волокнистой соединительных тканях кожи. В дальнейшем ведущими источниками регенерации становятся фибробласты рыхлой волокнистой соединительной ткани, что характеризует проявления регенерационного гистогенеза [1, 3, 4]. Одним из методов изучения закономерностей регенерации тканей является математическое моделирование, при этом проводится количественный и качественный анализ динамики раневого процесса на всех этапах заживления экспериментальной раны [5, 6]. Математическая модель позволяет персонализировать процесс заживления раны при механическом повреждении кожи.
Цель исследования – разработать и апробировать количественную модель межклеточных коопераций регенерата соединительных тканей кожи.
Материалы и методы исследования
Объектами исследования регенерационного гистогенеза служили соединительные ткани кожи лабораторных животных (крысы, n = 90; мыши, n = 50). Забор материала производили с учетом ранее установленных сроков гистологических изменений при нанесении различных видов повреждений в эксперименте (6 ч, 24 ч, на 3, 6, 15 и 25 сут).
Для гистологического исследования развития грануляционной ткани вырезали прямоугольный кожный лоскут так, чтобы в центре находился дефект кожи.
Для оценки клеточных элементов регенерата использовали комплекс гистологических исследований: световая и электронная микроскопия; одноволновая цитоспектрофотометрия, гистохимия и цитохимия, иммуногистохимия. Морфометрические методы применяли для регистрации количественных и качественных изменений в зоне формирующегося регенерата. Полученные результаты статистически обработали для последующего математического моделирования с целью персонализировать процесс заживления раны при механическом повреждении кожи [1].
Математическое моделирование методом линейного дискриминантного анализа позволило верифицировать клеточные изменения соединительных тканей кожи в раневом процессе [7, 8].
Обработка исходной информации в электронном виде осуществлялась в редакторе Exсel, а последующий статистический анализ – в программе статистического анализа Statistica 6.0.
Этапы математического моделирования включают следующую последовательность действий:
1. Обработки исходной информации в пакете Excel.
2. Расчет коэффициентов модели методом дискриминантного анализа в пакете Statistica 6.0.
3. Расчет статистической достоверности модели (p).
4. Апробация полученной количественной модели.
Количественная модель персонализированного течения раневого процесса представляет собой шесть линейных классификационных формул.
В общем виде они выглядят следующим образом:
ЛКФ1 = b0 + b1 × Х1 + b2 × Х2 + ....+ bk×Хk, (1)
где ЛКФ – линейная классификационная функция, b0 – константа; b1, b2, … bk – коэффициенты для количественных признаков Х1, Х2, … Хk; Х1, Х2, … Хk – значения количественных признаков модели.
Подставляя данные в линейные классификационные функции, производится классификация исходных показателей по максимальному значению, являющихся классифицирующим основанием [8].
Результаты исследования и их обсуждение
Качественные изменения клеток дифферона нейтрофилов периферической крови служит диагностическим критерием фазы воспалительной реакции в регенерационном гистогенезе и сопровождается цитохимическим обнаружением катионных белков. Повышение количества нейтрофильных гранулоцитов в периферической крови с высокой активностью катионных белков к 24 часам эксперимента статистически достоверно. Снижение фагоцитарной активности (снижение цитохимической активности катионных белков) нейтрофильных гранулоцитов регистрируется на третьи сутки и далее отмечается повышение вплоть до завершения эксперимента (25 сут). Что подтверждает факт наличия гетероморфии (активность катионных белков) в клеточной популяции нейтрофилов как у сегментоядерных, так и у палочкоядерных клеток.
В ранее проведенных исследованиях установлено, что «грануляционная ткань – это полидифферонная система, развивающаяся в тесном взаимодействии с кровеносными сосудами» [1]. Формирующийся регенерат содержит клеточные элементы различных дифферонов: лаброцитов, клеток макрофагического дифферона, лимфоцитов, определяя междифферонную гетероморфию. Ведущими клетками будут клетки фибробластической дифференцировки. Изменение клеточного состава грануляционной ткани связано с изменением соотношения гематогенных и соединительнотканных клеток в зоне регенерата. А именно фибробластов, макрофагов, эндотелиоцитов, лаброцитов, нейтрофилов, плазмоцитов. Преобладание зрелых, активно продуцирующих коллаген фибробластов устанавливается к 15-м суткам эксперимента. Электронно-микроскопически у таких клеток почти вся цитоплазма занята профилями гранулярной эндоплазматической сети.
К началу фазы дифференцировки (15-е сутки) эксперимента доля фибробластов составляет 76,16 ± 9,1 %. А также обнаруживается следующее количественное соотношение клеток гематогенного происхождения: нейтрофилы составляют 0,16 ± 0,37 %, макрофаги – 19 ± 3,45 %, лаброциты – 0,4 ± 0,7 %. Подтверждается выраженная внутридифферонная и междифферонная гетероморфия регенерата (рис. 1).
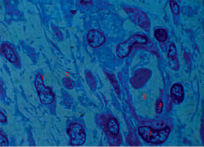
Рис. 1. Клеточные и тканевые элементы регенерата. 15-е сутки опыта. Полутонкий срез. Толуидиновый синий. Ув. 630. Обозначения: 1 – фибробласт, 2 – лимфоцит, 3 – просвет капилляра, 4 – эндотелиоцит, 5 – периваскулярная клетка
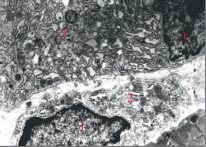
Рис. 2. Фибробласт регенерата. 15-е сутки. Ув. 8300. Обозначения: 1 – ядро, 2 – цитоплазма, 3 – гранулярная эндоплазматическая сеть
В клеточном регенерате клетки фибробластического дифферона преобладают среди клеточных дифферонов новообразованной соединительной ткани. В регенерате обнаруживаются нейтрофилы, макрофаги, лимфоциты, лаброциты, что обуславливает медленное снижение междифферонной и внутридифферонной гетероморфии.
К 25-м суткам в регенерате начинают преобладать зрелые фибробласты, их количественный показатель – 96,96 ± 1,27 %. Цитодифференцировка фибробластов сопровождается нарастанием объема канальцев гранулярной эндоплазматической сети, расширением просвета канальцев эндоплазматической сети, заполненных мелкозернистым содержимым, равномерным распределением последних по всей цитоплазме клетки. Наружная поверхность канальцев с многочисленными рибосомами (рис. 2). Встречаются высокодифференцированные клетки – фиброциты.
На первом этапе математического моделирования клеточного состава регенерата формировалась обучающая информация. Матрица обучающей информации создана на основе морфологического анализа клеточно-дифферонного состава перинекротической области раны экспериментальных животных (мыши), и группирующего признака – срока заживления раны (6 ч, 24 ч, 3, 6, 15 и 25 сут).
Сформированная грануляционная ткань имеет новые кооперации клеток, как по типу, так и по степени их дифференцировки. Это подтверждает целесообразность трактовки регенерационных процессов с позиции «функциональных гистионов» [1, 6]. Сложный состав клеточного регенерата закономерно изменяется во времени и позволяет персонализировать заживление раны при механическом повреждении кожи.
Среди ведущих клеточных типов в регенерате выделяют клетки системы крови (нейтрофильные лейкоциты, лаброциты) клетки макрофагического и фибробластического дифферонов, а также эндотелиоциты.
Количественные характеристики вышеназванных клеток закономерно изменяются во времени и могут служить надежными критериями для диагностики течения раневого процесса (таблица).
Содержание клеток в зоне регенерации (Х + Sх, %)
|
Клетки / Срок опыта |
Нейтрофильные лейкоциты |
Лаброциты |
Клетки макрофагического дифферона |
Клетки фибробластического дифферона |
|
6 ч |
49,8 ± 5,4 |
1,27 ± 0,19 |
0,09 ± 0,04 |
48,84 ± 3,1 |
|
24 ч |
62,4 ± 7,8* |
3,97 ± 0,04* |
5,9 ± 0,36* |
27,73 ± 1,4* |
|
3 сут |
19,2 ± 4,1* |
2,9 ± 0,07* |
59,3 ± 4,6* |
18,6 ± 2,9* |
|
6 сут |
1,8 ± 0,5* |
3,9 ± 0,16* |
31,4 ± 6,6* |
62,9 ± 9,3* |
|
15 сут |
0,09 ± 0,07 |
0,5 ± 0,02* |
19,6 ± 5,9* |
79,81 ± 8,5* |
|
25 сут |
0,1 ± 0,006* |
0,4 ± 0,04 |
8,1 ± 0,6* |
91,4 ± 10,6* |
Условные обозначения: * р ≤ 0,05.
На следующем этапе моделирования рассчитывались коэффициенты линейных функций для количественной модели (ЛКФ1-6) в модуле «Discriminant Analysis» программы Statistica 6,0. Полученные коэффициенты являются информационными признаками тканевых элементов регенерата.
После обработки введенных данных создавали количественную модель клеточного состава соединительнотканного регенерата, в которой были представлены данные для построения шести формул – соответствующие коэффициенты и константы. Использованные для вычисления значения линейно-классификационных функций и константы для каждого клеточного типа, вошедшего в модель.
В общепринятом виде модель имеет следующий вид:

На третьем этапе построения количественной модели клеточного состава соединительнотканного регенерата непосредственно решалась сама задача классификации по количественным показателям тканевых элементов раны. При сравнении динамики морфологических проявлений течения раневого процесса определялась фаза регенерационного гистогенеза по наибольшему значению ЛКФ.
Статистическая достоверность количественной модели определяли по точности классификации исходной статистической выборки с помощью полученных классификационных коэффициентов. Точность моделирования клеточного состава в зоне регенерации по указанным классификационным признакам достаточно велика (более 90 %).
Заключение
На разных этапах посттравматической регенерации тканей кожи имеется закономерное соотношение различных клеточных элементов, участвующих в воспалительной и регенерационной фазе раневого процесса [1, 9]. Математическое моделирование позволяет проводить количественный и качественный анализ динамики раневого процесса на всех этапах заживления экспериментальной раны [5]. Полученная количественная модель соотношения клеточных элементов в зоне регенерации представляет собой группу формул. Данная модель описывает возникновение, развитие и перестройку клеточного состава регенерата соединительных тканей, характеризуя временные особенности изменения их клеточного состава. При подстановке в формулы количественных показателей соединительнотканного регенерата полученные результаты позволяют персонализировать заживление раны при механическом повреждении кожи.

