В настоящее время активно ведутся исследования химии замещенных 2Н-хромен-2-онов и поиск путей построения новых соединений на их основе. Большой интерес к таким системам связан с широким распространением их в живой природе, например, хроменоновый гетерофрагмент встречается в структуре витамина Е. Также они отличаются высокой химической активностью. Соединения, содержащие хроменоновое ядро, проявляют множество различных, полезных для человека свойств, так, для них выявлена возможность ингибирования ВИЧ-интегразы [1–3], многочисленные исследования показывают, что хроменоны проявляют противоопухолевую [4–6] и антиоксидантную активность [7]. Модификация структуры хроменона позволит получить ранее неизвестные соединения, которые потенциально могут проявлять широкий спектр активности.
Хорошо известно, что 1,5-дикарбонильные соединения, включающие в свой состав хроменоновый фрагмент, являются запатентованными антикоагулянтными препаратами, такими как варфарин, неодикумарин и дикумарол [8], широко применяемыми в медицинской практике. Синтез новых систем, обладающих аналогичными свойствами, поможет расширить ряд антикоагулянтных препаратов, а также данные соединения потенциально могут обладать дополнительными полезными свойствами.
Материалы и методы исследования
Эксперименты в условиях in vitro выполнены и обработаны по стандартной методике, представленной в работах [9, 10].
Результаты исследования и их обсуждение
Нами были получены новые представители ряда несимметричных 1,5-дикетонов–димедонилхроменонов по ранее опубликованной методике [11], трехкомпонентной конденсацией 4-гдирокси-2Н-хромен-2-она 1, димедона 2 и различных ароматических альдегидов 3 в присутствии L-пролина как катализатора.
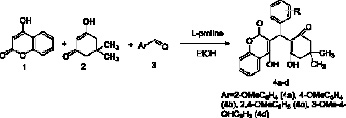
Участие L-пролина представляется следующим образом: молекула катализатора взаимодействует с альдегидом 1, образуя иминиевую соль, после чего происходит атака соли димедоном 2, что приводит к сложнопостроенному интермедиату. На следующем этапе происходит нуклеофильная атака интермедиата 4-гидрокси-2Н-хромен-2-оном 3 и отщепление молекулы катализатора, что приводит к образованию конечной молекулы – 4-гидрокси-3-((2-гидрокси-4,4-диметил-6-oксоциклогекс-1-ен-1-ил)арилметил)-2H-хромен-2-онов 4a-d с выходом 59–78 %.
Строение 4-гидрокси-3-((2-гидрокси-4,4-диметил-6-oксоциклогекс-1-ен-1-ил)(2-метоксифенил)метил)-2H-хромен-2-она 4а подтверждено методами ЯМР 1Н, 13С, HSQC, HMBC спектроскопии. Так, в сильном поле ЯМР 1Н спектра наблюдаются: сигнал, принадлежащий протонам эквивалентных метильных групп при 1,17 м.д., синглеты при 2,36 и 2,45 м.д., относятся к протонам двух метиленовых звеньев димедонильного фрагмента. Метоксильная группа в арильном заместителе проявляется при 3,63 м.д., сигнал протона при узловом третичном атоме углерода расположен при 5,82 м.д. Сигналы восьми протонов двух ароматических колец фиксируются в области 6,83–7,99 м.д. В слабопольной области спектра находятся два уширенных синглета, принадлежащие двум протонам енолизированных гидроксильных групп хроменонового и димедонильного фрагментов, их уширение, вероятно, вызвано образованием водородных связей (рис. 1).
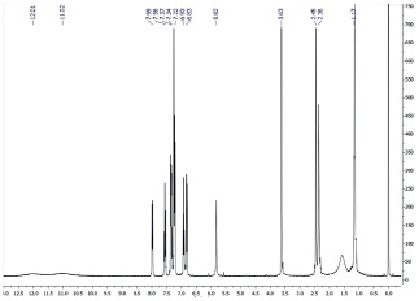
Рис. 1. ЯМР 1Н спектр 4-гидрокси-3-((2-гидрокси-4,4-диметил-6-оксоциклогекс-1-ен-1-ил)(2-метоксифенил)метил)-2H-хромен-2-она (4а), СDCl3
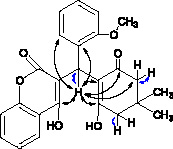
Рис. 2. Ключевые корреляционные взаимодействия в HSQC (синий) и HMBC (черный) спектрах соединения 4а
В двумерном корреляционном спектре HSQC (рис. 2) наблюдается ключевой сигнал 5,82/31,60 м.д., принадлежащий узловому CH фрагменту, отмечаются сигналы двух неэквивалентных друг другу СН2 звеньев димедонильного фрагмента при 2,45/43,87 м.д. и 2,36/49,76 м.д. В HMBC спектре ключевыми являются взаимодействия протона при третичном узловом атоме углерода с углеродом карбонильной группы димедонильного фрагмента при 5,82/189,6 м.д., с атомами углерода при гидроксильных группах хроменонового и димедонового фрагментов 5,82/163,4 и 5,82/157,1 м.д. соответственно, с различными атомами углерода в ароматическом заместителе, а также с одним из метиленовых звеньев при 5,82/49,9 м.д., всё это подтверждает предложенную структуру для продукта 4а (рис. 2).
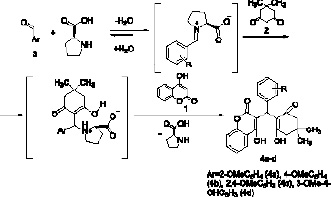
При использовании орто-гидроксибензальдегидов 3 превращение протекает аналогично вышеописанному, однако происходит О-гетероциклизация, имеющая место ввиду наличия сближенных гидроксильной группы альдегидного фрагмента и карбонильной группы димедонильного фрагмента, что позволяет получить конденсированные системы 9-(4-гидрокси-2-oксo-2H-хромен-3-ил)-3,3-диметил-2,3,4,9-тетрагидро-1H-ксантен-1-онов 5a-е выходом 63–81 %.
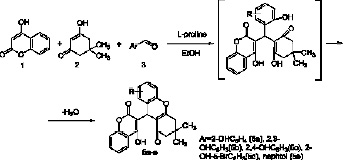
В сильнопольной области ЯМР 1Н спектра (рис. 3) соединения 5a наблюдаются два синглета при 1,06 и 1,16 м.д., характерные для диастереотопных метильных групп димедонильного фрагмента молекулы, два метиленовых звена молекулы проявляются в виде двух дублет дублетов при 2,36 и 2,61 м.д. (J = 18,8 Гц). Метиновый протон даёт сигнал при 5,08 м.д. В интервале 7,03–8,02 м.д. находятся сигналы 8 протонов ароматических циклов молекулы. В слабом поле при 11,06 м.д. расположен уширенный сигнал протона енольной гидроксильной группы хроменонового фрагмента.
Рис. 3. ЯМР 1Н спектр 9-(4-гидрокси-2-oксo-2H-хромен-3-ил)- 3,3-диметил-2,3,4,9-тетрагидро-1H-ксантен-1-oна (5а), СDCl3
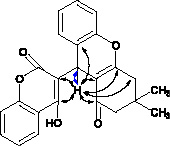
Рис. 4. Ключевые корреляционные взаимодействия в HSQC (синий) и HMBC (черный) спектрах соединения 5а
В HSQC спектре ключевым сигналом является кросспик 5,08/28,4 м.д., отвечающий за контакт непосредственно связанных метинового протона и узлового атома углерода (рис. 4) В HMBC отмечаются кросспики, говорящие о взаимодействии метинового протона с метиленовым звеном и карбонильной группой димедонильного фрагмента при 5,08/49,4 м.д. и 5,08/202,1 м.д. соответственно, а также множественные контакты метинового протона с атомами углерода ароматического заместителя и хроменонового гетерофрагмента, что позволяет утвердить предложенную структуру.
Соединения под номерами 4d, 5d проявили антиагрегационную активность на уровне ацетилсалициловой кислоты (показатель МА на уровне значений АСК при p < 0.05) (таблица). При этом соединение 5d, аналогично препарату сравнения, сокращало латентный период, а соединение 4d пролонгировало латентный период, удлиняя реакцию высвобождения тромбоцитов на 7,8 % относительно контроля (p < 0,05). Следует отметить, что соединение 5d и эффективнее аспирина в 5,5 раза (p < 0,05) и в 3,7 раза (p < 0,05) соответственно уменьшает скорость агрегации тромбоцитов. Соединения 4с, 5а и 5b также сокращали скорость агрегации тромбоцитов в среднем в 2 раза (p < 0,05), однако по уровню антиагрегационной активности они уступают ацетилсалициловой кислоте и значения их антиагрегационной активности находится в диапазоне 1,2–8,9 %. Среди изученных производных данного ряда соединения под лабораторным шифром 4b, 5c и 5e проявили проагрегантный эффект, усиливая агрегацию тромбоцитов. Наиболее выраженный проагрегантный эффект регистрировался у соединения 5с, который на 4,9 % интенсивнее вызывал агрегрегацию тромбоцитов по сравнению с контролем и соответствовал значению препарата сравнения – этамзилату. Пролонгируя реакцию высвобождения тромбоцитов (6,7 %, p < 0,05), увеличивая скорость агрегации тромбоцитов (23,2 %, p < 0,05) соединение 5с сокращает время достижения максимума агрегации тромбоцитов (10,3 %, p < 0,05). Соединения 4а-b,d, 5a-c, проявили антикоагуляционную активность, однако она составила меньше 10, и по данной активности уступали гепарину натрия.
Влияние соединений 4a-d, 5a-e и препарата сравнения на показатели агрегации тромбоцитов, тромбоцитов, коагуляционное звено гемостаза и плазменное звено гемостаза в условиях in vitro, Ме (0,25–0,75)
|
№ |
Латентный период, % к контролю |
Максимальная амплитуда, % к контролю |
Скорость агрегации, % к контролю |
Время достижения МА, % к контролю |
Удлинение АПТВ, % к контролю |
|
4a |
-5,1 (4,6–7,4)*,# |
-8,3 (6,9–9,1)*,# |
-17,4 (15,4– 20,2)* |
-5,7 (4,4–6,8)## |
9,5 (9,2–11,2)* |
|
4b |
+1,3 (1,1–2,3)#,†† |
+2,4 (1,6–3,5)## |
-4,2 (3,6–6,1)†† |
-3,2 (2,3–5,3)## |
7,5 (6,4–8,3)* |
|
4c |
-1,6 (1,2–3,4) |
-1,2 (0,7–1,4) ## |
-29,8 (23,4– 30,3)**,# |
-3,3 (2,7–4,7)## |
3,1 (2,3–4,6) |
|
4d |
+7,8 (7,1–9,5)*,# |
-11,4 (10,3–12,1)* |
-57,2 (54,3–61,1)**,## |
-17,3 (14,3–18,9 )**, ## |
9,2 (7,5–10,3)* |
|
5a |
-6,7 (6,2–7,9)*, # |
-7,4 (6,4–10,9)* ,# |
-27,1 (24,4- 30,2)**,# |
-16,3 (14,5–18,4)**,## |
10,4 (8,7–11,6)* |
|
5b |
-5,4 (5,2–7,4)* |
-8,9 (7,4–9,5)*,# |
-20,3 (17,8–22,4)**,# |
-4,8 (4,1–6,2)## |
7,3 (5,6–8,4)* |
|
5c |
+6,7 (6,1–8,7)*,#, †† |
+4,9 (3,5–6,8)*,## |
+23,2 (21,4–283)**,##,†† |
-10,3 (7,6–11,5)*,##,† |
4,5 (4,5–6,3)* |
|
5d |
-8,7 (7,2–10,3)*,# |
-11,7 (8,4–12,7)* |
-37,5 (34,5– 38,7)**,## |
-11,7 (8,6–13,4)*,## |
1,4 (1,1–2,3) |
|
5e |
+6,4 (5,3–8,5)*,##,†† |
+1,1 (0,5–2,5)## |
+2,1 (1,4–2,7)##,† |
-6,4 (4,7–7,6)##,† |
2,7 (1,9–3,6) |
|
Ацетилсалициловая кислота |
-2,1 (1,1–2,6) |
-13,7 (10,8–16,4)* |
-10,5 (7,5–12,4)* |
+10,5 (8,7–13,4)* |
– |
|
Этамзилат |
-6,3 (4,5–8,7)*,# |
+3,6 (2,4–4,6)*,## |
+8,5 (6,2–10,4)*,## |
-2,3 (1,6–4,5)## |
– |
|
Гепарин Na |
– |
– |
– |
– |
20,3 (19,7–21,4)** |
Примечание. Латентный период представлен для агрегации тромбоцитов, индуцированной коллагеном; *р < 0,05, **р < 0,001 – в сравнении с контролем; #р < 0,05, ##р < 0,001 – в сравнении с ацетилсалициловой кислотой; †р ≤ 0,05, ††р ≤ 0,001 – в сравнении с этамзилатом; n = 6.
Заключение
Таким образом, проведен синтез новых представителей ряда 1,5-дикетонов – структурных аналогов антикоагулятных препаратов, а также выявлено, что соединения 4а-b, d, 5a-c проявляют антикоагулятную активность, соединения 5d, 4с, 5а и 5b существенно уменьшают скорость агрегации тромбоцитов. Также обнаружено, что соединения 4b, 5c и 5e оказывают проагрегантный эффект – усиливают и ускоряют агрегацию тромбоцитов.

