Оксиэтиламмония метилфеноксиацетат (ОМ) является активным компонентом зарегистрированных в Российской Федерации препаратов «Трекрезан», «Трекресил», «Трекрезолид», обладающих иммуностимулирующей и адаптогенной активностью. ОМ стимулирует выработку α- и γ- интерферонов, влияет на иммунный статус организма за счёт активации клеточного и гуморального звеньев иммунитета, стимулирует фагоцитарную активность макрофагов [1–3]. В связи с широкой востребованностью в медицинской практике препаратов, обладающих указанными фармакологическими свойствами, проведение клинических исследований, направленных на глубокое и всестороннее изучение характеристик применяемых препаратов ОМ, является актуальной задачей. Важным аспектом клинических исследований лекарственных препаратов является оценка их фармакокинетических параметров; вместе с тем сведения, представленные в доступных источниках, недостаточны для формирования полного представления о фармакокинетике ОМ у человека. Исходя из изложенного, в задачи выполненной работы входила оценка фармакокинетики ОМ в рамках пилотного клинического исследования на минимальном числе субъектов с дальнейшим использованием полученной информации для планирования будущих исследований, включая сравнительные исследования фармакокинетики, проводимые в рамках разработки и регистрации воспроизведённых лекарственных препаратов. Поскольку ОМ представляет собой соль, образованную органическим основанием (триэтаноламин, ТЭА) и органической кислотой (2-(2-метилфенокси)-уксусная кислота, МФУК), исследование выполнено исходя из предположения о том, что в биологических средах происходит диссоциация ОМ и возможно измерение концентраций ТЭА и МФУК как индивидуальных соединений (рис. 1).
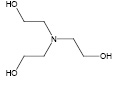
ТЭА
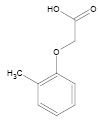
МФУК
Рис. 1. Структурные формулы ТЭА и МФУК
Целью представленного исследования является оценка фармакокинетических параметров оксиэтиламмония метилфеноксиацетата у здоровых добровольцев при однократном пероральном приёме в форме таблеток.
Материалы и методы исследования
В исследование были включены три добровольца (двое мужчин и одна женщина) в возрасте от 23 до 32 лет, клинически здоровые, с нормальными показателями физикального обследования, без отклонений в показателях клинического и биохимического анализов крови и клинического анализа мочи, с отрицательными тестами на ВИЧ, гепатиты B и C, сифилис, COVID-19, наркотические и сильнодействующие вещества и алкоголь (а также отрицательный тест на беременность для субъекта женского пола), не осуществлявших донорскую сдачу крови в течение предшествующих двух месяцев, не принимающих участия в других клинических исследованиях, не принимавших за последние 60 дней лекарственные препараты, оказывающие выраженное влияние на гемодинамику, функцию печени и другие системы, не принимавших за последние 72 часа алкоголь, пищу и напитки, содержащие метилксантины (чай, кофе, кола, энергетические напитки, шоколад), а также цитрусовые и клюкву (включая соки, морсы).
Добровольцы принимали натощак препарат «Трекрезан», таблетки, 200 мг, производитель АО «Фармпроект», Россия.
Отбор проб крови для оценки фармакокинетики осуществлялся в следующие моменты времени: 0 минут (до приёма препарата), через 15 мин, 30 мин, 45 мин, 1 ч, 1 ч 30 мин, 2 ч, 3 ч, 4 ч, 6 ч, 9 ч, 12 ч, 18 ч, 24 ч, 48 ч, 72 ч после приёма препарата (всего 16 отборов проб). Кровь отбирали с помощью постоянного катетера, установленного в вену, в вакуумные центрифужные пробирки объёмом 5 мл, содержащие трикалиевую соль этилендиаминтетрауксусной кислоты (К3ЭДТА) в качестве антикоагулянта. После отбора крови образцы центрифугировали при температуре +4 °С, полученную плазму помещали в криопробирки, замораживали и хранили при температуре не выше –40 °С.
В качестве аналитического стандартного образца для количественного определения ТЭА и МФУК использовали оксиэтиламмония метилфеноксиацетат, субстанция-порошок; производитель АО «Активный компонент» (Россия), серия АКП 750921, дата производства 09.2021, годен до 10.2023.
Подготовку проб осуществляли методом осаждения белков (депротеинизации). К аликвоте плазмы объёмом 100 мкл добавляли 400 мкл ацетонитрила, перемешивали, подвергали центрифугированию, надосадочную жидкость использовали для анализа.
Количественное определение ТЭА и МФУК было выполнено с помощью системы высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектором Shimadzu LCMS-8060 (Shimadzu Corporation, Япония). В связи с выраженными различиями физико-химических свойств рассматриваемых веществ проводился раздельный анализ с использованием индивидуальных аналитических методик.
Хроматографическая колонка Luna 3 µm HILIC 200Å, 150 x 3.0 mm (Phenomenex), компоненты подвижной фазы: ацетонитрил, 40 мМ формиат аммония, вода деионизированная ультрачистая; ионизация электрораспылением; детектирование в режиме мониторинга выбранных реакций превращения иона прекурсора в дочерние ионы: m/z 150 → 70, 150 → 88, 150 → 132, полярность – положительная. Диапазон измеряемых концентраций ТЭА: 5 – 3750 нг/мл.
Хроматографическая колонка Luna 5 µm C18 100Å, 100 x 4.6 mm (Phenomenex), компоненты подвижной фазы: метанол, 0,1% муравьиная кислота, вода деионизированная ультрачистая; ионизация электрораспылением; детектирование в режиме мониторинга выбранных реакций превращения иона прекурсора в дочерний ион: m/z 166 → 107, полярность – отрицательная. Диапазон измеряемых концентраций МФУК: 0,05 – 15 мкг/мл.
Расчёты концентраций выполнены по уравнению калибровочного графика (8 калибровочных точек) с использованием линейной функции.
Расчёты фармакокинетических параметров и статистическая обработка данных выполнены с использованием пакета программного обеспечения Phoenix™ WinNonlin® 8.3 (CERTARA, Pharsight, США). Методами некомпартментного анализа рассчитаны следующие фармакокинетические параметры: Cmax – максимальная концентрация в плазме, Tmax – время достижения максимальной концентрации, AUC0-t – площадь под фармакокинетической кривой «концентрация – время» от момента приема препарата до времени последнего отбора крови, при котором концентрация препарата равна или выше нижнего предела количественного определения, AUC0-∞ – площадь под кривой «плазменная концентрация – время» с момента приёма препарата до бесконечности, отношение AUC0-t / AUC0-∞, λz – константа скорости терминальной элиминации, Т½ – период полувыведения из плазмы. Графические иллюстрации фармакокинетических профилей построены с помощью Microsoft Excel 2016.
Результаты исследования и их обсуждение
Все включённые добровольцы завершили исследование, нежелательные явления отсутствовали. Образцы плазмы крови были отобраны и проанализированы согласно запланированным процедурам.
На рис. 2 представлены примеры хроматограмм ТЭА и МФУК: образцы бланковой (интактной) плазмы, полученные от здоровых доноров, не принимающих лекарственные препараты, и модельные калибровочные образцы на уровне нижнего предела количественного определения (НПКО) и верхнего предела количественного определения (ВПКО). На хроматограммах бланковых образцов отсутствуют значимые пики в области времени удерживания аналитов, что свидетельствует о достаточной селективности аналитических методик. В диапазонах измеряемых концентраций наблюдалась линейная зависимость площади хроматографических пиков от концентраций аналитов; расчётные значения концентраций калибровочных образцов находились в пределах 15% от номинальных.
В табл. 1 и 2 приведены фармакокинетические параметры ТЭА и МФУК, рассчитанные по результатам выполненных измерений концентраций.
На рис. 3 и 4 представлены усреднённые фармакокинетические кривые; данные кривые имеют профиль, характерный для однократного перорального приёма, включающий фазу абсорбции (нарастания концентрации), достижения максимального значения концентрации с последующим снижением (фаза элиминации). На фармакокинетических кривых отсутствуют какие-либо специфические особенности (не наблюдается мультипикового характера кривой, многостадийной элиминации, признаков энтерогепатической циркуляции и т.п.).
Полученные результаты подтверждают исходно сформулированное предположение о том, что при фармакокинетическом анализе ТЭА и МФУК могут рассматриваться как индивидуальные соединения.
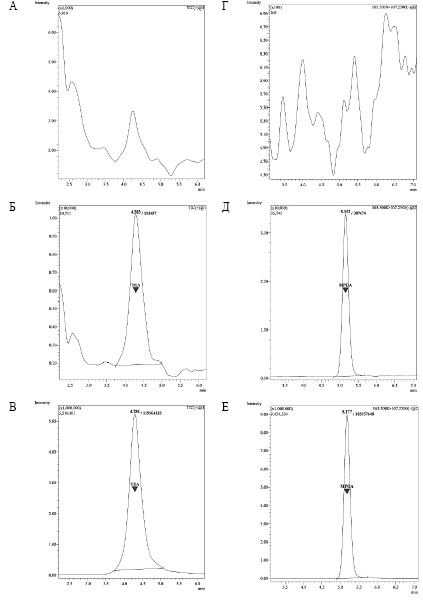
Рис. 2. Примеры хроматограмм ТЭА и МФУК: А, Г – бланковые образцы; калибровочные образцы: Б – 5 нг/мл ТЭА (НПКО), В – 3750 нг/мл ТЭА (ВПКО), Д – 0,05 мкг/мл МФУК (НПКО), Е – 15 мкг/мл МФУК (ВПКО)
Таблица 1
Фармакокинетические параметры ТЭА
|
№ добр. |
Cmax, нг/мл |
Tmax, ч |
AUC0-t, нг∙ч/мл |
AUC0-∞, нг∙ч/мл |
AUC0-t / AUC0-∞ |
λz, ч-1 |
Т½, ч |
|
01 |
1065,8 |
1,00 |
8456,9 |
8509,2 |
99,38 |
0,09597 |
7,22 |
|
02 |
754,4 |
0,50 |
5304,6 |
5426,0 |
97,76 |
0,15909 |
4,36 |
|
03 |
859,2 |
1,50 |
5819,5 |
6046,2 |
96,25 |
0,13938 |
4,97 |
|
M |
893,1 |
1,00 |
6527,0 |
6660,5 |
97,80 |
0,13148 |
5,52 |
|
SD |
158,4 |
0,50 |
1691,0 |
1630,8 |
1,57 |
0,03230 |
1,51 |
|
%CV |
17,74 |
50,00 |
25,91 |
24,48 |
1,60 |
24,56 |
27,34 |
M – среднее арифметическое, SD – стандартное отклонение, % CV – коэффициент вариации
Таблица 2
Фармакокинетические параметры МФУК
|
№ добр. |
Cmax, мкг/мл |
Tmax, ч |
AUC0-t, мкг∙ч/мл |
AUC0-∞, мкг∙ч/мл |
AUC0-t / AUC0-∞ |
λz, ч-1 |
Т½, ч |
|
01 |
11,171 |
1,00 |
64,953 |
65,726 |
98,82 |
0,18645 |
3,72 |
|
02 |
9,753 |
0,25 |
21,603 |
21,774 |
99,22 |
0,38118 |
1,82 |
|
03 |
13,116 |
0,50 |
65,563 |
67,443 |
97,21 |
0,11590 |
5,98 |
|
M |
11,347 |
0,58 |
50,707 |
51,647 |
98,42 |
0,22784 |
3,84 |
|
SD |
1,688 |
0,38 |
25,206 |
25,886 |
1,06 |
0,13740 |
2,08 |
|
%CV |
14,88 |
65,47 |
49,71 |
50,12 |
1,08 |
60,31 |
54,28 |
M – среднее арифметическое, SD – стандартное отклонение, % CV – коэффициент вариации
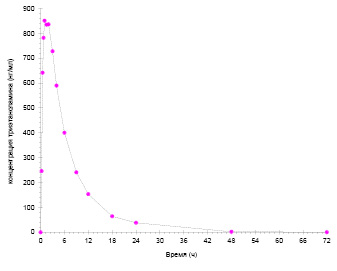
Рис. 3. Усреднённая фармакокинетическая кривая ТЭА
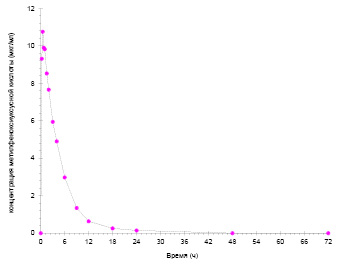
Рис. 4. Усреднённая фармакокинетическая кривая МФУК
Наблюдаемые концентрации МФУК более чем в 10 раз превышают концентрации ТЭА: средние значения Cmax составляют 11,347 мкг/мл и 0,8931 мкг/мл (893,1 нг/мл) для МФУК и ТЭА соответственно. При этом ТЭА характеризуется более медленным всасыванием и выведением по сравнению с МФУК: средние значения Tmax составляют 1,00 ч и 0,58 ч для ТЭА и МФУК соответственно, средние значения T1/2 – 5,52 ч и 3,84 ч для ТЭА и МФУК соответственно. В течение периода наблюдения 72 ч наблюдается полная элиминация обоих соединений. Исходя из полученных данных, достаточный период отбора проб для полного описания фармакокинетических кривых ТЭА и МФУК составляет 48 ч.
Заключение
В выполненной работе получены сведения, уточняющие недостаточно описанные в ранее опубликованной литературе параметры фармакокинетики ОМ. Применяемая биоаналитическая методология соответствует поставленным задачам, обладая достаточными параметрами чувствительности и селективности. Данные результаты и методические подходы могут быть использованы при планировании и проведении будущих клинических исследований препаратов, содержащих ОМ, с учётом актуальных требований Надлежащей клинической практики (GCP) и регуляторных документов [4, 5].

