Актуальность исследования продиктована необходимостью поиска внешних воздействий и их параметров для увеличения выхода клеток важных объектов биотехнологии и синтезируемых ими продуктов. Дрожжевые аскомицеты Saccharomyces cerevisiae являются широко используемым модельным организмом в генетических, иммунобиологических и биотехнологических исследованиях [1], и быстрое получение их культур является важным этапом в практике. Выделенные когда-то из водной среды дрожжевые базидиомицеты Rhodotorula rubra также представляют собой важный продуцент каротиноидов [2] и экзополисахаридов, имеющих фармакологическую ценность [3].
В микробиологической практике СВЧ- обработка применяется как один из методов ингибирующего воздействия на микроорганизмы. Однако при проведении многофакторного эксперимента [4] были обнаружены параметры воздействия СВЧ-излучения низкой мощности, активирующие рост дрожжей Sac. cerevisiae и Rh. rubra. Были получены следующие параметры работы установки, при которых наблюдалась активация роста дрожжей: мощность излучения 600 Вт, температура разогрева взвеси дрожжей от 26,0 до 35,0°С, время обработки от 5 до 8 с. Результаты многофакторного эксперимента были положены в основу настоящих исследований по определению оптимальных режимов СВЧ-обработки с целью повышения активности штаммов-продуцентов.
Цель работы – изучить воздействие выбранных режимов СВЧ-обработки на рост и активность штаммов-продуцентов биотехнологических производств Sac. cerevisiae и R. rubra.
Материалы и методы исследования
Для обработки СВЧ-излучением низкой плотности мощности использовали культуры дрожжей Sac. cerevisiae ВКМ Y-378 и Rh. rubra ВКМ Y-341. Готовили взвеси дрожжей Sac. cerevisiae и Rh. rubra в физиологическом растворе массой 5,00±0,01 г каждая в стеклянных пробирках. Перед обработкой определяли начальную температуру каждой пробирки с культурами (22,1±0,1 °С). Для культивирования обработанных и контрольных образцов использовали жидкую питательную среду бульон Сабуро объёмом 25 мл, куда добавляли по 1 мл взвеси дрожжей. Культивирование проводили в колбах объёмом 100 мл, в динамических условиях при частоте вращения колб n = 100 об/мин и температуре 23,0±0,1°С в биореакторе Sartorius Stedim CERTOMAT® CTplus [5]. Для определения концентрации клеток в приготовленных взвесях культур и в культуральной жидкости при выращивании обработанных и контрольных образцов дрожжей, использовали метод прямого подсчёта клеток в счётной камере Горяева [6].
Концентрация взвеси дрожжей для обработки составила 6,7·106 КОЕ/мл. Увеличение биомассы фиксировали через 24 ч от начала культивирования. Определение концентрации биомассы дрожжей проводили через 48 ч от начала культивирования. Биохимическую активность клеток изучали при помощи теста силы подкисления. Данный тест косвенно указывает на скорость биохимических реакций в клетках по скорости снижения рН в растворе глюкозы.
Результаты исследования и их обсуждение
Результаты изменения количества клеток дрожжей после обработки представили в табл. 1.
Установлено, что значительный прирост биомассы дрожжей наблюдался для всех опытов внутри оптимального диапазона по сравнению с контрольным образцом. При этом максимальное увеличение биомассы наблюдали в опыте № 2. Концентрация клеток в нём возросла до 24,3·106 КОЕ/мл, что в 2,7 раза больше, чем в контроле. Помимо указанных выше данных значительное увеличение количества клеток в культуральной жидкости наглядно продемонстрировано при микроскопии дрожжей (рис. 1). Данное наблюдение указывает на то, что СВЧ-излучение низкой мощности способно оказывать активизирующее влияние на скорость деления клеток. При подсчёте живых клеток определили, что наибольший процент их содержится в образцах № 1 и 2, что указывает на значимость влияния факторов времени и температуры воздействия на метаболизм исследуемых дрожжей.
Результаты определения биохимической активности клеток дрожжей представлены на рис. 2.
Снижение величины рН растворов происходит быстрее в опытах № 1 и 2, что указывает на большую биохимическую активность дрожжей при данных условиях обработки в сравнении с контролем. Следует отметить снижение метаболической активности культуры в опытах № 3 и 4.
На вторые сутки культивирования определяли количество биомассы дрожжей весовым методом после отделения клеток при помощи центрифугирования и высушивания их на воздухе (рис. 3).
Таблица 1
Параметры обработки и концентрация клеток дрожжей Sac. cerevisiae
|
Режим обработки |
Температура нагрева, °С |
Мощность работы магнетрона, Вт |
Время обработки, с |
Концентрация клеток |
||
|
КОЕ∙106/мл |
Живые клетки, % |
Мёртвые клетки, % |
||||
|
Контроль* |
22,1±0,1 |
– |
– |
8,7 |
70,2 |
29,8 |
|
1 |
27,1±0,1 |
600 |
5 |
15,8 |
80,3 |
19,7 |
|
2 |
29,2±0,1 |
6 |
24,3 |
80,4 |
19,6 |
|
|
3 |
31,0±0,1 |
7 |
18,2 |
74,3 |
25,7 |
|
|
4 |
34,3±0,1 |
8 |
14,2 |
65,2 |
34,8 |
|
* – необработанный образец
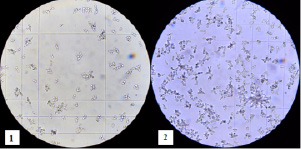
Рис. 1. Количество клеток дрожжей Sac. cerevisiae: 1 – контрольный образец, 2 – образец, обработанный в опыте № 2
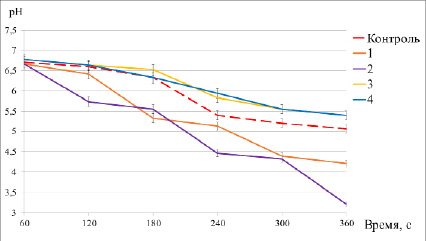
Рис. 2. Интенсивность снижения рН раствора глюкозы: 1–4 – номера опытов
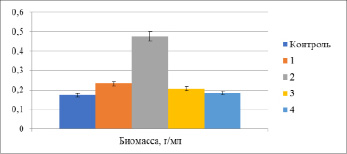
Рис. 3. Количество биомассы дрожжей Sac. cerevisiae
Таблица 2
Оптимальные параметры СВЧ-обработки культуры Rh. rubra
|
Режим обработки |
Температура нагрева, °С |
Мощность работы магнетрона, Вт |
Время обработки, с |
Концентрация клеток |
||
|
КОЕ∙106/мл |
Живые клетки, % |
Мёртвые клетки, % |
||||
|
Контроль* |
22,1±0,1 |
– |
– |
6,2 |
68,1 |
31,9 |
|
1 |
26,0±0,1 |
600 |
5 |
17,1 |
77,2 |
22,8 |
|
2 |
29,3±0,1 |
6 |
23,0 |
78,7 |
21,3 |
|
|
3 |
30,1±0,1 |
7 |
21,0 |
70,1 |
29,9 |
|
|
4 |
35,4±0,1 |
8 |
17,4 |
64,7 |
35,3 |
|
* – необработанный образец
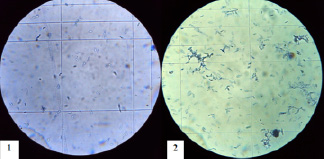
Рис. 4. Количество клеток дрожжей Rh. rubra 1 – контрольный образец, 2 – образец, обработанный в опыте № 2

Рис. 5. Изменение пигментации дрожжей Rh. rubra к – контроль, 1–4 – образцы, обработанные в опытах № 1–4 соответственно
Наибольшее количество биомассы образовывалось при температуре облучения 29,2±0,1°С и времени 6 с, что было больше, чем в контроле, в 2,8 раз, тем самым подтверждая ранее полученные результаты (рис. 2).
Результаты воздействия СВЧ-излучения низкой мощности на пигментированные дрожжи Rh. rubra представлены в табл. 2.
Значительное увеличение биомассы дрожжей наблюдали во всех обработанных образцах по сравнению с контролем.
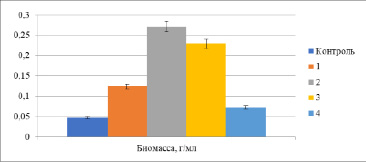
Рис. 6. Количество биомассы дрожжей Rh. rubra
При этом максимальный прирост биомассы наблюдали при температурах 29,3±0,1°С и 30,1±0,1°С, концентрация клеток в которых возросла в 3,7 и в 3,4 раз по сравнению с необработанным образцом. Также увеличение количества клеток продемонстрировано на рис. 4 при микроскопии.
При подсчёте живых клеток установили, что наибольший процент их содержится в образцах, обработанных при температурах 26,0±0,1 °С и 29,3±0,1 °С (образцы № 1 и 2).
Также после обработки СВЧ-излучением в оптимальном диапазоне отметили усиление пигментации всех обработанных культур в сравнении с контролем, что косвенно указывает на увеличение биохимической активности клеток (рис. 5), что, вероятно, связано с откликом дрожжей Rh. rubra на воздействие излучения защитной реакцией увеличения синтеза пигментов-каротиноидов.
Выход биомассы дрожжей Rh. rubra определяли на вторые сутки культивирования (рис. 6).
Показано, что наибольший прирост биомассы соответствовал культурам, обработанным в диапазонах от 29,3±0,1°С (6 с) до 30,1±0,1°С (7 с). Концентрация биомассы в этих образцах оказалась выше в 5,7 и в 4,8 раз по сравнению с контролем.
Заключение
На основе анализа полученных результатов показано, что СВЧ-излучение низкой мощности оказывает стимулирующее действие на клетки дрожжей Rhodotorula rubra и Saccharomyces cerevisiae в определённых диапазонах обработки, а именно: мощность излучения 600 Вт, температура нагрева от 26,0 до 35,0°С, время обработки от 5 до 8 с. При этом диапазон усиления активности для исследуемых объектов не различался. Для обоих видов дрожжей стимулирующее воздействие СВЧ-излучения подтверждено в диапазоне мощности работы магнетрона 600 Вт, при 6–7 с при температуре не выше 30,1 °С. Показано, что данные параметры обработки приводят к максимальному увеличению количества живых клеток дрожжей и их биохимической активности, что может быть использовано в перспективе для стимулирования промышленных штаммов-продуцентов БАВ Saccharomyces cerevisiae и Rhodotorula rubra.

