Рак яичников занимает лидирующую позицию среди причин смерти от гинекологических заболеваний. Это связано с диагностированием на поздних стадиях заболевания, низким процентом пятилетней выживаемости и высоким процентом химиорезистентности [1]. Канцерогенез является сложным многокомпонентным процессом, в котором большое значение имеет нарушение гомеостаза активных форм кислорода (АФК) [2] и апоптоза, тесно связанных между собой в единой патогенетической цепи. Запуск апоптоза раковых клеток является целью различных схем терапии рака, например химиотерапии, лучевой терапии, иммунотерапии или таргетной терапии [3]. Резистентность опухоли к терапии зависит в том числе от способности клеток к индукции апоптоза.
Каспаза-2 обладает уникальными характеристиками, свойственными инициаторным, эффекторным и неапоптотическим каспазам. Она играет роль в запуске и усилении апоптоза, активируясь при воздействии генотоксического стресса, активации рецепторов смерти, стресса эндоплазматического ретикулума, метаболических изменений, тепловом шоке и воздействии ряда патогенов [4]. Каспаза-2 играет неапоптотическую роль в остановке клеточного цикла, стабильности генома и подавлении опухоли, действует как супрессор опухоли и участвует в химиотерапевтическом ответе [5].
Каспаза-2 обладает уникальным свойством запускать митохондриальный путь апоптоза посредством расщепления проапоптотического белка Bid и последующей пермеабилизацией внешней мембраны митохондрий. Каспаза-2 участвует в запуске апоптоза, вызванном митохондриальным оксидативным стрессом [6] и стрессом эндоплазматического ретикулума (ЭПР-стрессом).
На внешней мембране митохондрий и мембранах эндоплазматического ретикулума располагаются цепи микросомального окисления цитохрома b5 и цитохрома Р450. Не найдено работ, в которых была бы изучена возможная связь активности каспазы-2 и систем микросомального окисления, однако гипотетически такая связь может существовать на уровне кислородного метаболизма и регуляции апоптоза. Цель исследования – изучить активность микросомальных редуктаз цитохром b5-редуктазы (CYB5R) и цитохром З450-редуктазы (CYPOR) на культуре интактных и дефицитных по каспазе-2 клетках рака яичников при помощи оригинальной методики люцигенин-активированной хемилюминесценции со стимулами NADH и NADPH.
Материалы и методы исследования
Исследовали следующие культуры клеток рака яичников Caov-4 (ATCC, США): интактные (Wild Type, WT), нокаутные по гену каспазы-2 с помощью метода CRISPR/Cas9 (Cr) и экспрессирующие малую шпилечную РНК, снижающую синтез каспазы-2 (Sh). Клетки центрифугировали в течение 10 мин при 3000 g при комнатной температуре, далее осадок ресуспензировали раствором Хенкса, стабилизированном 2 мМ HEPES. Надосадочную жидкость использовали для контрольных экспериментов.
Оценку активности микросомальных редуктаз в культурах клеток проводили с помощью люцигенин-активированной хемилюминесценции на 12-канальном приборе Lum-1200 («ДИСофт», Россия). В пластиковую кювету вносили 800 мкл суспензии культуры клеток (количество клеток в пробе 800 000 ) и регистрировали базальную хемилюминесценцию в течение 3 мин при t = 37 °С. Далее добавляли 200 мкл люцигенина (динитрат 10,10’-диметил-9,9’-биакридиния, Sigma, США, конечная концентрация 200 мкМ) и продолжали запись сигнала 3–5 мин. Далее к пробам добавляли NADH или NADPH (Sigma, США) в конечной концентрации 100 мкМ и регистрировали ответ на стимулы в течение не менее 30 мин. Общий объем пробы в кювете составил 1,000 мл. Стационарные уровни стимулированной хемилюминесценции АNADH и АNADPH отражают активность NADH-зависимой цитохром b5-редуктазы и NADPH-зависимой цитохром Р450-редуктазы, соответственно. Эксперименты были проведены на двух образцах культур, каждую хемилюминограмму регистрировали в трех повторах.
Результаты исследования и их обсуждение
При добавлении стимулов к суспензии клеток Caov-4 WT уровень хемилюминесценции возрастал на порядок, и кинетика была близка к стационарной. Аналитический сигнал обусловлен прямым восстановлением люцигенина при помощи редуктаз с образованием супероксидного анион-радикала, к которому чувствителен люцигенин как хемилюминесцентный зонд. Таким образом, уровень хемилюминесценции отражает активность редуктаз. Для дикого типа активность цитохром b5-редуктазы была примерно в полтора-два раза выше активности цитохром Р450-редуктазы (рис. 1, а). В контрольном опыте с надосадочной жидкостью сигнал хемилюминесценции был близок к нулю (рис. 1, б).
В клетках Caov-4, дефицитных по каспазе-2, уровень NADH-стимулированной хемилюминесценции был ниже, чем в клетках WT (рис. 2, а), причем этот эффект не зависел от метода редактирования генома (рис. 2, б). Уровень NADPH-зависимой хемилюминесценции был практически одинаков в клетках WT, Sh и Cr.
Таким образом, в дефицитных по каспазе-2 клетках рака яичников снижена примерно в 1,5–2 раза активность CYB5R, но не CYPOR.
Накопленные данные свидетельствуют о том, что каспаза-2 связана как с митохондриально-опосредованным апоптозом, в том числе вызванным стрессом ЭПР, так и с метаболическими процессами, в том числе с метаболизмом активных форм кислорода.
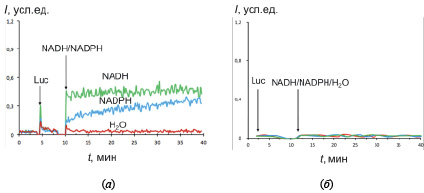
Рис. 1. Хемилюминограммы клеток дикого типа (а) и надосадочной жидкости (б) в присутствии люцигенина (Luc) NADH или NADPH; в качестве контроля к клеткам добавляли 10 мкл дистиллированной воды
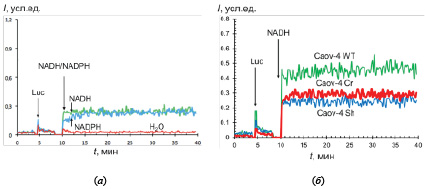
Рис. 2. Хемилюминограммы клеток Caov-4 (Sh), дефицитных по каспазе-2, в присутствии люцигенина (Luc) и NADH или NADPH (а); в качестве контроля к клеткам добавляли 10 мкл дистиллированной воды. Хемилюминограммы NADH-стимулированной хемилюминесценции для клеток Caov-4 дикого типа (WT) и с дефицитом по каспазе-2 (Cr и Sh) (б)
Каспаза-2, скорее всего, через факторы транскрипции FoxO, регулирует реакцию на оксидативный стресс in vivo. У мышей с нокаутом по каспазе-2 уровень окислительного стресса в белках был существенно выше, чем у животных дикого типа, а экспрессия генов транскрипционных противовоспалительных факторов FoxO1 и Nrf2 была снижена. Также при дефиците каспазы-2 не было усиления активности антиоксидантных ферментов глутатионпероксидазы и супероксиддисмутазы в ответ на обработку прооксидантом [7]. Таким образом, дефицит каспазы-2 приводит к усилению окислительного стресса потому, что не активируется механизм антиоксидантной защиты, что делает организм более уязвимым к экзогенным факторам и может частично объяснить более короткую продолжительность жизни мышей, дефицитных по каспазе-2 [7].
С другой стороны, АФК являются проапоптотическим фактором. Окислительный стресс приводит к накоплению белка p53 с последующей активацией каспазы-2, что, в свою очередь, инициирует апоптоз через митохондриальный путь в нейрональных стволовых клетках [8]. Ключевая роль активных форм кислорода в опосредованном каспазой-2 апоптозе подтверждается тем фактом, что антиоксиданты N-ацетилцистеин и кверцитин блокировали апоптоз и последовательную активацию каспазы-2 и каспазы-3 в раковых клетках [9]. В частности, может быть задействован путь АФК -> PERK (панкреатическая киназа эндоплазматического ретикулума) -> eIF2α (фактор инициации трансляции 2 эукариотического типа) -> каспаза-2 [10].
Стресс эндоплазматического ретикулума (накопление белков с нарушением укладки) приводит к активации проапоптотических белков BCL-2, BAX и BAK на внешней митохондриальной мембране, запуская таким образом апоптоз, и каспаза-2 участвует в этом, расщепляя BID в ответ на стресс эндоплазматического ретикулума, что приводит к потере потенциала на митохондриальной мембране; таким образом, ее ингибирование ее повышает устойчивость к апоптозу. Механизм апоптоза через BID и каспазу-2 реализуется также при окислительном стрессе. Таким образом, каспаза-2 участвует в передаче сигналов при ЭПР-индуцированном апоптозе для запуска митохондриального пути апоптоза [11].
Подведем итог: а) дефицит каспазы-2 способствует развитию окислительного стресса за счет ингибирования антиоксидантного ответа; б) окислительный стресс приводит к апоптозу, опосредованному каспазой-2; в) при стрессе эндоплазматического ретикулума каспаза-2 выступает как участник, передающий сигнал к митохондриальному апоптозу.
Цепь цитохрома Р450 располагается на мембранах эндоплазматического ретикулума. NADPH-зависимая цитохром P450-редуктаза (CYPOR) восстанавливает цитохром Р450, цитохром b5, гемоксигеназу, сквален-монооксигеназу, 7-дегидрохолестерол редуктазу, при этом образуются супероксидный анион-радикал и пероксид водорода. Цепь цитохрома b5 локализуется на мембранах эндоплазматического ретикулума, на внешней мембране митохондрий и мембранах комплекса Гольджи. NADH-зависимая цитохром b5-редуктаза (CYB5R) участвует в синтезе холестерина, элонгации жирных кислот, гидроксилировании ксенобиотиков и стероидных гормонов, поддерживает в восстановленном состоянии аскорбат и коэнзим Q10, защищая клетку от апоптоза [12]. Митохондриальная CYB5R локализуется на внешней мембране и в межмембранном пространстве. Она участвует, в частности, в синтезе липидов в митохондриях адипоцитов [13]. С другой стороны, CYB5R может действовать как прооксидантный фермент. Активация CYB5R, связанной с липидными рафтами, приводит к повышенной продукции супероксидного анион-радикала, что переводит апоптоз мозжечковых гранулярных клеток в необратимую фазу [14].
В литературе не найдено работ, изучающих взаимосвязь каспазы-2 и цитохром b5-редуктазы. Возникает ряд вопросов. Во-первых, в каком именно компартменте произошло снижение активности или концентрации CYB5R – митохондриальном, компартменте ЭПР или в комплексе Гольджи. При этом митохондриальная цитохром b5-редуктаза может быть как внешнемембранной, так и межмебранной, активность которой зависит от эффективности транслокации. Поскольку каспаза-2 тесно связана как с митохондриями, так и эндоплазматическим ретикулумом, ответ на этот вопрос следует искать специальными исследованиями, выделяя митохондрии и микросомальную фракцию из клеток, дефицитных по каспазе-2. Второй вопрос – за счет чего произошло снижение активности (или концентрации) CYB5R. Этот фермент является участником антиоксидантной защиты, и наши данные согласуются с ранее полученными результатами, свидетельствующими, что при дефиците каспазы-2 снижена активация антиоксидантных ферментов супероксиддисмутазы и глутатион-пероксидазы в ответ на окислительный стресс [15]. Каспаза-2 и CYB5R являются многофункциональными ферментами, участвующими в метаболизме активных форм кислорода, других метаболических процессах (обмен липидов и углеводов), в регуляции апоптоза. В целом они действуют в разных направлениях – активация каспазы-2 усиливает апоптоз и окислительный стресс, активация CYB5R противодействует апоптозу и окислительному стрессу. Если снижение активности каспазы-2 приводит к снижению активности CYB5R, возможно, эти ферменты связаны единой регуляцией, механизм которой предстоит выяснить.
Заключение
Отсутствие или снижение экспрессии гена каспазы-2 приводит к снижению активности цитохром b5-редуктазы в клетках рака яичника, что позволяет выдвинуть гипотезу о том, что эти ферменты связаны через пока еще невыясненные сигнальные пути. Предстоит определить, в каком пуле CYBR5 и по какому механизму произошло снижение активности. Поскольку в аспекте апоптоза и окислительного стресса каспаза-2 и CYB5R действуют разнонаправленно, практическое значение заключается в том, что при разработке методов терапии рака резистентных опухолей нужно учитывать влияние обоих ферментов.
Авторы благодарят канд. биол. наук Г.С. Копеину за предоставленные образцы клеток и ценные советы при обсуждении результатов.

