В последнее время одной из серьезных проблем современной медицины является множественная лекарственная устойчивость патогенов, в качестве эффективных и безопасных антибактериальных, антимикробных средств рассматриваются наночастицы серебра (НЧС), которые могут проявлять также инсектицидные и фунгицидные свойства и которые можно получить с помощью экстрактов растений. Включение наночастиц Ag в состав материала придает ему выраженные антимикробные и фунгицидные свойства, а использование экстрактов растений предполагает биобезопасность и экологическую чистоту производства металлических НЧ: химические и физические методы, применяемые для получения НЧ, часто дороги и потенциально опасны для окружающей среды [1, 2].
Ряд полученных таким образом наночастиц (например, серебра, цинка и др.) проявляют антибактериальные и фунгицидные свойства, что делает их перспективными для использования в медицине [3, 4].
Так, описаны наночастицы серебра, полученные с использованием экстракта Tridax procumbens (тридакс), обладающие сильной антимикробной активностью в отношении Escherichia coli, Shigella dysenteriae и Vibrio cholera. Наночастицы серебра, полученные с использованием экстрактов шишек Pinus thunbergii (сосна Тунберга), проявляли антибактериальное действие в отношении различных грамположительных и грамотрицательных сельскохозяйственных патогенов, таких как Pseudomonas syringae, Xanthomona soryzae, Burkholderia glumae и Bacillus thuringiensis. Серебряные наночастицы, полученные с использованием экстрактов латекса Euphorbianivulia (молочай), токсичны для линии клеток A549 рака легкого человека. Наночастицы серебра, синтезированные в Nerium oleander (олеандр обыкновенный), обладали сильным ларвицидным действием против личинок переносчика малярии Anopheles stephensi [5].
Цель исследования – разработка перспективных для медицины биологически активных веществ и антимикробных препаратов из экстрактов одуванчика лекарственного (Taraxacum officinale Wigg.) и лопуха войлочного (Árctium tomentosum Mill.), содержащих наночастицы серебра.
Материалы и методы исследования
Основным параметром, характеризующим взаимоотношения между микробом и антимикробным препаратом, является величина минимальной подавляющей концентрации (МПК) препарата. То есть МПК определяют как минимальную концентрацию, подавляющую видимый рост микроба. Антибактериальную активность данных образцов для определения МПК проводили по методике, описанной в приказе Минздрава Кыргызской Республики «Об утверждении методических рекомендаций по определению чувствительности микроорганизмов к антимикробным препаратам» от 25.02.2016, № 139. Исследования проводили на базе диагностической микробиологической лаборатории Ошского городского центра Госсанэпиднадзора.
В данной работе исследованы образцы экстрактов двух растений, в которых были получены наночастицы серебра (НЧС): лопуха войлочного (Arctium tomentotosumMill.) и одуванчика лекарственного (Taraxacum officinale Wigg.), описанные нами ранее [6].
На рис. 1 представлены фото экстракта одуванчика (1) и образцы (2–5) при добавлении к экстракту растворов нитрата серебра (НС) (а), и соответствующие им полосы поглощения (ПП) в УФ-области (б). Из ПП можно сделать заключение, что наиболее интесивные пики образуются при соотношениях (4:4) и (2:6).
На рис. 2 представлены фото экстракта лопуха (1) и образцы (2–5) при добавлении к экстракту растворов НС (а) и соответствующие им полосы поглощения (ПП) в УФ-области (б).
В экстрактах лопуха образование НЧС происходит при соотношениях ЭЛВ:НС 4:4 и 2:6 (рис. 2, б).
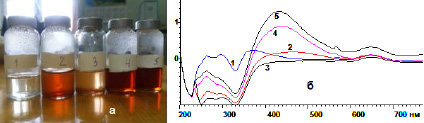
Рис. 1. а) 1 – экстракт одуванчика лекарственного (ЭОЛ) (Taraxacum officinale Wigg.); 2 – ЭОЛ: нитрат серебра (НС) 7:1; 3 – ЭОЛ:НС (6:2); 4 – ЭОЛ:НС (4:4); 5 – ЭОЛ:НС (2:6); б) UV-VIS-спектры: 1 – ЭОЛ; 2 – ЭОЛ:НС (7:1); 3 – ЭОЛ:НС (6:2); 4 – ЭОЛ:НС (4:4); 5 – ЭОЛ:НС (2:6)
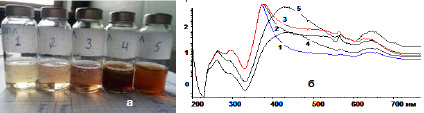
Рис. 2. а) 1 – экстракт лопуха войлочного (ЭЛВ) (Arctium tomentosum Mill.); 2 – ЭЛВ: нитрат серебра (НС) 7:1; 3 – ЭЛВ:НС (6:2); 4 – ЭЛВ:НС (4:4); 5 – ЭЛВ:НС (2:6); б) UV-VIS-спектры: 1 – ЭЛВ; 2 – ЭЛВ:НС (7:1); 3 – ЭЛВ:НС (6:2); 4 – ЭЛВ:НС (4:4); 5 – ЭЛВ:НС (2:6)

Рис. 3. Приготовление образцов для инкубации (А) и измерение зон подавления роста на чашках с измерительной линейкой (Б)
Результаты тестов на микробиологическую активность водного экстракта лопуха и экстрактов лопуха, содержащих НЧС в соотношениях экстракт: НС (4:4), (2:6), и их разведенных образцов приведены в табл. 1–3, экстракта одуванчика и экстрактов одуванчика, содержащих НЧС в соотношениях экстракт: НС (4:4), (2:6) – в табл. 4–6.
Определение антибактериальной активности разбавленных образцов экстрактов, содержащих НЧС, проводилось методом диско-диффузии в агар на газоне тест-культур (рис. 3, А). Заранее готовили диски из фильтровальной бумаги с размером со стандартного диска и стерилизовали при 180 °С, затем пропитывали диски исследуемыми образцами, помещали на засеянную тестовой культурой микроорганизмов поверхность с оптимальной питательной средой и культивировали при 37 °С в течение суток. После инкубации оценивали наличие или отсутствие видимого роста в мм диаметра (рис. 3, Б).
Таблица 1
Микробиологическая активность водного экстракта лопуха (Árctium tomentosum Mill.) и разведенных образцов по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов
|
Тест-культуры |
Экстр. лопуха, мм |
Разведение экстр. лопуха и зоны подавления роста тест-культур в мм |
|||
|
1:10 |
1:20 |
1:50 |
1:100 |
||
|
Bacillus cereus |
– |
– |
– |
– |
– |
|
Bacillus subtillis |
– |
– |
– |
– |
– |
|
Escherichia coli |
– |
– |
– |
– |
– |
|
Salmonella abony |
– |
– |
– |
– |
– |
|
Pseudomonas aeruginosa |
– |
– |
– |
– |
– |
|
Staphylococcous aureus |
– |
– |
– |
– |
– |
|
Candida albicans |
– |
– |
– |
– |
– |
Таблица 2
Микробиологическая активность водного экстракта лопуха (Árctium tomentosum Mill.) с наночастицами серебра (ЭЛ:НС4:4) и разведенных образцов по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов
|
Тест-культуры |
ЭЛ:НС(4:4), мм |
Разведения препарата и зоны подавления роста тест-культур, мм |
|||
|
1:10 |
1:20 |
1:50 |
1:100 |
||
|
Bacillus cereus |
5 |
– |
– |
– |
– |
|
Bacillus subtillis |
5 |
– |
– |
– |
– |
|
Escherichia coli |
5 |
– |
– |
– |
– |
|
Salmonella abony |
5 |
– |
– |
– |
– |
|
Pseudomonas aeruginosa |
– |
– |
– |
– |
– |
|
Staphylococcous aureus |
– |
– |
– |
– |
– |
|
Candida albicans |
10 |
– |
– |
– |
– |
Результаты исследования и их обсуждение
Из данных табл. 1 можно видеть, что экстракт лопуха и его разведенные образцы индифференты ко всем протестированным микроорганизмам.
Экстракты лопуха (табл. 2) с содержанием НЧС при соотношении ЭЛВ:НС (4:4) индифференты к Pseudomonas aureginosa и Staphylococcous aeurus, а к остальным проявляет активность до 5 мм, а к Candida albicans – 10 мм, однако при разведении эти экстракты к этим микроорганизмам индифферентны.
Экстракты лопуха (табл. 3) с содержанием НЧС при соотношении ЭЛВ:НС (2:6) проявляют активность ко всем испытанным микроорганизмам (табл. 6), однако при разведении экстракты к этим микроорганизмам также индифферентны.
Из анализа данных этой таблицы можно видеть, что чистый экстракт одуванчика проявляет активность только относительно Candida albicans (10 мм и 5 мм – при разведении 1:10), а к остальным микроорганизмам индифферентны (табл. 4).
Однако для экстракта одуванчика (Taraxacum officinale Wigg.) с наночастицами серебра при соотношении (ЭОЛ+НС, 4:4) и разведенных образцов картина меняется. Данная смесь индифферентна только по отношению к Salmonella abony; к остальным микроорганизмам активность ее значительна и наибольшего значения она достигает для Candida albicans от 30 мм без разведения и от 26 мм до 18 мм – при разведении (табл. 5).
Таблица 3
Микробиологическая активность водного экстракта лопуха (Árctium tomentosum Mill.) с наночастицами серебра (ЭЛВ+НС, 2:6) и разведенных образцов по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов
|
Тест- культуры |
ЭЛВ:НС(2:6), мм |
Разведения препарата и зоны подавления роста тест-культур, мм |
|||
|
1:10 |
1:20 |
1:50 |
1:100 |
||
|
Bacillus cereus |
8 |
– |
– |
– |
– |
|
Bacillus subtillis |
8 |
– |
– |
– |
– |
|
Escherichia coli |
10 |
– |
– |
– |
– |
|
Salmonella abony |
10 |
– |
– |
– |
– |
|
Pseudomonas aeruginosa |
8 |
– |
– |
– |
– |
|
Staphylococcous aureus |
5 |
– |
– |
– |
– |
|
Candida albicans |
10 |
– |
– |
– |
– |
Таблица 4
Микробиологическая активность водного экстракта одуванчика лекарственного (Taraxacum officinale Wigg.) (ЭОЛ) и разведенных образцов по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов
|
Тест-культуры |
Экстракт одуванчика, мм |
Разведения экстракта одуванчика и зоны подавления роста тест-культур, мм |
|||
|
1:10 |
1:20 |
1:50 |
1:100 |
||
|
Bacillus cereus |
– |
– |
– |
– |
– |
|
Bacillus subtillis |
– |
– |
– |
– |
– |
|
Escherichia coli |
– |
– |
– |
– |
– |
|
Salmonella abony |
– |
– |
– |
– |
– |
|
Pseudomonas aeruginosa |
– |
– |
– |
– |
– |
|
Staphylococcous aureus |
– |
– |
– |
– |
– |
|
Candida albicans |
10 |
5 |
– |
– |
– |
Таблица 5
Микробиологическая активность водного экстракта одуванчика лекарственного (Taraxacum officinale Wigg.) с наночастицами серебра (ЭОЛ+НС, 4:4) и разведенных образцов по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов
|
Тест- культуры |
ЭОЛ+НС(4:4), мм |
Разведения препарата и зоны подавления роста тест-культур, мм |
|||
|
1:10 |
1:20 |
1:50 |
1:100 |
||
|
Bacillus cereus |
5 |
– |
– |
– |
– |
|
Bacillus subtillis |
5 |
– |
– |
– |
– |
|
Escherichia coli |
8 |
– |
– |
– |
– |
|
Salmonella abony |
– |
– |
– |
– |
– |
|
Pseudomonas aeruginosa |
10 |
– |
– |
– |
– |
|
Staphylococcous aureus |
16 |
5 |
– |
– |
– |
|
Candida albicans |
30 |
26 |
24 |
20 |
18 |
Таблица 6
Микробиологическая активность водного экстракта одуванчика (Taraxacum officinale Wigg.) с наночастицами серебра (ЭОЛ+НС, 2:6) и разведенных образцов по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов
|
Тест-культуры |
ЭО+НС (2:6), мм |
Разведения препарата и зоны подавления роста тест-культур, мм |
|||
|
1:10 |
1:20 |
1:50 |
1:100 |
||
|
Bacillus cereus |
8 |
– |
– |
– |
– |
|
Bacillus subtillis |
8 |
– |
– |
– |
– |
|
Escherichia coli |
10 |
– |
– |
– |
– |
|
Salmonella abony |
– |
– |
– |
– |
– |
|
Pseudomonas aeruginosa |
15 |
10 |
5 |
– |
– |
|
Staphylococcous aureus |
16 |
8 |
– |
– |
– |
|
Candida albicans |
24 |
20 |
18 |
10 |
8 |
Для экстракта одуванчика (Taraxacum officinale Wigg.) с наночастицами серебра при соотношении (ЭОЛ+НС, 2:6) и разведенных образцов активность падает, но остается достаточно высокой (от 24 мм до 8 мм) для Candida albicans. Данная смесь также индифферентна по отношению к Salmonella abony; к остальным микроорганизмам активность ее значительна: например, для Pseudomonas aeruginosa от 15 мм до 5 мм при разведении, для Staphylococcous aureus от 16 мм до 8 мм (табл. 6).
Заключение
Результаты исследований показывают, что, как и ожидалось, наличие НЧС в экстрактах растений показывают высокую активность по сравнению с чистыми экстрактами. Причем НЧС, полученные в тех же условиях, но в экстрактах разных растений обладают разными активностями по отношению к изученным микроорганизмам. Также активности могут различаться для НЧС, полученных при разных соотношениях экстракта и нитрата серебра.
Наибольшая антимикробная активность была получена для Candida albicans при тестировании НЧС, полученных в экстракте одуванчика (Taraxacum officinale Wigg.) и нитрата серебра при их соотношении 4:4, что заслуживает внимания и требует дальнейшего детального изучения для внедрения в практику.

