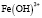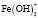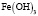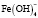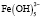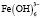Взаимодействие ионов металлов с водой является одним из важнейших химических взаимодействий, встречающихся в природе. В условиях гидролиза возможны реакции образования гидроксокомплексов, характеризующихся соответствующими константами устойчивости. Ионы железа (Fe3+) сильно подвержены гидролизу и формированию оксо-, гидроксосоединений. Формирование любых форм гидроксокомплексов железа (III) определяется полнотой протекания реакции гидролиза (величиной n):
[Fe3+] + n Н2О → [Fe(OH)n]3-n + n Н+
Величина n изменяется с увеличением значений температуры и pH. При рН 1,5 начинается гидролиз катионов Fe3+ со стадийным образованием моноядерных гидроксокомплексов [Fe(OH)]2+ и [Fe(OH)2]+, где на их долю приходится до 50% находящегося в системе ионизированного железа. При низких значениях указанных параметров необходимо ожидать присутствия в растворе наряду с положительно заряженными гидроксоаквакомплексами железа(III) составов [Fe(OH)]2+ или [Fe(OH)2]+ и электронейтральных частиц [Fe(OH)3]0. В диапазоне рН 2,5-4,0 может происходить процесс полимеризации гидроксокомплексов с образованием димера [Fe2(OH)2]4+ и в меньшей степени [Fe2(OH)5]+. При рН 4,5-5,5 в водной среде доминируют гидратированные катионы Fe3+ [1; 2]. Такое распределение гидролизующихся форм железа(III) отмечено и в других исследованиях [3; 4]. Однако существенную роль при этом играет концентрация катионов в растворе. В частности, в работе [4] на примере Fe(III) показано, что в растворе с концентрацией ионов Fe3+ ⁓ 10-5 М полиядерные гидроксокомплексы не образуются. Вероятность образования полиядерных форм уменьшается также в присутствии комплексообразующих анионов, при этом формируются смешаннолигандные моноядерные гидроксокомплексы различного состава. Склонность металлов переменной валентности, в том числе и железа, к образованию смешаннолигандных гидроксокомплексов различного состава отмечена во многих исследованиях [5-7]. Подверженное гидролизу железо (III) образует большое количество смешанных гидроксокомплексов. Как правило, такие комплексы обладают высокой биологической активностью и используются в качестве основы для получения лечебных препаратов и микроудобрений [8]. В этой связи особый интерес вызывают смешаннолигандные гидроксокомплексы, формирующиеся с участием гуминовых веществ (ГВ). Особый интерес к гуминовым веществам обусловлен их уникальными биологическими свойствами, включая биосовместимость, стабильность и многофункциональность. Основными структурными единицами молекул ГВ являются ароматическое ядро и периферические функциональные группы, которые обеспечивают их высокую реакционную способность в реакциях комплексообразования и образования хелатных структур [9-11]. В частности, в работе [12] установлено формирование стабильных пятичленных хелатных комплексов Fe(III) c гуминовыми кислотами в области рН 3,0-7,2. Было показано, что Fe(III) при концентрациях ⁓ 10-3 М встречается преимущественно в виде моноядерных комплексов c природными органическими веществами (ПОВ), а также с фульвокислотами. Органические комплексы Fe(III) обладают более высокой реакционной способностью по сравнению с железом в гидроксидных фазах. Несмотря на актуальность, все перечисленные выше вопросы изучены недостаточно.
Цель исследования – изучение гидролиза железа (III) в водном растворе в присутствии ГВ. Определение вида, состава, устойчивости и распределения в системе образующихся гидроксокомплексов, в том числе и смешаннолигандных гумат-гидроксокомплексов.
Материалы и методы исследования
В работе использован хлорид железа(III) марки ч.д.а. Гуминовые кислоты выделены из бурого окисленного угля. Состав и свойства описаны в работе [9]. Гидролиз ионов железа(III), а также образование смешаннолигандных гумат-гидроксокомплексов изучали в водных растворах в интервале концентраций ионов металла 10-5–10-4 М. В работе использован катионит КУ-2.8 в Na+ -форме. Ионит подвергался предварительной обработке для удаления примесей. К 0,25 г смолы добавляли 25 мл 0,1 М раствора NaClO4 (I=0,1 М) c определенным pH, которое варьировало от 1,5 до 10. В систему вносили раствор с заданной концентрацией иона металла и реакцию проводили до наступления равновесия. Отбирали аликвоту и определяли концентрацию ионов Fe3+ методом атомно-абсорбционной спектроскопии [13]. Образование как однородных, так и смешаннолигандных комплексов ионов металлов в растворе исследовано с методом ионообменного равновесия [14]. В условиях гидролиза при образовании гидроксокомплексов
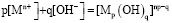
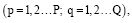
характеризуемых константой устойчивости
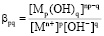 ,
,
катионный обмен описывается общим уравнением:
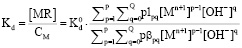 ,
,
где Kd – коэффициент распределения металла между раствором и ионитом, здесь lpq – функция, характеризующая сорбируемость комплексного иона, 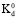 – коэффициент распределения его при мольной доле αpq = 1. Решение этого уравнения путем введения функции φ, которая зависит от 1/Кd и [OH], позволяет определить состав и устойчивость комплексов, образующихся при каждой фиксированной концентрации металла в растворе.
– коэффициент распределения его при мольной доле αpq = 1. Решение этого уравнения путем введения функции φ, которая зависит от 1/Кd и [OH], позволяет определить состав и устойчивость комплексов, образующихся при каждой фиксированной концентрации металла в растворе.
Анализ ионных равновесий в системе был проведен классическим методом [12].
Результаты исследования и их обсуждение
Состав и константы устойчивости гидроксокомплексов. В водных растворах солей ионы железа могут присутствовать в различной форме в зависимости от концентрации и рН. В общем случае, реакции гидролиза ионов железа (III) можно описать следующими уравнениями:
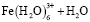
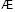
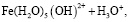
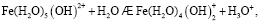
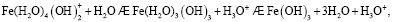
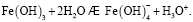
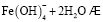
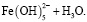
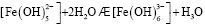 .
.
Помимо указанных в этих уравнениях гидроксокомплексов, могут присутствовать и другие. При увеличении рН протекают процессы оляции и оксоляции, в результате которых образуются полимеры состава OH/Fe≈1.1 и OH/Fe≈5.2. Одновременно происходит и образование двойных цепей октаэдров FeO(OH)6. Конденсация двойных цепей приводит сначала к образованию сферических частиц диаметром 2-4 нм, содержащих порядка 100 атомов Fe, а затем и анизотропных частиц α-FeOOH или β-FeOOH в зависимости от условий эксперимента и прекурсоров [3].
Состав и константы устойчивости гидроксокомплексов железа (III), рассчитанные по методу Фронеуса на основе данных ионообменного равновесия в системе гидролиза, представлены в таблице.
Данные о распределении в системе ионов железа (III) и их гидроксокомплексов, рассчитанные на основе констант устойчивости (таблица), представлены на рисунке 1.
Как показано на рисунке 1, в интервале рН от 1,5 до 5,5 в составе раствора доминируют частицы Fe3+. Но начиная от рН 3,0 наблюдается гидролиз этих ионов с образованием гидроксоформ 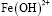 и
и 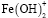 . Содержание этих частиц достигает максимального значения при рН 4,0. При этом для
. Содержание этих частиц достигает максимального значения при рН 4,0. При этом для 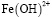 α=0,34, а для
α=0,34, а для 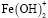 . α=0,21.
. α=0,21.
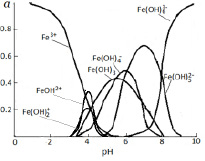
Рис. 1. Распределение в системе ионов железа (III) и их гидроксокомплексов
Состав и константы устойчивости образующихся гидроксокомплексов
|
Комплекс |
|
|
|
|
|
|
|
|
5,84 |
8,61 |
10,17 |
10 , 68 |
12,00 |
14,31 |
Образование Fe(OH)3 начинается при рН 3,4. Содержание этих частиц увеличивается с повышением рН и достигает 44% при рН 5,8. Далее происходит снижение этой величины, и при рН 8,0 в растворе частиц 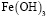 уже не существует. Максимальное содержание
уже не существует. Максимальное содержание 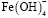 (α=0,50) наблюдается при рН 6,0. Образование этих частиц прекращается при pH 8,4. При рН 5,0 начинается образование
(α=0,50) наблюдается при рН 6,0. Образование этих частиц прекращается при pH 8,4. При рН 5,0 начинается образование 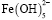 . При рН 7,5 для этих частиц α=0,6. В интервале рН 6,0-10,0 в растворе присутствуют
. При рН 7,5 для этих частиц α=0,6. В интервале рН 6,0-10,0 в растворе присутствуют 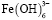 . При этом содержание их возрастает 0,1 до 90%.
. При этом содержание их возрастает 0,1 до 90%.
Ионные равновесия и распределение частиц в процессе гидролиза ионов железа(III) в присутствии гуминовых кислот. Для оценки кривой распределения частиц, образующихся при гидролизе ионов металлов в водном растворе в присутствии гуминовых кислот, было составлено несколько моделей равновесий, из которых на основании расчетов по программе CPESSP [15] была выбрана модель, имеющая наименьшее значение критерия Фишера. Cогласно этой модели в рассматриваемых системах наряду со свободными ионами металлов и их гидроксоформами присутствуют гуматные и смешанные гумат-гидроксокомплексы. При этом модель включала гидрокcокомплексы только следующих составов: 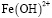 ,
, 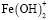 и
и 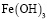 . Смешаннолигандные гумат-гидроксокомплексы представлены формами
. Смешаннолигандные гумат-гидроксокомплексы представлены формами 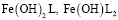 и полностью замещенным гуматом железа, таким как
и полностью замещенным гуматом железа, таким как 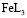 . В соответствии с моделью были составлены уравнения материального баланса, рассчитаны мольные доли всех частиц в растворе и построены кривые их распределения (рис. 2). Уравнение материального баланса в присутствии гумат-лигандов, то есть в системе
. В соответствии с моделью были составлены уравнения материального баланса, рассчитаны мольные доли всех частиц в растворе и построены кривые их распределения (рис. 2). Уравнение материального баланса в присутствии гумат-лигандов, то есть в системе 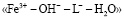 , с допущением того, что имеет место образование трех форм гумат-содержащих комплексов, имеет вид:
, с допущением того, что имеет место образование трех форм гумат-содержащих комплексов, имеет вид:
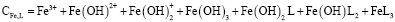
С учетом констант образования комплексов долевая концентрация 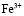 в системе, включающей гумат-анионы, выразится как:
в системе, включающей гумат-анионы, выразится как:
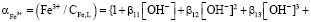
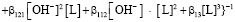
Концентрация гуматных донорных центров, образующихся при ионизации протоногенных функциональных групп (HL), может быть определена через константу ионизации последних:
Kион.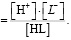
Отсюда [L–] = Kион. [HL] ∙ [H+]–1 или [L–] = Kион. [HL] ∙ [OH–] / Kw , где Kw – ионное произведение воды.
Тогда долевая концентрация смешанных гумат-гидроксокомплексов железа (III) определится следующими выражениями:

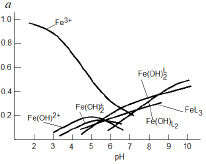
Рис. 2. Кривые распределения гидроксокомплексов и смешанных гумат-гидроксокомплексов железа
Величины констант образования смешанных гумат-гидроксокомплексов рассчитаны на основе данных о константах устойчивости гидроксокомплексов и ступенчатых констант образования гуматных комплексов [9]. 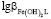 =14,23;
=14,23; 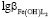 =13,57;
=13,57; 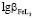 =16,86.
=16,86.
В присутствии гуминовых кислот кривая распределения смещается в щелочную область. Содержание свободных ионов Fe3+ доминирует до рН 6,5. Fe(OH)2+ присутствуют в системе в области pH от 3,2 до 6,5. Максимальное содержание их (α=0,2) наблюдается при pH 5,0. Образование 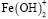 начинается при pH 3,4. Мольная доля этих частиц в присутствии ГК понижается, достигнув максимального значения α=0,18 при pH 6,0. Начиная от рН 6,0 и до рН 10,0 в растворе присутствуют смешанные гумат-гидроксокомплексы Fe(OH)2L и Fe(OH)L2.. Для Fe(OH)2L α=0,43 и для Fe(OH)L2 α=0,50 при pH 10. В области рН 4,5 начинается образование тернарных гуматных комплексов FeL3, которое прекращается при рН 8,5 при достижении α=0,3.
начинается при pH 3,4. Мольная доля этих частиц в присутствии ГК понижается, достигнув максимального значения α=0,18 при pH 6,0. Начиная от рН 6,0 и до рН 10,0 в растворе присутствуют смешанные гумат-гидроксокомплексы Fe(OH)2L и Fe(OH)L2.. Для Fe(OH)2L α=0,43 и для Fe(OH)L2 α=0,50 при pH 10. В области рН 4,5 начинается образование тернарных гуматных комплексов FeL3, которое прекращается при рН 8,5 при достижении α=0,3.
Заключение
Степень гидролиза ионов железа (III) в водном растворе при введении гуминовых кислот понижается, и область образования гидроксокомплексов смещается в область более высоких рН. Наряду с этим уменьшается концентрация свободных ионов металла за счет образования смешаннолигандных гумат- гидроксокомплексов различного состава.