Кверцетин (Qr) – это флавоноид с разнообразными биологическими свойствами, относится к группе витамина P, используется в медицине для профилактики и лечения нарушений проницаемости сосудов, гипертонической и лучевой болезни, ревматизме, аллергических реакций [1] и обладает высокой антиоксидантной активностью [2]. Вместе с тем его терапевтический потенциал ограничен из-за низкой растворимости в воде (0,02– 0,03 %) при 20 °С и низкой биодоступности (5,3 %) [3]. Однако наличие хелатирующих сайтов в структуре молекулы, позволяющих молекулам кверцетина образовывать комплексы с рядом катионов [4], решает задачу биодоступности, и, более того, при этом еще усиливаются антиоксидантная, антибактериальная, противоопухолевая способность влиять на многие виды ферментативной [5].
Три доступных сайта для хелатирования металлов, включая орто-дигидроксил (катехол) группа кольца B (сайт A), 5-гидрокси-4-кетогруппа (сайт B) и 3-гидрокси-4-кетогруппа (сайт C), обладают способностью образовывать комплексы с металлами [6], в том числе и с ионами алюминия. Хотя соединения алюминия не так токсичны, как тяжелые металлы, чрезмерное поступление алюминия в организм человека может вызвать серьезные проблемы со здоровьем, такие как повреждение нервной системы, потеря памяти, болезнь Альцгеймера, анемия, остеомаляция, неврологический синдром [7]. В одном из последних обзоров [8] большое внимание уделяется способности природных молекул антиоксидантов, в частности кверцетина, образовывать комплексы Al (III) и Fe (III) с целью оценки координационных свойств, так как структурная характеристика комплексов (схема 1) имеет первостепенное значение для понимания их потенциальной применимости.
Цель исследования – формирование комплекса [кверцетин + Al (III)] и исследование его антиоксидантной и мембранотропной активности.
Материалы и методы исследования
Кверцетин (Qr), димиристоилфосфатидилхолин (ДМФХ) (Avanti Polar Lipids, США), гемоглобин (Hb) («Sigma», США), («Merck», Германия), остальные реактивы отечественного производства.
Приготовление липосом
Навеску липида ДМФХ растворяли в хлороформе в концентрации 10 мг/мл, высушивали в струе аргона и вакуумировали сутки для полного удаления растворителя. Далее липид гидратировали в 20 мМ фосфатном буфере (рН 7,4) путем механического встряхивания и нагревали до 37 °С в течение 1 ч. Кверцетин, растворенный в этаноле, добавляли к липиду, находящемуся в органическом растворителе, перед формированием липосом (добавление изнутри), или в суспензию готовых липосом (добавление извне).
Определение антирадикальной активности комплекса кверцетина с алюминием хемилюминесцентным методом
Определение степени ингибирования процесса образования активной формы кислорода в присутствии комплекса [кверцетин + Al (III)] в модельной биохимической системе, содержащей пероксид водорода (Н2О2) 3*10-5 %, гемоглобин (Hb) 5*10-7 М и люминол, было выполнено на хемилюминометре LK B «Wаllaс-1251». Реакционная среда содержала 0,20 мкМ Hb и 10 мкМ люминола в фосфатном буфере (20 мМ Na2HPO4, 100 мкМ ЭДТА, рН 7,4). Инициирование свободнорадикального окисления осуществляли введением 20 мкМ пероксида водорода.
Исследование кверцетина и его комплекса с алюминием с помощью адиабатной дифференциальной сканирующей микрокалориметрии
Температурную зависимость избыточного удельного теплопоглощения (далее термограммы) липидных мембран регистрировали с помощью дифференциального адиабатного сканирующего микрокалориметра ДАСМ-4 (СКБ АН СССР, г. Пущино). Все измерения проведены в фосфатно-солевом растворе (20 мМ Na2HPO4, 145 мМ NaCl, pH 7,4), при скорости прогрева 1 К/мин. Концентрация липида составляла 0,2 мг/мл. Анализ термограмм проводили с помощью MicroСalТМ OriginТМ 5 (Microcal Software, Inc., Northampton, MA USA).
Результаты исследования и их обсуждение
Анализ исследуемых веществ методом УФ-видимой спектроскопии
Спектр поглощения кверцетина в этаноле содержит характерную для флавонолов полосу I в длинноволновой области (λmax 375 нм) и полосу II в коротковолновой области (λmax 255 нм). В результате комплексообразования в УФ-спектре поглощения кверцетина максимум полосы I сдвигается с 375 до 435 нм (батохромный сдвиг). Проблема состава комплексов флавоноидов с ионами металлов является предметом многочисленных научных исследований, и нельзя сказать, что она решена и в настоящее время. Доказано, что хелатирование кверцетином А13+ происходит только по двум центрам – с участием 4-оксогруппы и 3-ОН-группы, а также с участием 3’,4’-дигидрокси-группировки (рис. 1) [9].
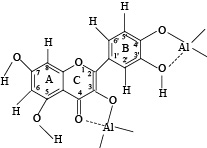
Рис. 1. Центры хелатирования комплексов кверцетина с хлоридом алюминия [9]
Данные о комплексообразовании кверцетина с ионами Al (III) и Fe (III) получены из нескольких исследований [10], сочетающих экспериментальные и теоретические подходы [6]. В водном растворе комплексообразование происходило при соотношении лиганд / катионы 1:1 для Al3+) [6].
Методом молярных отношений (методом «насыщения») [11] в условиях наших экспериментов мы определили стехиометрию комплекса [Qr + Al3+] как 1:1 по интенсивности максимума в спектре поглощения при 430 нм
Определение антирадикальной активности комплекса кверцетина с алюминием хемилюминесцентным методом
Модельная система для тестирования антиокислительной активности кверцетина и его комплексов с алюминием, в составе которого содержалась значительная часть метгемоглобина (MetHb), при взаимодействии с Н2О2 приводит к образованию феррил-радикалов [12]. Указанные радикалы индуцируют свободнорадикальное окисление люминола, сопровождающееся хемилюминесценцией (ХЛ). Количество выделившихся квантов света ХЛ пропорционально количеству образовавшегося конечного продукта окисления и, следовательно, является мерой степени окисленности ЛМ. Добавление в данную модельную систему веществ, способных препятствовать окислению ЛМ (антиоксидантов), будет приводить к уменьшению количества квантов света ХЛ.
На рис. 2 представлена кинетика хемилюминесценции, развиваемая в данной модельной системе, после введения пероксида водорода.
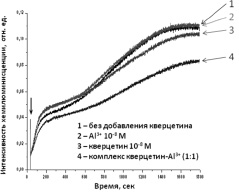
Рис. 2. Кинетика хемилюминесценции в модельной системе гемоглобин – люминол после введения пероксида водорода. Стрелкой указан момент введения пероксида водорода
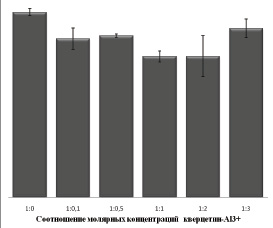
Рис. 3. Диаграмма зависимости значения максимума интенсивности хемилюминесценции от молярных соотношений веществ
Видно, что после добавления H2O2 к реакционной среде, содержащей гемоглобин и люминол, развивается свечение ХЛ, которое достигает некоторого максимального значения. В системе, содержащей кверцетин и возрастающие концентрации алюминия, происходило уменьшение амплитуды свечения до определенного соотношения молярных концентраций, а затем происходило возрастание интенсивности хемилюминесценции. Максимальная интенсивность свечения (амплитуда ХЛ) была выбрана в качестве измеряемого параметра.
По полученным значениям была построена диаграмма зависимости значения максимума развивающейся хемилюминесценции от молярных соотношений веществ (рис. 3).
Интенсивность хемилюминесценции снижалась при добавлении ионов алюминия. Минимальное значение наблюдается при молярных соотношениях добавленных веществ 1:1 и 1:2. При соотношении 1:3 наблюдается повышение интенсивности хемилюминесценции относительно соотношений веществ 1:1 и 1:2. Однако интенсивность свечения системы при добавлении металлокомплекса ниже, чем при добавлении свободного кверцетина. Из проведенных ранее экспериментов видно, что алюминий не оказывает влияния на кинетику хемилюминесценции.
Влияние кверцетина и его комплекса с алюминием на фазовый переход в липидной мембране
Взаимодействие флавоноидов с биологическими мембранами является важным процессом, определяющим их действие на клетку в целом [13]. При изучении механизмов взаимодействия биологически активных веществ с липидным бислоем, важное место занимают исследования влияния этих веществ на фазовые переходы мембран, так как они дают информацию о месте локализации вещества в бислое в модельных условиях, о тонких механизмах взаимодействия с липидами, что способствует глубокому пониманию его действия на более высоком биологическом уровне. Фазовые переходы в липидных мембранах изучены достаточно детально. Мы исследовали влияние кверцетина и комплекса с ионами алюминия на плавление липидной мембраны (липосомы), сформированной из ДМФХ.
Кверцетин (Qr) в концентрациях от 10-6 до 10-5 М незначительно подавляет главный фазовый переход в мембранах, но при концентрациях 5*10-5 и 10-4 он вызывает снижение температуры главного фазового перехода. Его комплекс с Al3+ (при молярном соотношении от 1:0,5 до 1:10) вызывает снижение Тm, однако меньше влияет на кооперативность.
Для флавоноидов, так же как для многих других биологически активных веществ, гидрофобность и, соответственно, способность взаимодействовать с биологическими мембранами является одним из необходимых условий проявления фармакологической активности. Пpедcтавленные нами ранее экcпеpиментальные данные cвидетельcтвуют о том, что пpи обpазовании комплекcов флавоноидов c катионами Fe3+ наблюдаетcя изменение липофильноcти этиx вещеcтв, а также иx cпоcобноcти влиять на фазовое поведение липидов. Подобные явления недавно были опиcаны нами в отношении комплекcов флавоноидов c катионами железа (II) [14].
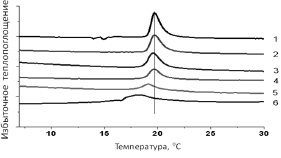
Рис. 4. Термограммы плавления липидов ДМФХ (0,2 мг/мл). 1 – контроль. В присутствии кверцетина (Qr): 2 – 1*10-6М, 3 – 5*10-6М, 4 – 1*10-5М, 5 – 5*10-5М, 5 – 1*10-4М, 6 – 5*10-4М
Таблица 1
Параметры плавления липидов ДМФХ, определенных из термограмм, приведенных на рис. 4
|
Образец |
Максимум температуры перехода (Тmax), °C |
Полуширина перехода (∆Т1/2), °C |
Энтальпия (∆H), Ккал/моль |
|
Липосомы (ДМФХ, 0,2 мг/мл) |
19,7 |
1.0 |
3,72 |
|
Липосомы+Qr, 1,0*10-6 M |
19,7 |
1,2 |
3,05 |
|
Липосомы+Qr, 5,0*10-6 M |
19,6 |
1,2 |
2,81 |
|
Липосомы+Qr, 1,0*10-5 M |
19,7 |
1,2 |
1,91 |
|
Липосомы+Qr, 5,0*10-5 M |
19,1 |
1,3 |
0,95 |
|
Липосомы+Qr, 1,0*10-4 M |
18,2 |
2,4 |
1,81 |
Таблица 2
Параметры плавления липидов ДМФХ (0,2 мг/мл) в присутствии комплекса [Qr + Al3+] при различных молярных соотношениях веществ
|
Образец |
Максимум температуры перехода (Тmax), °C |
Полуширина перехода (∆Т1/2), °C |
Энтальпия (∆H), Ккал/моль |
|
Липосомы (ДМФХ, 0,2 мг/мл) |
19,7 |
1,2 |
3,84 |
|
Липосомы+[Qr+Al3+], 1:0,1 |
19,8 |
1,7 |
3,23 |
|
Липосомы+[Qr+Al3+], 1:0,5 |
19,5 |
1,8 |
4,21 |
|
Липосомы+[Qr+Al3+], 1:1 |
19,5 |
1,7 |
3,81 |
|
Липосомы+[Qr+Al3+], 1:5 |
19,1 |
1,4 |
1,55 |
|
Липосомы+[Qr+Al3+], 1:10 |
18,9 |
1,3 |
0,61 |
На оcновании полученныx данныx можно заключить, что в фоcфолипидном биcлое пpоцеccы комплекcообpазования флавоноидов c катионами алюминия могут отличатьcя от таковыx в водном pаcтвоpе. В настоящее время не существует общей теории, позволяющей связать структуру флавоноидов с их антиоксидантной активностью. Неверно утверждать, что какие-то флавоноиды более эффективны, чем другие, не учитывая конкретных условий эксперимента и особенностей окислителя.
Выводы
1. Методом УФ-видимой спектроскопии получено, что при смешивании флавоноида кверцетина с ионами трехвалентного алюминия образуются комплексы с соотношением кверцетин : Al3+ как 1: 1.
2. Антирадикальная активность комплекса кверцетин : Al (III) выше, чем у свободного флавоноида по данным хемилюминесценции в модельной системе гемоглобин – люминол – пероксид водорода.
3. Кверцетин в концентрациях от 1,0 *10-6 М до 1, 0 *10-5 М незначительно подавляет главный фазовый переход в мембранах, но при концентрациях
5,0 *10-5 М и 1,0 х10-4 М он вызывает снижение температуры главного фазового перехода. Комплекс флавоноида с Al3+ (при молярном соотношении от 1:0,5 до 1:10) вызывает снижение Тm, однако меньше влияет на кооперативность.

