Астроциты участвуют во многих аспектах функционирования головного мозга, включая поддержание гомеостаза, развитие синапсов, поддержку нейронов, регуляцию мозгового кровотока, формирование и функцию гематоэнцефалического барьера и контроль нейротрансмиттеров [1]. Регуляция функции синапсов обеспечивается выделением астроцитами глиотрансмиттеров, которые поступают в межклеточное пространство. В качестве ведущего глиотрансмиттера выступает глутамат, он активирует рецепторы NMDA, AMPA с целью быстрого обеспечения сигнала. Тем самым астроцит принимает участие в пластической регуляции синаптических процессов [2]. Установлено, что морфология астроцитов влияет на пространственные отношения не только с нейронами, но и с олигодендроцитами, сосудистыми клетками и другими астроцитами [3–5].
Любое, в том числе и ишемическое, повреждение головного мозга затрагивает астроциты. Установлено наличие прямой зависимости между степенью и характером морфологических изменений нейронов и астроцитов. Эффекты при активации астроглии двулики и могут быть направлены на защиту страдающей ткани головного мозга или на деструкцию поврежденных нейронов и стать причиной необратимых повреждений [6]. Нарушение функции астроцитов в условиях повреждения головного мозга является результатом окислительного стресса, деструкции митохондрий, нейровоспаления и глутаматной токсичности [2]. Реакция астроцитов может иметь отличительные особенности при разных патофизиологических вариантах ишемии головного мозга. Согласно литературным данным, изучена реорганизация астроцитов при разных экспериментальных моделях церебральной ишемии [1, 7]. Однако при субтотальной ишемии после необратимой двусторонней ПОСА пространственная организация отростков астроцитов СМК головного мозга подлежит более детальному изучению, поэтому цель настоящего исследования – изучить пространственную организацию отростков астроцитов слоя I, III и V СМК головного мозга крыс после необратимой двусторонней ПОСА.
Материалы и методы исследования
Работа выполнена на базе ФГБОУ ВО «Омский государственный медицинский университет», одобрена этическим комитетом университета (протокол № 123 от 09 октября 2020 г.). В качестве экспериментальных животных использовали белых крыс линии Wistar массой 250–300 гр. Исследования проводили в соответствии с рекомендациями Международного комитета по работе с лабораторными животными, поддержанными ВОЗ, директивой Европейского парламента № 2010/63/EU от 22.09.2010 «О защите животных, используемых для научных целей».
Неполную глобальную ишемию головного мозга моделировали путем необратимой двусторонней ПОСА. Животных наркотизировали введением Zoletil 100 (10 мг/кг, внутримышечно). Контролем служили интактные крысы без манипуляций на общих сонных артериях (n = 5). Через 1, 3, 7, 14 и 30 сут животных выводили из эксперимента. Под наркозом (Zoletil 100) сосудистое русло мозга промывали введением 100–125 мл раствора 0,9 % NaCl и Фрагмина (5000 единиц) в левый желудочек сердца и фиксировали перфузией 30 мл 4 % раствора параформальдегида на фосфатном буфере (pH 7,2–7,4) через аорту под давлением 90–100 мм рт. ст. в течение 15 мин. Через 1,5–2 ч вскрывали черепную коробку, бережно извлекали головной мозг и помещали его в аналогичный фиксатор. Материал хранился в холодильнике при температуре + 4 °С. Через 1 сут полученный материал заключали с помощью автомата «STP 120» в гомогенизированный парафин (HISTOMIX®). Серийные фронтальные срезы (толщиной 4 мкм) готовили с помощью микротома HM 450 (Thermo) на уровне СМК: 1,2 – (-3,0) мм от Брегмы [8].
Общую качественную оценку нервной ткани и идентификацию нейронов проводили на препаратах, окрашенных гематоксилин-эозином, тионином по методу Ниссля. Иммуногистохимическое исследование проводили на срезах, помещенных на маркированные предметные стекла. Использовали мышиные моноклональные антитела к GFAP – глиальный фибриллярный кислый белок астроцитов (MA5-12023) – мышиные моноклональные антитела, разведение 1–2 μg/mL (США). Для визуализации использовали набор реагентов на основе полимера NovoLink и пероксидазы NovoLink Polymer Detection System (Великобритания).
Препараты приготовлены в соответствии с инструкциями фирмы производителя реагентов, фотографировали на микроскопе Leica DM 1000 (камера GXCAM-DM800 Unique Wrap-Around 8MP AUTOFOCUS USB, pixel size 1.4×1.4 μm), изображение сохраняли в файлах с расширением tiff (2592×1944 пикселей), затем в Photoshop CC размерность увеличивали (до 3780×2835 пикселей/см, разрешение 600 пикселей/дюйм). Для достижения максимальной контрастности и четкости мелких отростков астроцитов в Photoshop CC проводили коррекцию изображения с помощью фильтра Camera Raw (контрастность, баланс белого, четкость). Дальнейшее морфометрическое исследование астроцитов проводили на масках 8-битовых черно-белых изображений (объектив ×40) с использованием программы ImageJ 1.53. Фрактальный анализ полученных изображений осуществляли с помощью плагина FracLac 2.5 (Box Counting Sampling Methods).
Определяли относительную площадь GFAP-позитивного материала в поле зрения (по 80 полей зрения на каждый срок), фрактальную размерность (показатель заполнения пространства фрактальной структурой) и лакунарность (мера неоднородности заполнения пространства фрактальной структурой) для нейронов и астроцитов. Уменьшение фрактальной размерности свидетельствует об упрощении структуры клеток (например, о разрушении отростков), увеличение – об усложнении структуры (гипертрофия и разветвление отростков). Чем выше лакунарность, тем больше в поле зрения обнаруживалось асимметричных зон без хромогена (GFAP негативных структур). Повышение показателя лакунарности выше контроля свидетельствовало о мелкоочаговом повреждении цитоскелета нейронов или астроцитов. Снижение показателя лакунарности свидетельствовало о гипертрофии и равномерном разветвлении отростков [9].
Проверку статистических гипотез осуществляли непараметрическими критериями (Mann – Whitney U-test, ANOVA Kraskel-Wallis) с помощью программы Statistica 8.0 (StatSoft). Количественные данные в исследовании представлены: медиана (Me – 50 % квартиль, Q2), интерквартильный разброс (Q1-Q3 – 25–75 % квартили), (Min-Max), процентная доля (%). Проблема множественного сравнения решалась путем использования ANOVA Kraskel – Wallis [10].
Результаты исследования и их обсуждение
По данным иммуногистохимического изучения распределения GFAP-позитивного материала на фронтальных срезах СМК в контроле выявлено однородное распределение хромогена с максимальной концентрацией вокруг кровеносных капилляров и в молекулярном слое (рис. 1). GFAP-позитивный материал локализован в телах и отростках протоплазматических и волокнистых астроцитов. Относительная площадь GFAP-позитивного материала в слое I – 16,6 %, в слое III – 13,7 %, в слое V – 15,9 %.
В сером веществе СМК различают волокнистые и протоплазматические астроциты. Для волокнистых астроцитов характерно небольшое тело с длинными и слаборазветвленными отростками, они имеют древовидную организацию, высокая плотность GFAP-позитивного материала содержится в отростках (рис. 1, Г, Д). Протоплазматические астроциты отличались крупным телом, толстыми и короткими отростками (рис. 1, В, Д). Оба вида астроцитов встречались в слоях III и V СМК мозга крыс.
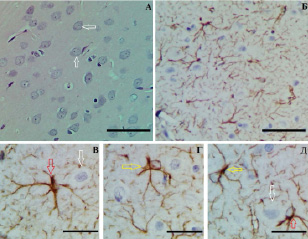
Рис. 1. Слой III (А–Г) и слой V (Д) СМК контрольной группы: А – нормохромные нейроны (белые стрелки) и нейропиль (*); Б – равномерное распределение хромогена; протоплазматические (красные стрелки) и волокнистые (желтые стрелки) астроциты. Окраска: гематоксилин-эозином (А); иммуногистохимическое типирование GFAP (Б–Д). Объективы х 40 (А, Б), х 100 (В–Д), шкала – 25 мкм
По полученным в ходе фрактального анализа данным, в контрольной группе показатели заполнения фрактального пространства фрактальными структурами (телами и отростками астроцитов) при иммуногистохимическом исследовании препаратов, окрашенных на GFAP, в разных слоях СМК статистически значимо различались.
По результатам иммуногистохимического исследования относительной площади GFAP-позитивного материала установлено увеличение локального содержания маркера GFAP уже через 1 сут после необратимой двусторонней ПОСА. Максимальным содержание маркера GFAP было в молекулярном слое СМК и составило 21,9 % (Q2), здесь преобладали фиброзные астроциты. Минимальное содержание отмечено в слое V СМК – 17,6 % (Q2). Значения в разных слоях статистически значимо отличались (Wilcoxon test между слоем I и слоем III – р < 0,005, между слоем I и слоем V – р < 0,01) (рис. 1). Через 1 сут после ПОСА происходило увеличение содержания реактивно измененных астроцитов с большим числом толстых отростков (гипертрофия отростков) с высокой очаговой плотностью распределения и усложнением фиброархитектоники. Эти изменения затрагивали и протоплазматические, и волокнистые астроциты СМК.
Через 3 сут после ПОСА установлено максимальное содержание маркера GFAP во всех исследуемых слоях СМК. В слое I – 23,8 %, в слое III – 20,9 %, в слое V – 22,2 % (рис. 1). Через 7 сут после ПОСА в слое I СМК установлено статистически значимое снижение относительной площади GFAP до 18,6 % (Mann – Whitney U Test; р = 0,02). Через 14 сут в слое I СМК отмечено увеличение относительной площади хромогена (GFAP) элементов глиальной сети СМК до 20,3 % с последующим снижением этого значения до 17,8 % через 30 сут после ПОСА (рис. 1). В слое III СМК через 7 сут после ПОСА относительная площадь маркера GFAP уменьшается до 18,6 % и имеет статистически значимое различие с 3 сут (Mann – Whitney U Test; р = 0,02). Через 14 сут после ПОСА в слое III СМК показатель относительной плотности хромогена статистически значимо снизился до 15,9 % (Mann – Whitney U Test; р = 0,008), затем через 30 сут после ПОСА произошло его увеличение до 16,85 %. В слое V СМК через 7 сут после ПОСА относительная площадь GFAP статистически значимо снизилась до 16,0 % (Mann – Whitney U Test; р < 0,001). Минимальных значений этот показатель в слое V СМК достигал через 30 сут после ПОСА и составил 14,6 % (рис. 2).
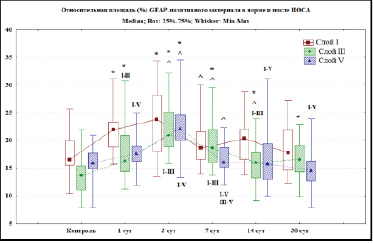
Рис. 2. Относительная площадь (%) хромогена при иммуногистохимическом выявлении (GFAP) элементов глиальной сети слоя I, III и V СМК в контроле и после ПОСА. Примечания: * – различия статистически значимы в сравнении с контролем, ^ – с предыдущим сроком (Mann – Whitney U test; p < 0,05), I–III, I–V, III–V – в сравнении между соответствующими слоями (Wilcoxon test; p < 0,05). При множественном сравнении по срокам (ANOVA Kraskel – Wallis) удалось отвергнуть нулевую гипотезу – слой I (df = 5; Н = 18,9: р = 0,002); слой III (df = 5; Н = 46,3; р = 0,0001); слой V (df = 5; Н = 40,6; р = 0,0001)
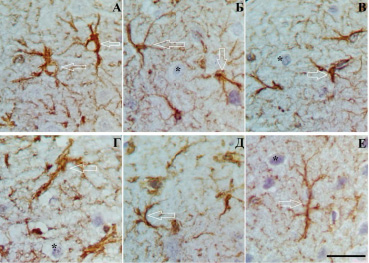
Рис. 3. Слой III (А, Б, В) и слой V (Г, Д, Е) СМК через 3 (А, Г), 7 (Б, Д) и 30 (В, Е) сут после ПОСА. Разная степень гипертрофии отростков астроцитов. Стрелки – указанные проявления. Окраска: иммуногистохимическое типирование GFAP. Объектив х100, шкала – 25 мкм
По результатам проведения фрактального анализа после ПОСА происходит пространственная реорганизация глиальной сети СМК мозга крыс. Вероятными причинами изменений могут быть деструктивные процессы отростков астроцитов вследствие возникшей гипоперфузии головного мозга, пролиферация и гипертрофия астроцитов. Через 1 сут после ПОСА выявлены статистически значимые изменения фрактальной размерности и лакунарности астроглиальной сети СМК. Фрактальная размерность в сравнении с контролем увеличивалась во всех исследуемых слоях СМК (Mann – Whitney U test; p < 0,05) (рис. 4). Через 3 сут после ПОСА выявлены статистически значимые изменения всех переменных (фрактальной размерности и лакунарности). Происходило статистически значимое увеличение фрактальной размерности во всех исследуемых слоях одновременно со статистически значимым уменьшением лакунарности в слое I и слое III СМК (Mann – Whitney U test; p < 0,05). Данные проявления могут свидетельствовать об увеличении площади GFAP-материала (рис. 2, 4).
Увеличение относительной площади GFAP-материала и увеличение фрактальной размерности астроглиальной сети может свидетельствовать о гипертрофических процессах, протекающих в отростках астроцитов в ответ на ишемию, и может быть рассмотрено как компенсаторная реакция астроцитов (рис. 3).
Через 7 сут после ПОСА происходит статистически значимое снижение фрактальной размерности в сравнении с контролем и предыдущим сроком (Mann – Whitney U test; p < 0,05). Лакунарность достигает максимальных значений в этот период, происходит статистически значимое увеличение этой переменной в сравнении с предыдущим сроком (Mann – Whitney U test; p < 0,05). Это свидетельствует о появлении GFAP-негативных зон. Так же имеются статистически значимые различия между слоем III и V (Wilcoxon test; p < 0,05).
Через 14 и 30 сут после ПОСА происходит статистически значимое увеличение фрактальной размерности и снижение лакунарности астроглиальной сети во всех исследуемых слоях СМК. Происходило постепенное заполнение фрактального пространства отростками астроцитов.
Согласно данным литературы, после 20 мин ООСА выявлена количественная гетерогенность и гетерохронность изменений пространственной организации астроцитарных отростков в разных слоях гиппокампа. В остром периоде ишемии происходило уменьшение фрактальной размерности и значительное увеличение лакунарности.
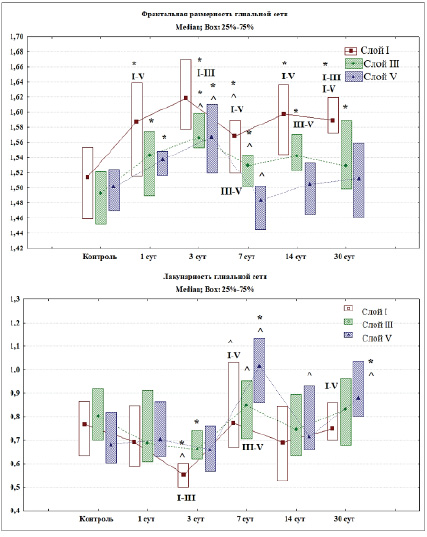
Рис. 4. Фрактальная размерность и лакунарность глиальной сети различных слоев СМК в контроле и после ПОСА, Q2 (Q1–Q3)
Примечания: * – различия статистически значимы в сравнении с контролем, ^ – с предыдущим сроком (Mann – Whitney U test; p < 0,05), I–III, I–V, III–V – в сравнении между соответствующими слоями (Wilcoxon test; p < 0,05). При множественном сравнении фрактальной размерности по срокам (ANOVA Kraskel – Wallis) удалось отвергнуть нулевую гипотезу – слой I (df = 5; Н = 22,8: р = 0,0004); слой III (df = 5; Н = 44,6; р = 0,0001); слой V (df = 5; Н = 31,8; р = 0,0001). При множественном сравнении лакунарности по срокам (ANOVA Kraskel – Wallis) удалось отвергнуть нулевую гипотезу – слой I (df = 5; Н = 23,6: р = 0,0003); слой III (df = 5; Н = 12,8; р = 0,02); слой V (df = 5; Н = 37,2; р = 0,0001).
Причиной деструкции отростков астроцитов были отек и набухание с разрушением цитоскелета [11, 12]. В неокортексе через 1 и 3 сут после 20 мин ООСА происходило разрушение части отростков астроцитов, а в других отростках происходили компенсаторные реактивные изменения. Через 7 сут после 20 мин ООСА увеличивалась численная плотность фиброзных астроцитов в субпиальной зоне под наружной пограничной глиальной мембраной мозга. Начиная с 3 сут происходило восстановление характеристик астроцитарной фрактальной структуры неокортекса, но контрольного уровня они не достигали в течение всего периода наблюдения (30 сут) [7]. По нашим данным, через 3 сут после ПОСА отмечались адаптивные компенсаторные изменения отростков астроцитов, проявляющиеся уменьшением лакунарности и увеличением фрактальной размерности. Через 7 сут отмечалась очаговая деструкция отростков астроцитов. По всей видимости, часть отростков имела признаки компенсаторных изменений, в связи с чем через 14 и 30 сут после ПОСА происходило увеличение фрактальной размерности и уменьшение лакунарности.
Заключение
Таким образом, при проведении фрактального анализа получена дополнительная количественная характеристика астроцитов, включающая площадь и форму распределения отростков астроцитов в пространстве. Согласно полученным результатам установлено, что пространственная реорганизация астроцитов, активация микроглиоцитов и олигодендроцитов способствовали выживанию нейронов в условиях ишемии.

