Статистика Всемирной организации здравоохранения свидетельствует, что среди эндокринных патологий заболевания щитовидной железы занимают второе место после сахарного диабета. Более 665 млн чел. в мире имеют эндемический зоб или страдают другими заболеваниями щитовидной железы, у 1,5 млрд отмечен риск развития йододефицитных заболеваний. При этом ежегодно эта цифра увеличивается на 5 %. В связи с этим в 2008 г. по инициативе Европейской тиреоидологической ассоциации (European Thyroid Association, ETA) был утвержден Всемирный день щитовидной железы (ЩЖ) (World Thyroid Day) [1].
Одним из наиболее известных заболеваний ЩЖ является аутоиммунный тиреоидит (АИТ) Хашимото, который встречается у 3–4 % населения Земли. Но частота клинически выраженных форм заболевания составляет 1 % [2].
Известно, что морфологически АИТ Хашимото (АИТХ) характеризуется диффузной лимфоплазмоцитарной инфильтрацией стромы железы с образованием лимфоидных фолликулов, последующим разрушением тиреоидных фолликулов и развитием склероза ткани ЩЖ различной степени тяжести [3]. В результате разрушения фолликулов освобождается избыточная информация об их тканевых антигенах. Эта информация инициирует иммунный ответ, результатом которого является в первую очередь формирование пула специфически сенсибилизированных лимфоцитов и последующий синтез антител к тканям собственной ЩЖ.
Аутоантитела к тиреоглобулину циркулируют в крови 70–80 % пациентов с АИТХ [4], у 30–40 % пациентов с диффузным токсическим зобом, 10–15 % пациентов с неаутоиммунными заболеваниями щитовидной железы [2, 5].
Наличие аутоантител в первую очередь свидетельствует о срыве толерантности организма к тканевым антигенам собственного органа и формировании «запрещенного» пула лимфоцитов, распознающего аутоантигены [6]. В этой связи не вызывает сомнений наличие в кровотоке больных с тиреоидной патологией не только антитиреоидных антител, но и специфически сенсибилизированных к тканям ЩЖ лимфоцитов.
Однако в доступной литературе практически не рассматривается вопрос об идентификации специфически сенсибилизированных лимфоцитов в периферической крови при тиреоидной патологии, их диагностическом и прогностическом значении.
Целью настоящего исследования являлось определение степени сенсибилизации циркулирующих лейкоцитов к антигенам ЩЖ в контексте морфологической характеристики тиреоидной патологии.
Материалы и методы исследования
Исследование выполнено на базе Научно-исследовательского центра Государственного медицинского университета Туркменистана им. М. Гаррыева и Центрального патологоанатомического бюро (ЦПАБ) г. Ашхабада.
Объектом исследования послужили 130 образцов ткани ЩЖ, полученных при тиреоидэктомии, и 30 образцов ткани ЩЖ практически здоровых лиц (ПЗЛ) обоего пола, погибших от случайных причин. Объектом исследования также служила периферическая кровь 120 больных с патологией ЩЖ и 120 практически здоровых лиц обоего пола в возрасте от 20 до 55 лет (в среднем 37,8±5,3 лет).
Материалом морфологического исследования служила ткань ЩЖ, удалённая во время тиреоидэктомии и присланная из профильных клиник г. Ашхабада в ЦПАБ для морфологической верификации диагноза «АИТ Хашимото». Образцы ткани фиксировали в 10 % нейтральном формалине и жидкости Карнуа, традиционным способом готовили парафиновые блоки и препараты толщиной 5–6 мкм. Препараты окрашивали альциановым синим, гематоксилин – эозином, по Фельгену, Браше, ставили PAS-реакцию [7]. При морфометрии использовали окулярную сетку Г.Г. Автандилова [8].
Степень сенсибилизации лейкоцитов периферической крови к антигенам ЩЖ определяли в реакции торможения миграции лейкоцитов (РТМЛ) в модификации [9]. Результаты выражали в виде индекса миграции лейкоцитов (ИМЛ), который вычисляли в процентах от количества клеток, мигрировавших в среду без антигена. ИМЛ определен у 120 ПЗЛ и 60 пациентов с тиреопатологией.
Для приготовления растворимого тканевого антигена (РТАГ) использован гомогенат пяти ЩЖ ПЗЛ обоего пола в возрасте от 20 до 40 лет, погибших от случайных причин. Антигены из гомогенатов ткани ЩЖ извлекали методом водно-солевой экстракции, определяли содержание белка и доводили его концентрацию до 20 мкг/мл [10]. Полученные РТАГ ЩЖ хранили в пробирках MULTIPLEX – ПРЕМИУМ по 1,0 мл при температуре -19 °С. Размораживали за 1 час до постановки РТМЛ.
Полученные цифровые данные математически обработаны с использованием программы SPSS (Statistics 20 USA).
Результаты исследования и их обсуждение
Исследование показало, что в периферической крови ПЗЛ циркулируют лейкоциты, специфически сенсибилизированные к РТАГ ЩЖ. Референсные значения ИМЛ колеблются от 74 до 156 %. Величина ИМЛ, полученная на основании статистического и кластерного анализов результатов 120 исследований, составляет 120,3±9,3 %. Она принята за региональную норму.
При тиреоидной патологии значения ИМЛ колеблются от 37 до 200 %. Величина ИМЛ зависит от вида тиреоидной патологии и ее морфологической картины (таблица). Из таблицы видно, что у больных АИТ Хашимото (АИТХ) ИМЛ в среднем по группе составляет 65,7±4,3 % (p < 0,01 против уровня контроля).
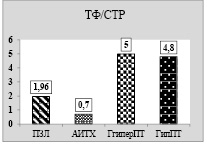
При этом морфологическая картина характеризуется массивной лимфо-плазмоцитарной инфильтрацией стромы с образованием лимфоидных фолликулов, местами со светлыми центрами. В очагах лимфо-плазмоцитарной инфильтрации в большом количестве имеются пиронинофильные плазмоциты. На фоне картины микро-макрофолликулярного зоба резко выражено разрушение тиреоидных фолликулов, в большом количестве встречаются поля склероза, разрастание плотных коллагеновых волокон с высоким содержанием кислых мукополисахаридов. При этом площадь стромы резко увеличена против нормы. На диаграмме (рисунок) представлено отношение площади тиреоидных фолликулов к площади стромы в зависимости от тиреопатологии.
Иммуно-морфологические показатели в зависимости от тиреоидной патологии
|
Тиреоидная патология |
ИМЛ (%) |
Объёмная плотность лимфоидной инфильтрации (%) |
Объемная плотность, занимаемая тиреоидными фолликулами (%) |
|
Аутоиммунный тиреоидит |
65,7±4,3** |
61,8 ± 9,7 * |
37,2 ± 2,1* |
|
Гиперпластический процесс в фолликулах ЩЖ |
168,3±9,6* |
16,7 ±3,0** 1:4,9 |
83,4 ± 8,6* |
|
Гиперпластический процесс с выраженным склерозом и гиалинозом стромы |
52,7±4,2** |
37,5 ± 2,3* 1:1,16 |
60,5 ± 7,6 |
|
ЩЖ ПЗЛ (контроль) |
120,3±9,3 |
29,6±3,5 1:2 |
58,3±6,1 |
Примечание. * – p < 0,05; ** – p < 0,001.
Отношение площади, занимаемой тиреоидными фолликулами, к площади стромы в зависимости от тиреоидной патологии
Если в ЩЖ ПЗЛ это отношение составляет около 2:1 , то при АИТХ – 0,7:1, что свидетельствует о высокой активности процесса лимфоидной инфильтрации фолликулярной ткани ЩЖ с разрушением тиреоидных фолликулов. В этой связи мы допускаем, что низкий ИМЛ у больных с АИТХ связан с уменьшением в циркуляции численности сенсибилизированных лейкоцитов, которые «заняты» атакой на тиреоидные фолликулы. По всей видимости, при АИТХ, чем ниже ИМЛ в присутствии РТАГ ЩЖ, тем более нарушена структура тиреоидных фолликулов и тем более тяжелым является аутоиммунный процесс в ткани железы.
В очагах лимфоидной инфильтрации стромы при тиреопатологии идентифицированы как Т-, так и В-лимфоциты. Т-клетки мигрируют с периферии в щитовидную железу и активно участвуют в процессе деструкции тиреоидных фолликулов [11]. Инфильтрирующие ЩЖ лимфоциты оказывают как прямой цитотоксический эффект по отношению к фолликулярным клеткам, так и косвенный, опосредованный продукцией цитокинов [12]. Фолликулярные Т-клетки хелперны (Tfh), участвуют в формировании антиген-специфической популяции B-клеток за счет продукции IL-21 [13]. Известно, что синтез антител начинается в результате трансформации антиген-презентированной субпопуляции В-клеток в плазмоциты, которые впоследствии и синтезируют иммуноглобулины. Таким образом, в патогенезе аутоиммунного поражения ЩЖ в равной степени участвуют как клеточный, так и гуморальный тип иммунного ответа.
Роль аутоантител в патогенезе тиреоидитов чрезвычайно важна, но до конца не определена. Оказалось, что существует склерозирующее аутоиммунное заболевание ЩЖ, связанное с IgG4. При этом в ткани ЩЖ развивается массивная инфильтрация IgG4-позитивными плазматическими клетками. Морфологически наблюдается более высокая степень фиброза и более распространенная дегенерация фолликулярных клеток по сравнению с не-IgG4 тиреоидитом. [5]. Эти находки еще раз подчеркивают недостаточную изученность вопроса о роли аутоантител в патогенезе тиреоидной патологии, несмотря на то, что они присутствуют в сыворотке крови практически у всех больных с тиреоидной патологией и широко используются в диагностике и прогнозировании развития тиреопатологии, особенно в сочетании с измерением уровня ТТГ.
Но еще менее изучена степень участия в патогенезе тиреоидитов специфически сенсибилизированных к антигенам ЩЖ лимфоцитов. В 1997 г. эти исследования были начаты, но реакции клеточного иммунитета в присутствии тиреоидных антигенов трудоемки, поэтому в практической деятельности почти не использовались [14]. В периферической крови больных АИТХ нами выявлены лейкоциты, сенсибилизированные к РТАГ ЩЖ. Это заставило нас рассмотреть в данном контексте другие заболевания ЩЖ.
Так, при микро-макрофолликулярном зобе с выраженным гиперпластическим процессом в ЩЖ (ГиперпТ) выявлен очень высокий ИМЛ, который составляет 168,3±9,6 % (таблица). Различие достоверно как по отношению к группе ПЗЛ, так и к группе больных АИТХ (p < 0,05 и p < 0,001 соответственно). При этом морфологическая картина ЩЖ характеризуется значительной гиперплазией паренхимы с узлообразованием, пролиферацией эпителия, полями скопления лимфоцитов, плотно прилегающих друг к другу в виде солидных клеточных тяжей, местами напоминающих структуру фолликула. В участках пролиферации в цитоплазме тиреоцитов увеличено количество зерен РНК, в ядрах – зерен ДНК. Одновременно выявлено наличие фолликулов различной величины, заполненных РАS-положительным коллоидом. Местами имеются признаки пролиферации многорядного эпителия с образованием выростов в просвет фолликула, то есть формированием подушечек Сандерсона. Другими словами наблюдаются признаки повышенной пролиферативной активности в участках пролиферации. При этом объемное отношение ТФ/СТР равно 5:1, то есть в 2,6 раза выше по сравнению с группой ПЗЛ и в 7 раз – по сравнению с группой больных АИТХ (таблица). Выброс в кровоток большого числа сенсибилизированных лейкоцитов, на наш взгляд, свидетельствует о том, что в процессе деструкции ЩЖ при микро-макрофолликулярном зобе не участвуют. В данном случае активирован гуморальный ответ на аутоантигены ЩЖ и в процессах деструкции ткани участвуют специфические аутоантитела.
При микро-макрофолликулярном зобе с очаговой пролиферацией эпителия в виде сосочков, очагового склероза и гиалиноза стромы, атрофией фолликулярного эпителия ИМЛ составляет 52,7±4,2, что достоверно ниже по сравнению с группой ПЗЛ (р < 0,001), но отношение ТФ/СТР почти не отличается от такового в группе лиц с гиперпластическим тиреоидитом и составляет 4,5:1 (p > 0,05). ИМЛ в этой группе больных практически не отличается от такового в группе больных с АИТХ (таблица), но объемная площадь тиреоидных фолликулов в 1,6 раза выше, а площадь стромы – в 4,6 раза ниже в сравнении с этой группой. Скорее всего, в данном случае в процессе деструкции ткани ЩЖ участвуют как гуморальный, так и клеточный тип иммунного ответа.
Заключение
Аутоиммунная патология щитовидной железы характеризуется лимфоидной инфильтрацией стромы, в том числе Т- и В-лимфоцитами [1, 11, 15]. Следовательно, в патогенезе аутоиммунного процесса участвуют как клеточный, так и гуморальный иммунитет. Клеточные механизмы деструкции щитовидной железы в настоящее время привлекают все большее внимание. Показано, что при АИТХ Т-клетки мигрируют с периферии в щитовидную железу и активно участвуют в процессе деструкции тиреоидных фолликулов. Причем дефекты Т-регуляторных клеток и повышенная активация фолликулярных Т-хелперов могут играть роль как в инициации, так и поддержании патологического процесса [15].
Инфильтрирующие ЩЖ лимфоциты могут как оказывать прямой цитопатогенный эффект по отношению к фолликулярным клеткам, так и косвенно влиять на жизне-способность и функцию ЩЖ за счет продукции цитокинов. Кроме того идентифици-рованы фолликулярные Т-клетки хелперы (Tfh), участвующие в формировании антиген-специфической популяции B-клеток за счет продукции IL-21 в [13]. В результате антигенинформированная популяция В-клеток трансформируется в плазмоциты и начинается синтез специфических аутоантител, которые играют ключевую роль в диагностике тиреопатологии и прогнозе исхода специфической терапии.
На наш взгляд, столь пристальное внимание к гуморальным факторам иммунитета при тиреоидной патологии не должно исключать интерес к патогенетическому значению циркулирующих лимфоцитов, специфически сенсибилизированных к тканевым антигенам ЩЖ.
В соответствии с клонально-селекционной теорией Ф.М. Бернета в ответ на повреждение тканей ЩЖ в результате внешних или внутренних (например, генетических) факторов освобождаются аутоантигены, они распознаются Т-хелперами и инициируют иммунный ответ. Из классической иммунологии известно, что любой ответ на антиген формируется по двум основным путям – Th1 и Th2. При активации Th1 пути развивается клеточный тип ответа с последующей активацией Fas-рецепторов на тиреоцитах, что приводит к их апоптозу, гибели тиреоидных фолликулов и развитию аутоиммунного процесса, в данном случае аутоиммунного тиреоидита Хашимото. При активации Th2-пути развивается гуморальный тип иммунного ответа с выработкой аутоантител к TSH-рецепторам тиреоцитов с дальнейшей их блокадой или стимуляцией [16]. Процесс гуморальной стимуляции иммунного ответа на тиреоантигены неизбежно заканчивается развитием либо болезни Грейвса, либо атрофического тиреоидита. Другими словами, тиреопатология иммунологически многокомпонентна и имеет различные пути активации иммунного ответа на тиреоидные антигены и различные варианты исхода этого ответа.
На наш взгляд, величина ИМЛ в присутствии РТА ГЩ довольно четко манифестирует эти процессы. Низкие значения ИМЛ при АИТХ, скорее всего, связаны с атакой тиреоидных фолликулов сенсибилизированными Т-лимфоцитами и резким снижением их выброса в кровоток. При усиленном гипертрофическом процессе в ткани железы (например, при болезни Грейвса) напротив, скорее всего, активируются В-лимфоциты (то есть иммунный ответ идет по Th2-пути), что приводит к усиленному синтезу антител, занятых в атаке на ткань ЩЖ. Сенсибилизированные лейкоциты устремляются в кровоток, и ИМЛ резко увеличивается. При гиперпластическом тиреоидите с выраженным склерозом и гиалинозом стромы иммунный ответ на антигены ЩЖ развивается одновременно по двум направлениям – Th1 и Th2. При этом наблюдается некоторое повышение процессов пролиферации в фолликулах на фоне гиалиноза стромы и самый низкий ИМЛ, что, на наш взгляд, может быть следствием малигнизации ткани железы или предиктором ее развития.
Таким образом, величина индекса миграции лейкоцитов в присутствии тканевого антигена ЩЖ в значительной степени отражает морфологические изменения в ней и может быть использована в качестве предиктора ее патологии. На наш взгляд, косвенным подтверждением данного допущения является выявленная корреляционная зависимость между эхографической картиной ЩЖ и уровнем анти-ТПО у пациентов с аутоиммунным тиреоидитом Хашимото [17].

