Внедрение сильных кислот между слоями графита – интеркалирование, как известно, широко применяется для изготовления различных изделий из графита и графито/графено наполненных композиций. Несмотря на то, что реакция интеркалирования графита изучается уже почти 90 лет [1] и опубликованы десятки работ на эту тему, многие особенности этого процесса недостаточно изучены. Так, общепризнанным фактом считается, что при использовании избытка серной кислоты и достаточного количества окислителя образуется бисульфат графита – соединение, описываемое брутто-формулой C24+.HSO4- .2H2SO4. В то же время при интеркалировании избытком азотной кислоты, которая сама по себе является окислителем, образуется C5+.NO3- [2] и даже C4.3+.NO3- [3]. При недостатке окислителя или кислоты или при применении других температур можно получить и другие отношения углерод/кислота, с большим количеством углерода, чем указано в [4–6], а также в [7–9]. Как правило, чем выше концентрация используемой кислоты, тем выше степень интеркалироваия. Несмотря на многочисленность работ по интеркалированию графита кислотами, получение столь разных по брутто-формуле интеркалятов не получило никакого рационального объяснения. Во многом это, по-видимому, связано с трудностями работы с графитом как химическим соединением.
Реакция интеркалирования, что очевидно, сильно зависит от диффузии реагентов между слоями графита, в силу чего нельзя быть полностью уверенным в том, что в условиях эксперимента интеркалирование прошло достаточно ровно по всей длине слоев графита, а разделение продуктов реакции невозможно. На интеркалирование также оказывает сильное влияние морфология твердой фазы. Например, в одних работах скорость реакции интеркалирования оказалась больше в мелких зернах графита [10], а в других исследованиях, наоборот, скорость интеркалирования была больше в более крупных зернах [11]. Разные образцы графита дают разные брутто-формулы интеркалирования у одних и тех же авторов [5, 9]. Дополнительно усложняет ситуацию то, что в интеркалятах при комнатной температуре продолжают протекать какие-то реакции [9, 12, 13]. Эти данные указывают на лабильность интеркалированных структур, а также на то, что важно правильно определить время установления равновесия в интеркалированных структурах.
В настоящей работе сделана попытка объяснить химический смысл той или иной стехиометрии при интеркаляции графита сильными кислотами на основе образования различных «малых» ароматических структур из бесконечной ароматической структуры графита и нанотрубок при интеркаляции сильными кислотами как без окислителей, так и в присутствии окислителей.
Модель
В органической химии известно, что сильные кислоты легко протонируют двойные связи, в том числе ароматических соединений. В низкомолекулярных ароматических соединениях за протонированием обычно следует реакция замещения ароматического водорода остатком кислоты с образованием, если рассматривать серную кислоту, сульфокислот. В графите такая реакция замещения невозможна, поэтому единственной реакцией после протонирования может быть только присоединение аниона кислоты к карбокатиону, образовавшемуся после протонирования, то есть логично, по нашему мнению, предположить, что серная кислота присоединяется по одной из двойных связей графита. Понятно, что связь HСn-ОSO3H в этом случае достаточно неустойчива и реакция (1) может быть существенно сдвинута влево.
Сn +НОSO3H  НСn++
НСn++
+-ОSO3H  HСn-ОSO3H. (1)
HСn-ОSO3H. (1)
Образование электро-нейтрального эфира HСn-ОSO3H, тем не менее, должно облегчать присоединение следующей молекулы серной кислоты и т.д. до некоторого «насыщения».
Это насыщение графита серной кислотой определяется (второе допущение) сохранением ароматического характера в молекулярных структурах графита. Имеется в виду следующее. Присоединение одной-двух молекул серной кислоты к двойным связям графита не может сильно изменить ароматический характер молекулы графита, которая может быть представлена комбинацией бесчисленного количества путей ароматического сопряжения, причем эта комбинация постоянно меняется. Это будет продолжаться до тех пор, пока количество двойных связей, присоединивших серную кислоту, относительно невелико. По мере присоединения все большего количества кислоты возможность образовывать ароматические структуры будет сокращаться из-за того, что ароматические структуры будут разделены местами присоединения кислоты. Чем больше присоединится кислоты, тем меньше будет размер ароматических фрагментов, пока не дойдет до некоторых критических для данных условий (концентрация и сила кислоты, температура, окислитель и др. условия) состояний, в котором реакция (1) остановится. Это и будет определять число «n» в HСn-ОSO3H.
Если предположить, что первой стадией интеркаляции является окисление графита, а не присоединение кислоты к двойной связи графита, то это не повлияет на наш конечный вывод. Тогда при первичном окислении графита будет образовываться катион радикал *Сn+. Если в присутствии избытка окислителя катион-радикал претерпевает дальнейшее окисление, то конечным продуктом реакции интеркаляции будет ZСn-ОSO3H, где Z = ОН, ОSO3H или другая функциональная группа (атом), химическое строение которой зависит от условий проведения реакции окисления. Если окисление катион-радикала не происходит, то он может сохраняться в таком виде при невысоких температурах. Известная формула бисульфата графита, C24+.HSO4- .2H2SO4, полученная многими авторами, отражает этот факт. Устойчивость катион-радикалов, центрированных на углероде, сильно зависит от возможности делокализации неспаренного электрона и катиона. В обоих случаях такая делокализация происходит лучше всего на ароматических фрагментах.
По мере протекания интеркаляции ароматические фрагменты уменьшаются в размерах. Логично предположить, что происходит упорядочение этих фрагментов благодаря возможности миграции присоединенных остатков сильной кислоты по причине обратимости реакции (1). Некоторые фрагменты Z также могут мигрировать, например:
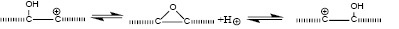 (2)
(2)
В реакции (2) вместо гидроксила могут легко участвовать эфиры кислород-содержащих кислот, такие как нитраты и сульфаты:
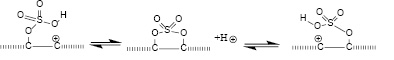 (3)
(3)
Миграция Z при Z = F или Cl, вероятно, затруднена, что приведет к образованию неупорядоченных структур в интеркаляте, если в качестве окислителя использовался фторирующий или хлорирующий окислитель. Действительно, многие авторы наблюдали ступенчатость в протекании реакции интеркалирования, как отмечалось во введении.
Таким образом, при глубоких степенях интеркаляции должны образовываться устойчивые структуры, которые, во-первых, состоят из ароматических фрагментов в сочетании с фрагментами окисления. Геометрия этих структур, во-вторых, позволяет собрать их в бесконечную бездефектную плоскость. Попробуем разобраться с такими структурами, используя известное правило Хюккеля для ароматичности.
Результаты исследования и их обсуждение
Самой малой структурой, удовлетворяющей обоим условиям, является I (ZС8-ОSO3H), представляющим собой бензол (С6) в соединении с ≡ СZ и/или ≡ C – OSO3H .
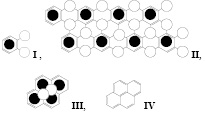
Здесь и далее для большей визуализации светлыми кружками обозначены места присоединения Z и/или кислотного остатка А, а черными – ароматический фрагмент. Из I можно легко составить бесконечную плоскую молекулу II, в которой каждый ароматический фрагмент бензола окружен sp3-гибридизированными атомами углерода. Структура представляется пределом интеркаляции графита, поскольку дальнейшее присоединение функциональных групп Z и А приведет к образованию полностью окисленного графита (graphite oxide), не содержащего ароматические структуры, и это окисление/интеркаляция становится необратимым.
По мере уменьшения степени интеркаляции (снижение концентрации кислоты НА, применение менее сильного окислителя и пр.) может образовываться структура III, ZС16-ОSO3H, основанная на молекуле пирена IV, которая после присоединения НА образует ароматический [14] аннулен. Из нее тоже можно собрать бесконечную плоскость V. Сульфированный перилен, VI, дает бесконечную плоскость ZС20-ОSO3H (VII). Устойчивость ему придает ароматическая система [18] аннулена, которая образуется после присоединения НА.
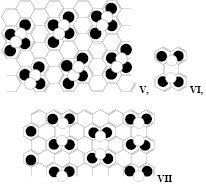
Дальнейшее снижение степени интеркаляции может привести к образованию структуры VIII, из которой можно построить бесконечную плоскость IX (ZС26-ОSO3H). Основа IX – коронен, который иногда называют «супербензолом», поскольку его электронная система сопряжения состоит из двух ароматических систем, центрального бензольного кольца и периферийного [22] аннулена. Еще большее соотношение углерод-кислота, ZС30-ОSO3H, можно найти у фрагмента X, также способного образовывать бездефектную бесконечную плоскость.
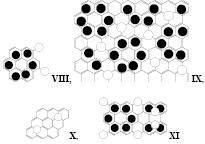
Некоторые смешанные структуры, например XI (ZС16-ОSO3H), также способны образовывать бесконечную ароматическую плоскостную молекулу, удовлетворяющую второму допущению. Среди других вариаций строений сульфированного графита со смешанными структурами мы нашли XII и XIII.
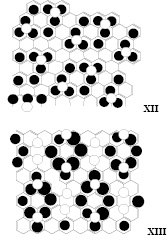
Структура XIII также удовлетворяет формуле ZС16-ОSO3H, полученной для структуры III. В случае образования при интеркаляции графита катион-радикалов, в найденных структурах катион и радикал могут располагаться на атомах обозначенных белыми кругами.
Какова же молекулярная структура бисульфата графита C24+.HSO4- .2H2SO4? Если эта формула корректна, то она может быть катион-радикалом коронена, поскольку графит можно представить в виде поликоронена XIV. Она же удовлетворяет структуре радикала XV, вариант структуры I. Как отмечалось в [1], формула C24+.HSO4- .2H2SO4 примерная. С учетом неточностей определения брутто-формулы интеркалирования, ее можно записать как C26+.HSO4- .2H2SO4, то структура сможет выглядеть как VIII. Получение структуры C26+ (VIII) зафиксировано при применении трифторсульфокислоты для интеркаляции графита [14].
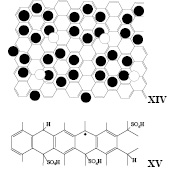
На основании вышеприведенных рассуждений мы предполагаем, что при интеркаляции графита азотной кислотой формула C4.3+.NO3- ближе к истинной структуре, чем C5+.NO3- и должна быть записана как C8(NO3)2 в соответствии со структурой I с небольшим включением неинтеркалированных доменов.
Полученные формулы выведены для идеального случая, когда использовался окислитель, недостаточный для окисления бензольного кольца, например пероксодисульфат, и при равномерном окислении каждого слоя графита.
Заключение
Предложено молекулярное строение графита, интеркалированного кислотами в равновесном состоянии. Молекулярная структура определяется разным соотношением между углеродом и кислотой при сохранении ароматичности составляющих ее доменов. Эти ароматические домены разделены между собой sp3-гибридизированными атомами углерода. В предельном состоянии (теоретически максимальная степень интеркаляции) интеркалят, способный к обратимости интервалирования, состоит из бензольных колец, разделенных sp3-гибридизированными атомами углерода.
Работа выполнена по теме Госзадания № 0082-2019-0003.

