Недостаток железа в питании вызывает заболевание растений, называемое железодефицитным хлорозом. Для коррекции этого заболевания используют растворы солей железа, которые при низких концентрациях малоэффективны, а при высоких – токсичны. В этих целях применяют также хелаты железа с различными синтетическими комплексонами. Однако последние, обладая высокой реакционной способностью, образуя растворимые в воде соединения с другими металлами и радионуклидами, способствуют миграции их в окружающую среду и вызывают экологические проблемы. В этой связи разработка новых безопасных и эффективных железосодержащих препаратов представляется важной и актуальной задачей. Реальную альтернативу синтетическим комплексонам представляют гуминовые вещества (ГВ) [1]. Железо может быть связано с гуминовыми веществами в виде комплексов, а также может присутствовать в составе гуминовых матриц в форме стабилизированных высокодисперсных гидратированных оксидов [2]. Высокую реакционную и сорбционную способность этим веществам обеспечивают основные структурные единицы, такие как ароматическое ядро и периферические функциональные группы. Эффективность использования синтезированных на основе ГВ препаратов предопределяют их многофункциональность, биологическая доступность и стабильность. Применение препаратов имеет особое преимущество, поскольку известно, что они снижают токсичность загрязняющих веществ и повышают устойчивость растений к химическому стрессу, стимулируют развитие корней и вызывают увеличение биомассы корней [3]. Гуминовые вещества представляют супрамолекулярные ансамбли, состоящие из однотипных по строению, но различающихся по структурным фрагментам и специфическим свойствам органических соединений, которые могут быть рассмотрены в нативных и модифицированных формах [4].
Цель исследования – изучение состава и характеристических свойств отдельных образцов гуминовых веществ с целью подбора органических прекурсоров для получения железосодержащих препаратов и предопределения формы железа в этих препаратах.
Материалы и методы исследования
В качестве органических прекурсоров для получения железосодержащих биоактивных препаратов были выбраны следующие гуминовые вещества: гуминовые кислоты (ГК), фульвокислоты (ФК), оксигуминовые кислоты (ОГК), гуминовые вещества продуктов анаэробной ферментации органического сырья (ГВм). Методы получения ГК, ФК и ОГК описаны в работе [5], а ГВм – в [6].
Препараты подвергались элементному анализу на автоматическом анализаторе (Carlo Erba, Италия). Содержание функциональных групп определяли методами химического анализа, описанными в работе [5]. ИК-спектры поглощения снимали в диапазоне 400–4000 см-1 на спектрометре LR-200 (Thermo Nicolet, USA) с использованием KBr. Спектры 13С ЯМР измеряли в растворах в среде 0.3 М NaOD/D2O на спектрометре Bruker Aspect 3000 с наблюдаемой частотой 100 МГц с использованием пульсирующей программы CPMG. 1H ЯМР спектры записаны на Bruker DMX 500 ЯМР – спектрометре при 303 К с использованием резонансной частоты, в которых магнитное поле (Н0) создается с помощью сверхпроводящего соленоида, работающего при температуре жидкого гелия, период релаксации 15 с.
Результаты исследования и их обсуждение
Гуминовые вещества не представлены индивидуальными химическими соединениями, поэтому элементный состав (углерод, водород, азот, кислород) является одним из их идентификационных признаков. Выражение элементного состава в массовых процентах не дает полного представления о роли отдельных элементов в построении молекул. Более информативное представление можно получить из соотношения содержания элементов в атомных процентах. Как показали результаты анализов (табл. 1), в ряду рассматриваемых прекурсоров наиболее высоким содержанием углерода обладают гуминовые кислоты. Наиболее низкое значение H/C для ГК указывает на преобладание в структуре этих соединений ароматических фрагментов. Для характеристики гуминовых веществ используют также атомное отношение O/C, величина которого зависит от содержания кислородсодержащих функциональных групп в их составе Значение O/C для ФК, ОГК и ГВм выше, чем для ГК, что свидетельствует о значительном вкладе периферических фрагментов в структуру этих образцов гуминовых веществ. В исследуемых образцах ГВ от 61,57 % до 79,60 % кислорода распределено между тремя типами функциональных групп: карбоксильными, фенольными, карбонильными (табл. 2). Доля кислорода, входящего в состав функциональных групп, выше для оксигуминовых кислот. Не все атомы кислорода, входящие в состав исследуемых препаратов, выявляются в указанных функциональных группах.
Таблица 1
Элементный состав гуминовых прекурсоров
|
Препараты |
Влага, % w |
Зола, % A |
Элементный состав органической массы |
|||||||||||
|
Массовые проценты |
Атомные проценты |
Соотношения |
||||||||||||
|
C |
H |
N |
S |
O |
C |
H |
N |
S |
O |
H/C |
O/C |
|||
|
ГК |
8,97 |
5,10 |
63,93 |
4,07 |
1,17 |
0,33 |
30,50 |
46,80 |
35,77 |
0,70 |
0,05 |
16,72 |
0,76 |
0,36 |
|
ФК |
7,80 |
4,40 |
60,30 |
4,20 |
4,80 |
0,28 |
30,47 |
44,55 |
37,12 |
0,60 |
0,07 |
17,70 |
0,83 |
0,39 |
|
ОГК |
9,80 |
3,16 |
61,62 |
4,27 |
1,02 |
0,30 |
32,76 |
44,31 |
37,62 |
0,51 |
0,08 |
17,56 |
0,85 |
0,40 |
|
ГВм |
10,2 |
7.90 |
62,18 |
4,40 |
0,82 |
0,22 |
32,80 |
38,10 |
36,01 |
5,25 |
0,08 |
20,64 |
0,95 |
0,54 |
Таблица 2
Характеристика состава функциональных групп в гуминовых препаратах
|
Препарат |
Содержание |
Распределение кислорода между функциональными группами, % |
Общее содержание кислорода ГП, % |
Доля кислорода функц. групп в общем содержании кислорода, % |
Доля кислорода, входящего в другие структурные фрагменты |
||||||||
|
мМ/г |
% от общего содержания кислорода в ГВ |
||||||||||||
|
COOН |
Ar-OH |
C=O |
COOH |
Ar-OH |
C=O |
Учтенный кислород, % |
COOH |
Ar-OH |
C=O |
||||
|
ГК |
5,34 |
2,40 |
1,44 |
24,03 |
4,08 |
4,02 |
23,34 |
17,20 |
3,84 |
2,30 |
30,50 |
76,52 |
23,47 |
|
ФК |
5,81 |
3,90 |
2,65 |
26,15 |
6,63 |
7,72 |
29,04 |
18,56 |
6,24 |
4,24 |
39,46 |
73,59 |
26,41 |
|
ОГК |
6,52 |
4,00 |
2,96 |
28,83 |
6,94 |
8,28 |
32,08 |
20,83 |
6,52 |
4,73 |
40,30 |
79,60 |
20,70 |
|
ГВм |
4,61 |
20,74 |
2,40 |
4,08 |
1,44 |
4,02 |
20,86 |
14,72 |
3,84 |
2,30 |
30,47 |
68,46 |
31,53 |
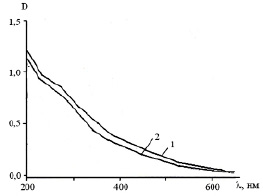
Рис. 1. УФ-видимые спектры гуминовых препаратов: ГК (1), ФК (2)
Оставшуюся часть кислорода следует отнести к структурным фрагментам ГВ, включающим эфирные, сложноэфирные, спиртовые, метоксильные и другие группы. Кроме того, в ядерной части молекулярного строения ГВ могут присутствовать хинонные группировки, а также кислородсодержащие гетероциклические структуры [7]. Наиболее высокое содержание кислорода, входящего в эту часть структурных фрагментов, наблюдается для ГВм. Значения рК ионизации для карбоксильных групп исследуемых препаратов варьируют в пределах от 4,49 до 5,61 и для фенольных групп – от 7,98 до 8,95. Благодаря разнообразию способов связывания в гумусовых веществах мономерных структурных единиц, различающихся по своей химической природе, протоногенные центры могут оказаться на участках, характеризующихся различным электронным строением и энергетической характеристикой. Большое значение при этом имеет сопряжение электронов кислорода функциональных групп с π-электронной системой ароматических структурных фрагментов макромолекул, которое вызывает снижение на кислороде эффективного отрицательного заряда и вследствие этого служит причиной их повышенной протоногенности [8].
В электронных спектрах всех исследуемых препаратов наблюдается понижение интенсивности поглощения с увеличением длины волны, что объясняется, как правило, присутствием в структуре подобных соединений хромофоров, которые поглощают во всей анализируемой области [9]. В некоторых из них проявляется плечо вблизи 275 нм (рис. 1).
Поглощение при 275 нм относят к π – π* электронному переносу в фенольных структурах, ароматических углеводородах с двумя и более кольцами, а также к конъюгированным ароматическим кольцам. Еще одним важным из диагностических критериев ГВ, которое не зависит от концентрации, определяется только структурой и соотносится со степенью конденсированности ароматических фрагментов, является коэффициент цветности E4/E6. Коэффициент цветности E4/E6 определяют по отношению поглощения при 465 нм к таковому при 665 нм. В наших исследованиях пониженные значения соотношения E4/E6 равные 2,50 и 3,3 наблюдаются для ГК и ГКм соответственно. ОГК и ФК характеризуются более высокими величинами соотношения E4/E6 (5,00 и 4,50), подтверждающими, что основная часть хромофоров в их структуре сконцентрирована в карбоксильных, карбонильных С=О и ароматических С=С.
ИК-спектры исследуемых препаратов имеют характерный облик и предоставляют определенные сведения о природе структурных фрагментов, природе связей и общем мотиве построения [10]. В спектрах ГК (рис. 2, а) имеется широкая и интенсивная полоса в области 3450–3300 см–1, относящаяся к гидроксильным ОН и NН группам, образующим водородные связи. Характеристическая полоса с максимумом 1720–1700 см–1 относится к С=О карбоксилов альдегидов и кетонов. В области 1470–1370 см–1 имеются несколько полос. Эти полосы обусловлены деформационными колебаниями С –Н, О–Н и С–О групп. Поглощение между 1250 см–1 и 1246 см–1 относится к вибрационным колебаниям О–Н и С–О карбоксильных групп.
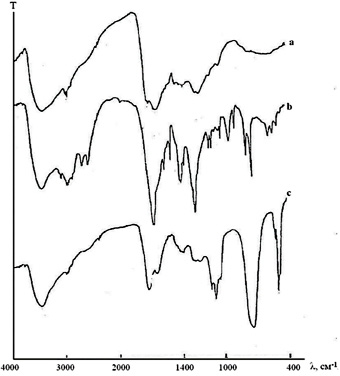
Рис. 2. ИК-спектры гуминовых кислот (а), фульвокислот (b) и оксигуминовых кислот (с)
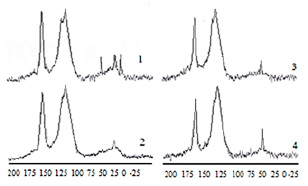
Рис. 3. 13С ЯМР спектры препаратов: ГК(1), ФК (2), ГВм (3), ОГК(4)
Деформационные колебания спиртовых гидроксилов четко проявляются при 1150–1050 см–1. Имеются слабоинтенсивные полосы между 900–750 см–1, которые обычно относят к деформационным колебаниям С–Н в ароматических структурах.
ИК-спектры ФК и ОГК (рис. 2, b, с) отличаются присутствием относительно четких и дискретных пиков при определенных длинах волн, что указывает на их более высокую молекулярную организацию по сравнению с другими гуминовыми веществами. В этих же спектрах содержатся интенсивные полосы поглощения в области проявления спиртовых гидроксилов и простых эфиров (1130–1110 см–1). ФК и ОГК помимо того, что в значительной степени обогащены карбоксильными, фенольными и карбонильными группами, они содержат также хиноидные (1640–1600 см–1), а также метоксильные (1460–1450 см–1) группы. Значительный вклад карбонилсодержащих фрагментов (альдегиды, кетоны, карбоновые кислоты, эфиры) в структуру исследуемых гуминовых препаратов выражается интенсивной полосой при 1705 см–1 и 1430 см–1. Эти полосы хорошо выражены в ИК-спектрах ОГК и ГК.
Отнесение сигналов в спектрах ЯМР гуминовых прекурсоров проводилось согласно данным, описанным в работе [11]. Как показали данные 13C ЯМР- спектроскопии (рис. 3), в структуре всех рассматриваемых образцов четко просматриваются ароматические фрагменты. Выявлено усиление ароматических сигналов в 13С ЯМР спектрах в следующем ряду: ОГК > ФК > ГК > ГВм. Наблюдаются различия в интенсивности сигналов, относящихся к алкил-замещенным и незамещенным ароматическим структурам. Содержание углерода в Ar-O, N в отдельных образцах препаратов варьирует в интервале 5,9–11,9 %. Незамещенная ароматическая часть в структуре исследуемых препаратов характеризуется самым высоким содержанием углерода.
В ФК и ОГК наблюдается повышенное содержание кетонных и хинонных групп. Углерод С=О в ФК составляет 6,5 %. Во всех других исследуемых образцах содержание этих групп ниже и углерод, входящий в их состав, находится на уровне 4,2–5,6 %. В составе всех препаратов имеются карбоксильные и сложноэфирные группы. Доля CCOOH-H,R составляет от 16,7 % до 19,5 % от общего содержания углерода (табл. 3).
Спектры 1Н ЯМР препаратов представлены на рис. 4.
Протоны гуминовых веществ подразделяют на два основных типа: подвижные протоны функциональных групп (СООН, СAr –ОН и СAlk –ОН), спиртовых (ОН) фрагментов и протоны углеродного скелета, среди которых выделяют ароматические (СAr –Н), алифатические (СAlk –Н). Содержание ароматических протонов в исследованных препаратах различается незначительно и характеризуется высоким уровнем (от 49,6 % до 56,5 %). Однако следует заметить, что максимальное содержание Н-замещенных ароматических фрагментов наблюдается для препарата ОГК, а для ГВм оно ниже, чем для других препаратов.
Различия наблюдаются для соотношения скелетных протонов СArH/HAlk., которое максимально в случае ОГК (1,74), минимально для ГВм (1,34). Для других препаратов это соотношение находится в диапазоне между указанными величинами (табл. 4).
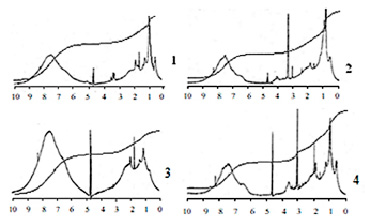
Рис. 4. 1Н ЯМР спектры препаратов: ГВм (1), ГК (2), ОГК (3), ФК (4)
Таблица 3
13С ЯМР спектральные интегралы для гуминовых препаратов
|
№ |
Образцы М. д. |
С = 0 220 –187 М. д. |
COO –H, R 187–165 М. д. |
Ar –O, N 165 –145 М. д. |
Ar –H, C 145–108 М. д. |
OC –O, N 108 –90 М. д. |
CH–O, N 90 –64 М. д. |
СН2–O, N 64 –58 М. д. |
СН3O 58 –48 М. д. |
CH –H, C 48 –5 М. д. |
∑СAlk |
∑СAr |
∑СAr / ∑СAlk |
|
1 |
ГК |
5,6 |
18,8 |
11,9 |
50,2 |
1,8 |
0,5 |
0,4 |
1,1 |
8,1 |
11,9 |
60,0 |
5,04 |
|
2 |
ФК |
6,5 |
19,2 |
11,6 |
52,1 |
1,9 |
0,4 |
0,2 |
0,7 |
7,0 |
10,2 |
63,7 |
6,24 |
|
3 |
ГВм |
4,8 |
18,0 |
7,8 |
51,7 |
1,6 |
0,9 |
0,7 |
1,8 |
11,7 |
17,1 |
59,5 |
3,47 |
|
4 |
ОГК |
5,1 |
19,5 |
9,2 |
51,9 |
1,8 |
0,5 |
0,4 |
1,3 |
7,0 |
11,0 |
64,4 |
5,85 |
Таблица 4
1H ЯМР спектральные интегралы для гуминовых препаратов
|
№ |
Структурные фрагменты |
Ароматический протон |
O-CH-ON |
CH-О,N |
α-СН* |
Alk-Н |
СArH/HAlk |
|
Интервал, м.д. |
10,0–6,0 |
6,0–4,8 |
4,6–3,2 |
3,2–2,05 |
2,05–0,0 |
||
|
1 |
ГК |
54,2 |
1,5 |
1,7 |
8,9 |
33,6 |
1,61 |
|
2 |
ФК |
52,0 |
1,8 |
2,2 |
8,9 |
35,1 |
1,48 |
|
3 |
ОГК |
56,5 |
1,6 |
1,2 |
8,2 |
32,4 |
1,74 |
|
4 |
ГВм |
49,6 |
1,9 |
1,6 |
9,8 |
37,0 |
1,31 |
*α-СН – протоны алифатических групп в α положении к электроотрицательным группам или ароматическому кольцу.
Данные 1Н ЯМР спектроскопии также показывают, что сигналы алкильных фрагментов изменяются в порядке, противоположном изменению ароматических С-Н. При рассмотрении алифатической части структуры гуминовых препаратов обнаруживается, что для всех образцов и вне зависимости от соотношения СAr – Н/НAlk в области 3,2–2,05 м.д выявляются от 8,2 % до 9,8 % алифатических протонов. Это указывает на общий принцип строения алифатической части ГВ, для которой характерно наличие СН-групп в α положении к электроотрицательным группам ароматического ядра. Все подвижные протоны функциональных групп проявляются в области 6,0–4,8 м.д. Такие протоны более выраженно проявляются в ГК, ФК, ОГК. В других препаратах количество функциональных групп с подвижными протонами незначительно ниже.
Заключение
Рассмотренные гуминовые вещества имеют однотипное молекулярное строение, характеризуются присутствием в их структуре ароматических фрагментов разной степени конденсированности. Наблюдаются различия в интенсивности сигналов, относящихся к алкил-замещенным и незамещенным ароматическим структурам. Содержат множество кислородсодержащих функциональных групп, прикрепленных к ароматическим или алифатическим фрагментам. В составе этих групп выявлены два основных типа подвижных протонов: а) протоны, принадлежащие функциональным группам (СООН, CAr–ОН и CAlk–ОН) и спиртовым (ОН) фрагментам; б) протоны углеродного скелета, среди которых выделяют ароматические (СAr–Н), алифатические (СAlk–Н). Реакционная способность гуминовых веществ, предназначенных для использования в качестве прекурсоров железосодержащих препаратов, будет определяться их вышеуказанными характеристическими особенностями.

