Магнитные наночастицы оксида железа являются репрезентативным кандидатом многофункциональных наноматериалов с растущим использованием во многих биомедицинских полях, включая магнитный резонанс визуализации (МРТ), биологический катализ, магнитную гипертермию, магнитное наведение, магнитное сепарация, фотореактивную терапию и доставку наркотиков, и в настоящее время широко используются в диагностике и лечении опухолей [1-3]. Как известно, для повышения контрастности МРТ-изображений применяют различные парамагнитные контрастирующие агенты, влияющие на времена продольной (Т1) и поперечной (Т2) ядерной магнитной релаксации [4]. Например, на основе соединений (прежде всего органических комплексов) гадолиния получаются Т1-контрастные агенты, сокращающие время продольной релаксации (r1), а на основе суперпарамагнитных наночастиц магнетита – Т2-контрастные агенты, поперечной релаксации (r2). Контрастные агенты на основе гадолиния являются наиболее важными и наиболее распространенными контрастирующими агентами для МРТ [5, 6, 7]. Между тем сегодня появляется все больше информации о токсических эффектах гадолиний-содержащих МРТ-контрастирующих агентов, что связано с токсическими эффектами свободных ионов гадолиния, депонируемых в различных органах и тканях и вызывающих развитие нефрогенного системного фиброза [8]. Это приводит к отзыву разрешений на использование контрастирующих агентов на основе гадолиния в ряде стран [9]. Если в клинической практике пока нет наночастиц соединений гадолиния (судя по всему, и не предвидится), то ряд наночастиц на основе оксидов железа (магнетиты Fe3O4 и маггемиты γ-Fe2O3) уже используют [10], в том числе и коммерческие предприятия (например, Endorem®, Ferumoxytol®, Supravist®). Обычно их модифицируют органическими молекулами, включая фосфат-дендримеры [11], карбоновые кислоты (лимонную [12], димеркапто-янтарную [13]), полимеры (полиэтиленгликоль [14], винилацетат или декстран [15] и пр.). Таким образом, разработка новых мультифункциональных контрастирующих агентов на основе наночастиц оксида железа является перспективным направлением. В рамках данной работы нами предложена новая схема синтеза наночастиц оксида железа, допированных гадолинием (Fe3O4:Gd), обладающих высокой степенью агрегативной устойчивости, и проведена комплексная оценка их цитотоксичности in vitro.
Цель исследования – комплексный анализ цитотоксического действия нового нанотераностика на основе оксида железа Fe3O4:Gd, допированного гадолинием, на культурах нормальных и трансформированных клеток млекопитающих.
Материал и методы исследования
Синтез и физико-химическая характеристика наночастиц Fe3O4:Gd. Наночастицы Fe3O4:Gd получали путем гидролиза хлорида железа (FeCl2 и FeCl3) и хлорида гадолиния (GdCl3) в эквимолярных концентрациях в присутствии концентрированного раствора аммиака и изопропилового спирта. В качестве стабилизатора была использована лимонная кислота, которая является биосовместимым лигандом и эффективным стабилизатором коллоидного золя. Рентгенофазовый анализ образца проводили с использованием дифрактометра Bruker D8 Advance (CuKα-излучение, θ–2θ-геометрия) в диапазоне углов 10°–80° 2θ с шагом 0,02° и временем накопления сигнала не менее 0,3 с на точку. Микроструктуру образца наночастиц Fe3O4:Gd изучали методом просвечивающей электронной микроскопии на электронном микроскопе Leo912 AB Omega (ускоряющее напряжение 100 кВ).
Культуры клеток. В исследовании было использовано 5 различных типов клеточных культур (остеосаркома человека линии MNNG/Hos, карцинома человека линии NCI/ADR, меланома мыши линии B16/F10, карцинома мыши линии EMTP6 и мезенхимальные стволовые клетки человека, выделенные из пульпы зуба (МСК) человека), депонированные в биобанке клеточных культур лаборатории тераностики и ядерной медицины ИТЭБ РАН. Клетки культивировались при 5%-ном содержании СО2 и 95%-ной влажности в инкубаторе. Клетки культивировались в культуральных флаконах 25 см2 (SPL, Корея) в среде ДМЕМ/Ф12 («ПАнЭко», Россия), содержащей 10% эмбриональной телячьей сыворотки и 200 ед. смеси антибиотиков (пенициллин/стрептомицин). Клетки снимались с культурального пластика путем их обработки раствором трипсин/версен 0,025% («ПАнЭко», Россия). Перед внесением наночастиц клетки трижды промывали раствором Хэнкса («ПАнЭко», Россия).
Анализ метаболической активности клеток после инкубации с наночастицами Fe3O4:Gd (МТТ тест). Анализ жизнеспособности клеточных культур после 24 и 72 часов инкубации с наночастицами в различных концентрациях (100–200 мкг/мл) проводился с использованием колориметрического МТТ-теста (тетразолиевый краситель 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид). Клетки высеивались в 96-луночные культуральные планшеты (SPL, Корея) в плотности 25 тыс/см2 в среде ДМЕМ/Ф12+10% эмбриональной телячьей сыворотки, к которым через 6 часов вносились различные концентрации наночастиц Fe3O4:Gd (10-200 мкг/мл). Через 24 или 72 часа среда заменялась на среду, содержащую 0,5 мг/мл раствора тетразоля, и клетки инкубировали в течение 3 часов в СО2 инкубаторе. Далее образовавшиеся в лунках кристаллы формазана растворяли ДМСО и измеряли оптическую плотность растворенного формазана при длине волны 540 нм.
Анализ жизнеспособности клеток после инкубации с наночастицами Fe3O4:Gd (Live/Dead assay). Для определения количественного соотношения живых и мертвых клеток в культуре после инкубации с наночастицами были использованы набор красителей LUCS13, окрашивающий все клетки, и йодид пропидия (PI), окрашивающий ядра только мертвых клеток. Данный метод основан на различной проницаемости живых и мертвых клеток. Наличие в клеточной мембране перфораций – критический фактор, несовместимый с жизнеспособность клеток, что обеспечивает проникновение красителя. Подсчет клеток проводился по микрофотографиям, полученным с использованием инвертированного микроскопа Zeiss Axiovert 200 при 200-кратном увеличении.
Анализ апоптоза клеток после инкубации с наночастицами Fe3O4:Gd. Для количественного определения апоптотических клеток был использован набор селективных красителей YO-PRO™-1 Iodide (491/509) (Thermo Fisher Scientific). Данный набор основан на селективной проницаемости клеточной мембраны для флуоресцентных красителей, детектирующих апоптотические изменения в клетке. Подсчет клеток проводился по микрофотографиям, полученным с использованием инвертированного микроскопа Zeiss Axiovert 200 при 200-кратном увеличении при длинах волн возбуждения и эмиссии (491/509 нм).
Статистическая обработка. Статистическая обработка полученных данных проводилась с использованием программного модуля GraphPad 8.5. Достоверные различия экспериментальных групп выявляли с использованием t-критерия Стьюдента.
Результаты исследования и их обсуждение
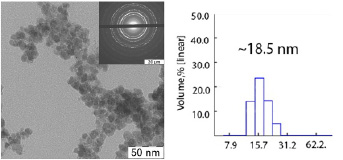
В результате синтеза был получен электростатически стабилизированный золь диоксида церия с размером частиц порядка 15–20 нм по данным просвечивающей электронной микроскопии (рис. 1 А). Для функционализации поверхности наночастиц был выбрана лимонная кислота, являющаяся широко используемым биосовместимым лигандом, которая обеспечила высокую стабильность полученного коллоидного золя, а гидродинамический диаметр в воде (MQ) составил около 20 нм (рис. 1 Б).
Для выявления цитотоксических эффектов был проведен анализ метаболической активности клеточных культур методом МТТ-теста через 24 и 72 часа сокультивирования с наночастицами в широком диапазоне концентраций (10–200 мкг/мл). Выявлено, что наночастицы Fe3O4:Gd не производили токсического эффекта на клетки остеосаркомы человека линии MNNG/Hos и карциномы мыши линии EMTP6 во всех исследованных концентрациях (рис. 2 А, Б) как через 24 часа, так и через 72 часа сокультивирования. Культуры раковых клеток линий B16/F10 и NCI/ADR оказались более чувствительными и снижали уровень метаболической активности до 70–80% через 72 часа после внесения наночастиц (рис. 2 В, Г). Стоит отметить, что культура NCI/ADR показала более выраженное снижение метаболической активности (до 50%) по сравнению с клетками меланомы мыши. Мезенхимальные стволовые клетки человека, выделенные из пульпы зуба, также показали снижение жизнеспособности через 72 часа сокультивирования для всех исследованных концентраций (рис. 2 Д).
А Б
Рис. 1. (А) Просвечивающая электронная микроскопия и (Б) гидродинамический диаметр, полученный методом динамического рассеяния света наночастиц Fe3O4:Gd в воде
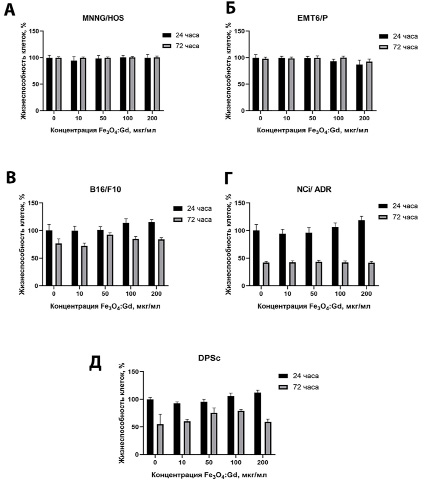
Рис. 2. Анализ метаболической активности клеток после инкубации с наночастицами Fe3O4:Gd в течение 24 и 72 часов: (А) клетки остеосаркомы человека линии MNNG/HOS; (Б) клетки опухоли молочной железы мыши линии EMT6/P; (В) клетки меланомы мыши линии B16/F10; (Г) клетки рака яичников человека линии NCi/ADR; (Д) мезенхимальные стволовые клетки человека
Далее методом дифференциального окрашивания был проведен анализ количества апоптотических клеток (Yo-Pro-1) через 24 и 72 часа. Культура клеток MNNG/Hos после инкубации с наночастицами не показала достоверного увеличения числа апоптотических клеток (рис. 3А). В культуре карциномы мыши линии EMTP6 в контрольной группе детекрировался высокий уровень мертвых клеток (рис. 3 Б). Максимальная концентрация наночастиц Fe3O4:Gd в концентрации 200 мкг/мл через 72 часа вызвала достоверное увеличение доли апоптотических клеток. Культура клеток меланомы мыши линии B16/F10 показала достоверное увеличение доли апоптотических клеток в большинстве исследованных концентраций, кроме максимальной (200 мкг/мл) (рис. 3 В). Максимальная концентрация наночастиц показала увеличенное число апоптотических клеток непосредственно через 72 часа. При этом стоит отметить, что, несмотря на значительное снижение метаболической активности клеток линии NCI/ADR через 24 и 72 часа после инкубации с наночастицами Fe3O4:Gd, достоверно не увеличивается количество апоптотических клеток (рис. 3 Г). Аналогичная тенденция наблюдается и для культуры МСК человека: метаболическая активность клеток по данным МТТ-теста значительно снижается через 72 часа, однако не происходит детекции апоптотических клеток через 72 часа (рис. 3 Д). Такой эффект, по всей видимости, может быть связан с развитием состояния окислительного стресса, но не гибелью клеток.
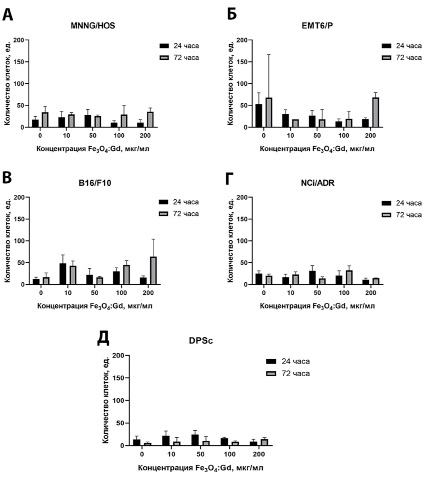
Рис. 3. Результаты анализа количества апоптотических клеток после инкубации с наночастицами Fe3O4:Gd в течение 24 и 72 часов: (А) – клетки остеосаркомы человека линии MNNG/HOS; (Б) – клетки опухоли молочной железы мыши линии EMT6/P; (В) – клетки меланомы мыши линии B16/F10; (Г) – клетки рака яичников человека линии NCi/ADR; (Д) – мезенхимальные стволовые клетки человека
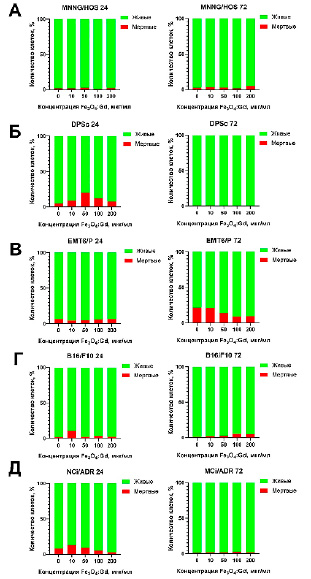
Рис. 4. Анализ доли мертвых клеток по отношению к количеству живых клеток после инкубации с наночастицами Fe3O4:Gd в течение 24 и 72 часов: (А) клетки остеосаркомы человека линии MNNG/HOS; (Б) клетки опухоли молочной железы мыши линии EMT6/P; (В) клетки меланомы мыши линии B16/F10; (Г) клетки рака яичников человека линии NCi/ADR; (Д) мезенхимальные стволовые клетки человека. Данные были получены методом флуоресцентной микроскопии с использованием красителя йодид пропидия для детектирования мертвых клеток (красный), далее подсчет доли производился относительно общего количества клеток по результатам окрашивания красителем Hoechst 33342
Анализ соотношения живых и мертвых клеток после 24-часовой инкубации с наночастицами в культуре клеток линии MNNG/Hos не выявил повышения числа мертвых клеток. Аналогичная картина наблюдается и через 72 часа сокультивирования, за исключением максимальной концентрации 200 мкг/мл, где наблюдается рост числа мертвых клеток (рис 4. А). Наиболее выраженный рост числа мертвых клеток через 24 часа сокультивирования наблюдается в культуре МСК человека и культуры NCI/ADR (рис. 4. Б). В отношении культуры клеток карциномы мыши через 72 часа сокультивирования с наночастицами отмечено значительное увеличение числа мертвых клеток (до 20%) (рис 4.В).
Заключение
Разработана новая схема синтеза наночастиц оксида железа, допированных гадолинием, которые обладают высокой коллоидной стабильной, малым гидродинамическим диаметром (не более 20 нм) и высокой степенью биосовместимости (IC50 выше 100 мкг/мл). Снижение метаболической активности некоторых культур раковых и нормальных клеток в высоких концентрациях наночастиц через 72 часа инкубации связано с развитием апоптоза. Дальнейший анализ достоверно выявил рост числа мертвых клеток после 72 часов сокультивирования. Нами выдвинуто предположение о том, что выявленная селективная токсичность наночастиц связана с различной эффективностью эндоцитоза синтезированных наночастиц для каждого типа использованных в исследовании клеточных культур, а также их дифференциального процессинга уже непосредственно внутри клетки.
Работа выполнена при финансовой поддержке Государственного задания Российской Федерации (075-01027-22-01).

