Современное сельское хозяйство невозможно без использования пестицидов, используемых для борьбы с вредителями, сорными растениями, и для повышения урожайности культур. Пестициды могут не оказывать влияние на почвенное микробное сообщество. Чаще отмечают снижение численности и разнообразие бактерий в почвах, подвергшихся обработке пестицидами [1]. Изменение равновесия в микробиоценозе связывают с внесением высоких доз пестицидов в почву, в десятки раз превышающих норму внесения [2].
Недостаточно изучено влияние пестицидов на патогенные бактерии фекального происхождения, которые определяют эпидемиологическую опасность почвы сельскохозяйственных угодий. Патогенные кишечные бактерии не принимают какое-либо существенное участие в разложении пестицидов. Почва и ее микробное сообщество являются агрессивной средой в отношении этих бактерий, размножающихся в кишечном тракте теплокровных животных. Не ясны вопросы их выживаемости, устойчивости и натурализации в почве. Сложно предугадать характер воздействия на отдельные микроорганизмы самого пестицида и продуктов его деструкции, поскольку основные направления реакций окисления и образования метаболитов представляют собой сложный биохимический процесс [3].
В соответствии с нормативными требованиями при обосновании ПДК пестицидов собирают информацию и проводят исследования воздействия пестицидов на почвенные микроорганизмы. Проведение экспериментальных лабораторных исследований подразумевает подбор тестовых микроорганизмов, наиболее чувствительных к химическим веществам. Для учета этих микроорганизмов должны быть разработаны методики их выделения из почвы и подсчета, подобраны селективные дифференциально-диагностические среды.
Цель исследования: изучить в эксперименте влияние десятикратной нормы внесения в почву двух химических веществ – инсектицида и гербицида, на численность, культуральные, морфологические и биохимические свойства тест штаммов кишечных патогенных и условно-патогенных бактерий. Оценить возможность использования этих бактерий как дополнительный к ОМЧ и дегидрогеназной активности показатель для определения пороговой концентрации пестицидов в почве.
Материалы и методы исследования
Для эксперимента использовали просеянный песок, прогретый при температуре 105° С в течение 1 часа для снижения численности вегетативных форм бактерий. Из-за низкого содержания органического вещества влияние иммобилизации и инактивации пестицидов на результаты эксперимента были минимальны. Для моделирования процесса в песок добавляли стерильную водопроводную воду (60% влажность), пестициды в концентрации в 10 раз выше нормы внесения, и тест штаммы бактерий. Пестицид 1 – действующее вещество химического класса пиретроидов, используемое в сельском хозяйстве для борьбы с вредными насекомыми и вредителями. Низкотоксично по отношению к птицам, не причиняет вреда дождевым червям. Токсично для пчел и других полезных насекомых. Высокотоксичное для рыб. Вещество практически не растворимо в воде, поэтому навеска для 10-кратной концентрации подготовлена в 10 мл ацетона (из расчета на 5 кг). Внесено по 1 мл в 75 мл стерильной водопроводной воды до заражения бактериями (0,15 мг/0,5 кг).
Пестицид 2 – действующее вещество химического класса фенилпиразолы, являющееся системным гербицидом – ингибитором ацетил-КоА-карбоксилазы. 10-кратная концентрация подготовлена в 10 мл (из расчета на 5 кг). Внесено по 1 мл в 75 мл стерильной водопроводной воды до заражения бактериями (0,15 мг/0,5 кг).
Бактерии: Shigella dysenteriae 1 № 1362, Shigella flexneri 1a №8516, Salmonella enterica susp. enterica serovar Typhimurium 79, Salmonella enterica susp. enterica serovar Enteritidis АТСС 13076, Escherichia coli АТСС 11229, Enterococcus faecalis АТСС 23655. Внесено по 0,5 мл суспензии бактерий каждого вида примерно 109 кл/мл (по стандарту ОСО) на 0,5 кг почвы в стеклянных стаканах для создания концентрации бактерий около 105 КОЕ/г почвы.
После одновременного внесения пестицидов и бактерий проведено ручное перемешивание почвы. В течение всего эксперимента поддерживали стабильные температурные условия и влажность. Пробы отбирали на 5, 11, 20, 31 и 60, 90 сутки эксперимента. Для исследования асептически отбирали 10 г навески почвы, из которых после роторного размешивания при 150 об./мин. в течение 15 минут, готовили разведения для количественного посева. Численность типичных по культуральным признакам кишечных бактерий учитывали методом посева на поверхность агаризованных диагностических питательных сред: питательный агар, сальмонелле-шигелла агар (SS – агар), висмут сульфит агар (ВСА – агар), агар с канамицином, эскулином и азидом натрия Мерк, Эндо агар, хромогенный агар Мерк для E. coli и колиформных бактерий. После учета презумптивных колоний проверяли их некоторые биохимические свойства. Общее микробное число (ОМЧ) – методом посева на чашки Петри с ГРМ агаром из десятикратных разведений почвы в водопроводной воде. При этом изучали динамику ОМЧ по отдельности в почве с разными внесенными бактериями. На 20, 30 и 60, 90 сутки дополнительные навески почвы для предварительного обогащения помещали на 4 часа в забуференную пептонную воду, затем на 20 часов на жидкие селенитовый бульон, Раппапорта – Василиадиса бульон, лактозо – пептонный бульон. Из них делали высев петлей на агаризованные среды. Дегидрогеназную активность почвы определяли спектрофотометрическим методом.
Результаты исследования и их обсуждение
Прямым методом посева без предварительного обогащения оценили реальную численность жизнеспособных кишечных бактерий спустя 11 суток после инокуляции в почву (табл. 1).
Морфологические характеристики колоний на питательных средах, выделенных после 11 суток пребывания в почве с пестицидами, в сравнении этими же суточными культурами из коллекции были характерными для данных видов бактерий. Микроскопирование препаратов бактерий также не показало визуальных отличий от суточной коллекционной культуры.
Таблица 1
Морфологическая характеристика колоний бактерий и их численность в почве с пестицидами через 11 суток после заражения
|
Микроорганизм |
Численность, КОЕ/г |
Морфология колоний (прямой метод выделения из почвы) |
|
|
Гербицид |
Инсектицид |
||
|
Shigella dysenteriae |
4,0х103 |
4,5х103 |
На среде Эндо – колонии бледные с розовым центром 2 мм, блестящие, круглые. На SS агаре – очень мелкие менее 1 мм, прозрачные |
|
Shigella flexneri |
3,0х103 |
9,0х102 |
|
|
Salmonella typhimurium |
3,1х103 |
2,2х103 |
На среде Эндо – бледно-розовые 1-2 мм с выпуклым розовым центром, блестящие круглые 1-2 мм. На ВСА колонии мелкие 1 мм, черные, блестящие, с отпечатком на агаре. |
|
Salmonella enteritidis |
3,0х102 |
3,0х102 |
На среде Эндо колонии 2 мм, круглые, бледные с розовым центром. ВСА колонии мелкие, темно – зеленые, без отпечатка. |
|
Escherichia coli |
1,7х103 |
3,7х103 |
На среде Эндо – темно красные колонии с неровным волнистым краем и металлическим блеском 1-2 мм. На хромогенном агаре – бета-глюкуронидаза-положительные синие колонии с неровным краем, плоские, круглые – до 2 мм. |
|
Enterococcus faecalis |
3,3х10 |
1,0х10 |
На среде с канамицином – мелкие колонии черного цвета, окруженные темной зоной. |
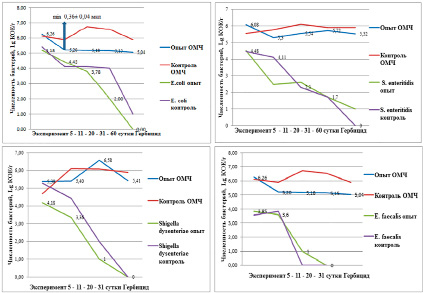
Рис. 1. Влияние гербицида из класса фенилпиразолы на численность бактерий
Постановка некоторых основных дифференцирующих биохимических тестов показала соответствие свойств выделенных из почвы культур заявленным паспортным данным: положительно маннит, мальтоза (шигеллы), цитрат Симмонса (сальмонеллы), индол и бета глюкуронидаза (эшерихия), подвижность (все кроме шигелл), а также характерный рост на трехсахарном агаре с железом. Пребывание коллекционных типовых штаммов бактерий в течение 11 суток в почве с 10-кратной концентрацией пестицидов не привело к изменению физиологических показателей микроорганизмов. Численность бактерий сохранялась на высоком уровне.
Динамика ОМЧ и численности кишечных патогенных и условно – патогенных бактерий в эксперименте с гербицидом и представлены на рисунке в логарифмической шкале (рис. 1).
Помимо разной скорости элиминации кишечных бактерий из почвы, отмечали токсичное влияние 10-кратной концентрации гербицида на численность интродуцированных штаммов.
Для всех микроорганизмов 10-кратная концентрация гербицида изменяла их численность более чем на 50% в сравнении с контролем.
Отмечено достаточно продолжительное, до 60 дней, выявление и возможность учета бактерий кишечной палочки и сальмонелл, и быстрое снижение и элиминация из почвы шигелл и энтерококков.
Численность шигелл в течение первых двадцати суток упала до единичных клеток в контроле и опыте, вследствие чего их невозможно было выделить и идентифицировать при прямом посеве среди бурного роста сапрофитной микрофлоры. Среда SS – агар была недостаточно селективной. На ней росли мелкие прозрачные колонии бактерий в количестве до 104 КОЕ/г, принадлежащие к родам Pseudomonas, Aeromonas, Acinetobacter, Achromobacter, и другие, осуществляющие процесс самоочищения почвы. Шигеллы относятся к 3 классу опасности и являются патогенами, вызывающим заражение человека при попадании в организм от 10 до 100 клеток [4]. Шигеллы оказались «неудобными» для изучения оценки влияния гербицида, хотя различия между контролем и опытом позволяли обнаружить пороговую концентрацию. Численность энтерококков также быстро снижалась в почве, не показав различий между опытом и контролем. Вследствие не высокой чувствительности прямого метода (от 100 КОЕ/г), начальная доза заражения почвы должна быть увеличена с 103 до 105 КОЕ/г. Являясь санитарным показателем недавнего загрязнения почвы, энтерококки могли бы быть удобным микроорганизмом для оценки влияния разных концентраций гербицидов. Питательная среда – эскулин канамицин азидный агар для энтерококков, позволяла с высокой степенью селективности выявлять их присутствие.
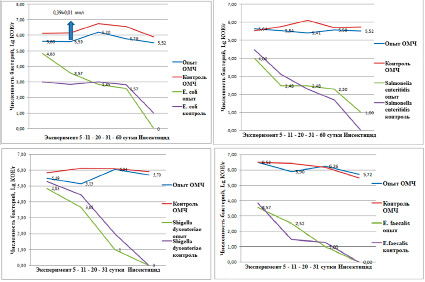
Рис. 2. Влияние инсектицида класса пиретроидов на численность бактерий
Сравнивая продолжительность выявления двух других микроорганизмов из почвы, обнаружена большая устойчивость сальмонелл к 10-кратной концентрации гербицида по сравнению с кишечной палочкой. Крайние обнаружения сальмонелл и кишечной палочки были через 60 дней. При следующем отборе проб почвы через 90 дней – микроорганизмы не найдены.
В районе 14 суток от начала эксперимента была зафиксирована минимальная дегидрогеназная активность в опытной почве с гербицидом, достоверно отличавшаяся более чем на 25% от контроля. Дегидрогеназы бактерий участвуют в окислительно-восстановительных процессах. Их ингибирование в этот период отразилось на ОМЧ и численности кишечных бактерий (кроме энтерококков).
Сходная картина наблюдалась по влиянию инсектицида на динамику численности микроорганизмов в почве (рис. 2).
Численность сальмонелл и шигелл к концу второй недели была ниже в опытной почве под действием инсектицида. Снижение численности кишечной палочки по сравнению с контролем наблюдали после 20 суток эксперимента. Дегидрогеназная активность в опыте по сравнению с контролем была достоверно ниже на 14 и 20 сутки эксперимента, что больше было связано не с интродуцированными штаммами кишечных бактерий, а с ОМЧ. Наибольшую устойчивостью к инсектициду показали сальмонеллы.
Таблица 2
Свойства сальмонелл и кишечной палочки, выделенных из почвы с пестицидами через 30 суток, в сравнении с коллекционной суточной культурой этих же бактерий
|
Название теста |
S. enteritidis 30 сут. Гербицид |
S. enteritidis 30 сут. Инсектицид |
S. enteritidis 1 сут. |
E. coli 30 сут. Гербицид |
E. coli 30 сут. Инсектицид |
E. coli 1 сут. |
|
L-пролинАРИЛАМИДАЗА |
нет |
нет |
нет |
- |
+ |
+ |
|
ПРОДУКЦИЯ H2S |
+ |
+ |
+ |
нет |
нет |
нет |
|
L-ЛАКТАТ |
+ |
+ |
+ |
- |
- |
+ |
|
УСТОЙЧИВОСТЬ К 0/129 |
- |
+ |
+ |
+ |
- |
+ |
|
D-МАЛЬТОЗА |
+ |
+ |
+ |
+ |
+ |
+ |
|
ОРНИТИНДЕКАРБОКСИЛАЗА |
+ |
+ |
+ |
+ |
+ |
+ |
|
D-МАННИТ |
+ |
+ |
+ |
+ |
+ |
+ |
|
D-ТРЕГАЛОЗА |
+ |
+ |
+ |
+ |
+ |
+ |
|
СУКЦИНАТ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ЛИЗИНДЕКАРБОКСИЛАЗА |
+ |
+ |
+ |
нет |
нет |
нет |
|
D-ГЛЮКОЗА |
+ |
+ |
+ |
+ |
+ |
+ |
|
D-MAHHO3A |
+ |
+ |
+ |
+ |
+ |
+ |
|
ТирозинАРИЛАМ ИДАЗА |
+ |
+ |
+ |
+ |
+ |
+ |
|
ЦИТРАТ (НАТРИЯ) |
+ |
+ |
+ |
нет |
нет |
нет |
|
ЭЛЛМАН |
нет |
нет |
нет |
+ |
+ |
+ |
|
ГАММА-ГЛЮТАМИЛ-ТРАНСФЕРАЗА |
- |
- |
+ |
нет |
нет |
нет |
|
АЛ ЬФА-ГАЛАКТОЗИДАЗА |
+ |
+ |
+ |
+ |
+ |
+ |
|
КУМАРАТ |
+ |
+ |
+ |
+ |
+ |
+ |
|
БЕТАТАЛАКТОЗИДАЗА |
нет |
нет |
нет |
+ |
+ |
+ |
|
СБРАЖИВАНИЕ ГЛЮКОЗЫ |
+ |
+ |
+ |
+ |
+ |
+ |
|
D-СОРБИТ |
+ |
+ |
+ |
+ |
+ |
+ |
|
5-КЕТО-0-ГЛЮКОНАТ |
+ |
+ |
+ |
нет |
нет |
нет |
|
ФОСФАТАЗА |
+ |
+ |
+ |
+ |
- |
+ |
|
БЕТА-ГЛЮКУРОНИДАЗА |
нет |
нет |
нет |
+ |
+ |
+ |
|
ИНДОЛ |
нет |
нет |
нет |
+ |
+ |
+ |
|
Морфология колоний |
типовая |
типовая |
типовая |
типовая |
типовая |
типовая |
|
Подвижность |
- |
- |
+ |
- |
- |
+ |

1 сут. S. enteritidis 30 сут. Гербицид 30 сут. Инсектицид
Рис. 3. Морфология бактерий выделенных из почвы с пестицидами через 30 суток, в сравнении с коллекционной суточной культурой этих же бактерий
Несмотря на то, что изучаемые пестициды относились к разным классам химических веществ, полученные данные указали на существенное (более чем на 50%) влияние 10-кратной нормы внесения на микробное сообщество (ОМЧ) и отдельные виды кишечных бактерий для обеих веществ.
Численность как патогенных, так и условно-патогенных бактерий, существенно (на несколько порядков) снижалась за первый месяц эксперимента, что позволяет использовать последние для оценки эпидемиологического статуса почвы, загрязненной пестицидами.
Эксперимент показал на возможность сохранения в прогретой почве споровых и других форм бактерий, ответственных за процесс самоочищения почвы, увеличивших в первые 60 дней свою численность до уровня 105 – 106 КОЕ/г.
Прямой метод посева без предварительного обогащения не учитывает часть клеток микробной популяции, не выросших из-за повреждения химическим веществом. При этом прямой метод показывает реальное состояние и численность интродуцированной популяции бактерий в почве, искажаемое при восстановлении первоначальных свойств культуры в бульонной среде из небольшой части клеток, не подвергшихся токсическому воздействию химического вещества.
Тестирование свойств суточных культур, пересеянных на питательный агар со сред выделения ВСА и Эндо на 30 сутки эксперимента прямым методом, приведено в таблице (табл. 2).
Среди 26 биохимических признаков, положительных для типовых суточных культур, под воздействием пестицидов у E. coli – исчезла гидролазная активности (амидазы) -пролинАРИЛАМИДАЗА. (L-пролин – один из двадцати протеиногенных аминокислот), пропала устойчивость к О/129 – вибростатику (2,4-диамино-6,7-диизопропилптеридинфосфат), подвижность. У S. enteritidis – также устойчивость к вибростатику, подвижность, и фермент обмена аминокислот Гамма-глютамил-трансфераза. Незначительные изменения произошли в морфологии клеток (рис. 3).
В первоначальной суточной культуре сальмонелл и эшерихий преобладали небольшие полиморфные палочки с закругленными концами. Спустя 30 суток пребывания в почве с пестицидами выделенные бактерии приобрели палочковидную форму, что согласуется с имеющимися данными [5, 6].
Выводы
Патогенные кишечные бактерии можно использовать для выявления пороговой концентрации пестицидов, влияющей на микробное сообщество. Шигеллы и энтерококки наиболее чувствительны к пестицидам при выявлении прямым посевом на агаризованных средах. Сальмонеллы и кишечная палочка сохраняется в почве с пестицидами свыше двух месяцев.
Пестициды в 10-кратной норме внесения в почву через 30 суток незначительно изменяют некоторые физиологические и морфологические характеристики тест штаммов E.coli и S. enteritidis.

