За последние несколько десятков лет взоры биотехнологов и микробиологов обратились к высшим актинобактериям, имеющим большое практическое значение в связи с их способностью продуцировать различные биологически активные вещества, в том числе антибиотики, применяемые во многих отраслях – медицине, ветеринарии, растениеводстве, пищевой промышленности [1, 2].
Одной из сфер использования антагонистической активности данных бактерий является создание биологических средств защиты растений от фитопатогенных агентов [3]. Наибольшее значение в создании данных средств имеют стрептомицеты – продуценты вторичных метаболитов с различными ингибирующими, фунгицидными и другими специфическими свойствами [3, 4]. Стабильность штаммов-продуцентов является одним из условий получения стандартных биопрепаратов с высокой эффективностью.
Уровень специфичности и биологической активности штаммов-продуцентов зависит от химической природы синтезируемых биологически активных веществ. Поэтому актуальной является проблема выделения и изучения активных компонентов метаболитного комплекса высших актинобактерий с целью создания новых эффективных биопрепаратов.
При получении высокоактивных биопрепаратов большое значение имеет подбор питательной среды, которая обеспечивает оптимальный рост и размножение бактерий, что приводит к увеличению выхода целевого продукта. В настоящее время при оптимизации состава питательных сред широко используют математический метод планирования экспериментов [5, 6].
Цель работы: на основе изучения спонтанной изменчивости штамма Streptomyces cremeus выделить активные клоны с высокой антагонистической активностью и изучить ингибирующее действие фракций экстракта биомассы штамма в отношении фитопатогенных грибов для дальнейшего определения действующих веществ.
Материалы и методы исследования
Объектом исследования являлся штамм Streptomyces cremeus, выделенный Ю.Е. Коневым из почвенного образца (Армения) [7]. Штамм относится к высшим актинобактериям и представляет собой грамположительные бактерии с ветвящимся мицелием и спорами на прямых спороносцах. Стрептомицеты Streptomyces cremeus – мезофильные, аэробные, нейтрофильные, но с широким диапазоном толерантности к рН, хемоорганотрофные, каталазоположительные, медленно растущие прокариоты. На агаризованных питательных средах требуют присутствия глюкозы и создают белый пушистый мицелий [8]. Использованные в работе питательные среды представлены в таблице 1.
Оптимизация состава питательной среды для культивирования штамма проводилась путем изменения концентрации двух основных компонентов: глюкозы – источника углерода – и соевой муки – источника азота. Матрицу составляли с шагом λ = 0,5, в диапазоне от 9,00 до 11,00 г каждого компонента на 1 л воды. Таким способом исследовали 25 вариантов питательной среды, отличающихся по количеству источника углерода и азота.
Определение массы сухого мицелия проводили после ферментации. Для этого культуральную жидкость центрифугировали (3000 об/мин, 20 мин), фильтровали на вакуум-фильтре и сушили при t = 22–24°С в течение 3 суток.
Для выявления влияния различных факторов на выход мицелия были определены эффекты исследуемых факторов. Эффект определенного уровня фактора равен разнице среднего значения выхода мицелия во всех опытах, где данный фактор находился на этом уровне, и среднего значения выхода для всей серии опытов (формула 1).
Ei = mмиц. ср. i – mмиц. ср. , (1)
где Ei – эффект определенного уровня фактора;
mмиц. ср. i – среднее значение выхода мицелия во всех опытах, где данный фактор находился на этом уровне, г;
mмиц. ср. – среднее значение выхода мицелия для всей серии опытов, г.
Изменение состава питательной среды могло влиять на выход мицелия и на синтез метаболитов, определяющих антагонистическую активность данного штамма, поэтому проводили их экстрагирование из сухого мицелия этиловым спиртом в течение 1 часа. Экстракт в количестве 0,1 мл наносили на бумажные диски и высушивали на воздухе. Оценку антагонистической активности проводили на тестовых фитопатогенных грибах Alternaria alternata и Fusarium graminearum методом диффузии в агар.
Таблица 1
Питательные среды и режимы стерилизации для культивирования стрептомицетов
|
Название питательной среды |
Состав, г на 1 л воды |
Режим стерилизации |
|
Среда 19/6 [5] |
Кукурузный экстракт – 10,4 Крахмал картофельный растворимый – 10,0 (NН4)2SO4 – 3,0; NaCl – 3,0; CaCO3 – 3,0 Агар микробиологический – 20,0 Вода водопроводная – 1 л |
0,8 атм 30 мин |
|
Среда №5 |
Соевая мука – 10,0; Глюкоза – 10,0; NaCl – 5,0 CaCO3 – 3,0; Вода водопроводная – 1 л |
0,5 атм 30 мин |
|
Среда Чапека с сахарозой |
Сахароза – 20,0; К2НРО4 – 1,0; NaNO3 – 2,0 KCl – 0,5; Вода водопроводная – 1 л |
0,6 атм 30 мин |
|
Среда МПА |
Мясо-пептонный бульон – 1 л Агар-агар – 20 г |
0,5 атм 30 мин |
Посев и культивирование штамма проводили поверхностным и глубинным способами на искусственной агаризованной среде 19/6 в течение 7 суток при температуре 280С. Глубинное культивирование осуществляли в колбах Эрленмейера на 750 мл, содержащих 100–120 мл ферментационной среды № 5. Колбы с засеянным штаммом с плотной питательной среды устанавливали на качалку (220 об/мин) и инкубировали при t = 27 – 28°С в течение 4 суток.
Отбор вариантов с антагонистической активностью против грибов-фитопатогенов проводили поэтапно.
На первом этапе работы изучали популяционный состав штамма, для чего был произведен первый моноспоровый рассев для получения изолированных колоний на агаризованной питательной среде с кукурузным экстрактом и крахмалом в чашках Петри. Через 7 суток роста при t = 28°С выросшие изолированные колонии пересеивали в пробирки со скошенной средой 19/6. Для дальнейшей работы отбирали наиболее характерные морфологические варианты. Для повышения целевой активности вариантов проводили 3 повторных моноспоровых рассева для получения изолированных колоний.
На втором этапе проводили ферментацию в колбах Эрленмейера на 750 мл, содержащих 100–120 мл ферментационной среды № 5. Колбы с засеянным штаммом с плотной питательной среды устанавливали на качалку (220 об/мин) и инкубировали при 27–28°С в течение 5 суток. После проведенной ферментации определяли антагонистическую активность культуральной жидкости. Опыты проводили в 3 повторностях.
Для третьего этапа работы выбирали наиболее активный вариант по признаку антагонистической активности и использовали его для получения сухого экстракта. После проведения экстракции исследовали зависимость антагонистической активности от концентрации сухого экстракта. Использовали концентрации 0,1, 0,25 и 0,5 мг/мл.
Экстрагирование для выделения активного метаболитного комплекса, продуцируемого штаммом, проводили в три этапа.
Первое экстрагирование. От культуральной жидкости штамма, полученной на 5-е сутки роста, отделяли мицелий с помощью центрифуги (3000 об/мин, 20 минут). Отделенный мицелий экстрагировали этиловым спиртом в соотношении 1:5 в течение 30 минут при постоянном перемешивании (500 об/мин). Далее фильтровали спиртовой экстракт на вакуум-фильтре, концентрировали на ротационном испарителе при t=45–55°С и 0,03–0,005 Мпа, высушивали в сушильном шкафу в течение 1 суток при t=35°С. В результате получали лабораторный образец биопрепарата, представляющий собой гигроскопичный порошок, который хранили в стеклянных бюксах в вакуум-эксикаторе при t = +4±2ºС. Для оценки инсектицидной и антагонистической активности лабораторный образец использовали без дополнительной очистки. Часть этанольного экстракта отобрали для исследования биологической активности. Оставшийся экстракт использовали на следующем этапе.
Второе экстрагирование. Сухой этанольный экстракт экстрагировали этилацетатом в соотношении 1:35 в течение 20 мин на ультразвуковой ванне. Экстракт концентрировали на ротационном испарителе при t = 45–55°С и давлении 0,03–0,005 МПа до сухого остатка и отбирали половину для исследования активности. Дополнительно проводили отбор водной части экстракта до упаривания.
Третье экстрагирование проводили метанолом по методике, аналогичной предыдущей.
Метод колоночной хроматографии был применен для выделения отдельных компонентов активного комплекса из сухого экстракта. В качестве сорбента применяли силикагель. Для более эффективного разделения смеси метаболитов штамма Str. cremeus использовали градиентное элюирование, начинали разделять неполярным растворителем (гексан), далее постепенно увеличивали полярность смеси и переходили к высокополярным растворителям. Объем элюента для каждой фракции составлял 50 мл.
Перед заполнением колонки сорбент (35 мл) заливали гексаном. Растворяли исследуемый экстракт (200 мг) в этиловом спирте (5 мл) на ультразвуковой ванне, далее наносили на сухой силикагель (5 мл) и вносили в колонку на силикагель с гексаном. Растворители в указанном порядке наносили на колонку. В ходе работы были отобраны аликвоты из каждой фракции (10 мл) для анализа инсектицидной и фунгицидной активностей.
Оценку фунгицидной активности экстрактов из стрептомицета проводили методом диффузии в агар. Экстракты растворяли в воде в концентрации 0,1, 0,25 и 0,5 мг/мл. Оценку активности культуральной жидкости проводили без разведения. Антагонистическую активность полученного раствора определяли методом лунок по диаметру зон задержки роста тест-культур фитопатогенных микроорганизмов. Для оценки активности в чашках Петри с агаризованной средой Чапека или МПА, засеянной тест-культурами, делали лунки с помощью стандартного бура (d=5 мм), а затем в лунки пастеровской пипеткой вносили испытуемый раствор. Чашки инкубировали при t=28°С. Зоны задержки роста фитопатогенных бактерий замеряли через 24–48 ч, а грибов – через 3–5 суток после засева. В качестве тест-объектов использовали:
− фитопатогенные грибы из Государственной коллекции ВИЗР: Alternaria alternate (Keissler, 1912), Bipolaris sorokiniana (Shoemaker 1959), Botrytis cinerea (Persoon, 1797), Colletotrichum falcatum (Went 1893), Colletotrichum lagenarium (Ellis & Halsted, 1893), Fusarium culmorum (Sass, 1892), F. graminearum (Schwabe, 1839), F. redolence, F. sambucinum (Brondeau, 1855), F. solani (Sass, 1881), F. sporotrichella;
− условно-патогенные дрожжи Candida albicans (Berkhout, 1923) АТСС 10231.
Для сравнения и контроля использовали тестовые бактериальные штаммы: Escherichia coli АТСС 8739, Staphylococcus aureus АТСС 6538.
Статистическую обработку результатов проводили методом вариационной статистики с вычислением среднего арифметического для каждой группы опытов и стандартного отклонения от среднего арифметического. Достоверность различий между контрольными и опытными измерениями оценивали с помощью критерия Стьюдента [9, 10].
Результаты исследования и их обсуждение
На первом этапе выявления наиболее активных вариантов проводили оценку антагонистической активности Str. cremeus в отношении грибов Fusarium graminearum и Alternaria alternate (рис. 1).
В большинстве исследуемых вариантов можно отметить высокую антагонистическую активность в отношении фитопатогенных грибов. Следует выделить варианты № 5, 6, 12, 13 и 24 с наибольшими значениями размеров зон задержки роста тест-культур. Варианты № 13 и 24 также отличаются максимальным выходом мицелия. На основании этих результатов и экономической целесообразности для дальнейшей работы был отобран вариант питательной среды № 13: 10,00 г глюкозы, 10,00 г соевой муки, 5,0 г NaCl, 3,0 г CaCO3. Str. cremeus на среде 19/6 формирует следующий устойчивый морфологический вариант колоний. Изучаемый штамм обладает высокой фунгицидной активностью (рис. 2), и культуральная жидкость активна в отношении фитопатогенных грибов. Скрининг осуществляли на двух видах грибов для определения антагонистической активности культуральной жидкости всех выделенных вариантов. В качестве тест-грибов использовали возбудителей опасных заболеваний растений грибы Botrytis cinerea и Fusarium culmorum, которые удобно использовать для скрининга, поскольку они обладают высокой скоростью роста. По результатам экспериментов были отобраны 6 наиболее активных вариантов. Результаты представлены на рисунке 2.
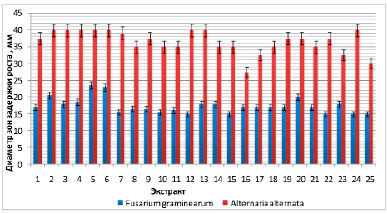
Рис. 1. Антагонистическая активность экстрактов штамма Str. cremeus в отношении грибов F. graminearum и A. alternata
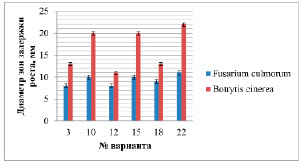
Рис. 2. Антагонистическая активность культуральной жидкости штамма Str. cremeus biovar. octemberanun var. nov. 729 на культуры Fusarium culmorum и Botrytis cinerea
Полученные данные свидетельствуют о высокой антагонистической активности полученных вариантов в отношении Botrytis cinerea. Варианты № 10, 15, 22 проявили наибольшую активность – диаметры зон задержки роста от 20 до 22 мм. Варианты № 3, 12, 18 обладают несколько меньшей активностью – диаметры зон задержки роста от 11 до 13 мм. Активность в отношении Fusarium culmorum была ниже: диаметр зон задержки роста составлял от 8 до 11 мм. Вариант № 22 проявил максимальную фунгицидную активность – диаметр зон задержки роста 11–22 мм.
Поскольку среди грибов рода Fusarium имеется значительное число фитопатогенных видов, то на следующем этапе решили расширить спектр тестовых фитопатогенных видов (табл. 2 и 3).
Вариант № 22 проявил высокую активность в отношении всех грибов рода Fusarium. Диаметр зон задержки роста составлял от 9 до 15 мм. Тем самым показано, что вариант № 22 обладает высокой фунгицидной активностью в отношении всех тест-грибов. Для дальнейшей работы был выбран именно он. После проведения экстракции биологически активного вещества по описанной методике исследовали его антагонистическую активность в отношении широкого спектра грибов (рис. 3).
Оценка антагонистической активности экстракта варианта № 22 показала, что имеется зависимость активности от концентрации экстракта: при использовании концентрации 0,1 мг/мл диаметр зон задержки роста составил от 11 до 50 мм, а при концентрации 0,5 мг/мл – от 14,5 до 50 мм. Максимальная активность была обнаружена против гриба Alternaria alternata.
Таблица 2
Антагонистическая активность культуральной жидкости штамма Str. cremeus biovar. octemberanun var. nov. 729 на фитопатогенные грибы рода Fusarium
|
№ |
№ варианта |
Диаметр зон задержки роста, мм |
||||
|
F. graminearum |
F. redolence |
F. sambucinum |
F. solani |
F. sporotrichella |
||
|
1 |
Исх. штамм* |
– |
– |
– |
– |
– |
|
2 |
3 |
9±0,1 |
11±0,09 |
10±0,12 |
7±0,08 |
12±0,09 |
|
3 |
10 |
8±0,08 |
12±0,1 |
12±0,08 |
9±0,09 |
14±0,1 |
|
4 |
12 |
8±0,08 |
11±0,09 |
10±0,09 |
8±0,1 |
13±0,09 |
|
5 |
15 |
9±0,09 |
10±0,11 |
12±0,12 |
8±0,09 |
15±0,12 |
|
6 |
18 |
9±0,1 |
9±0,09 |
11±0,09 |
7±0,08 |
12±0,08 |
|
7 |
22 |
10±0,09 |
12±0,09 |
13±0,1 |
9±0,11 |
15±0,08 |
*Исходный штамм потерял свою фунгицидную активность в результате хранения в связи с длительным перерывом между рассевами. Наша задача состояла в выделении активного варианта.
Таблица 3
Антагонистическая активность культуральной жидкости штамма Str. cremeus biovar. octemberanun var. nov. 729 на фитопатогенные грибы
|
№ |
№ варианта |
Диаметр зон задержки роста, мм |
|||
|
Alt. alternata |
B. sorokiniana |
Col. falcatum |
Col. lagenarium |
||
|
1 |
Исх. штамм |
– |
– |
– |
– |
|
2 |
3 |
8±0,08 |
13±0,08 |
13±0,09 |
12±0,1 |
|
3 |
10 |
10±0,1 |
15±0,1 |
14±0,1 |
11±0,12 |
|
4 |
12 |
9±0,09 |
15±0,12 |
12±0,08 |
10±0,09 |
|
5 |
15 |
9±0,08 |
13±0,1 |
14±0,12 |
12±0,1 |
|
6 |
18 |
9±0,1 |
13±0,09 |
13±0,08 |
11±0,08 |
|
7 |
22 |
10±0,11 |
14±0,08 |
15±0,12 |
11±0,08 |
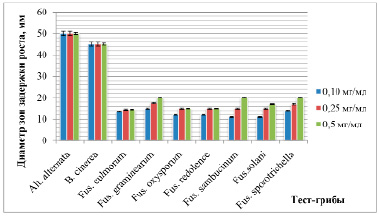
Рис. 3. Антагонистическая активность экстракта штамма Str. cremeus biovar. octemberanun var. nov. 729 в отношении фитопатогенных грибов
Заключение
В результате поддерживающего отбора штамма Str. cremeus было выделено 120 моноклоновых изолятов, которые были охарактеризованы по культурально-морфологическим признакам, из них 95% – основного типа. Выявлены варианты, обладающие широким спектром антифунгальной активности. Отобран вариант № 22, который отличается значительной интенсивностью роста, продуктивностью и высокой эффективностью антифунгального действия. На основе варианта № 22 получен сухой спиртовой экстракт мицелия, содержащий метаболитный комплекс с высокой антифунгальной активностью.

