Засоленность почв является одной из наиболее важных сельскохозяйственных проблем во всем мире. Сокращение площадей посевов из-за засоленности почв сильно влияет на развитие сельскохозяйственного хозяйства [1]. Одной из причин засоленности почв является изменение климата. Глобальное потепление вызывает дефицит пресной воды и приводит к использованию минерализованной воды для орошения, что обусловливает еще большую их засоленность [2]. Во всем мире площадь засоленных почв растет с каждым годом, что оказывает все большее влияние на сельское хозяйство, биоразнообразие и окружающую среду. Являясь сильным абиотическим стрессом, засоленность вызывает до 70% потери урожая культур [3]. Одной из основных культур, помогающих снижать дефицит белка в продуктах питания, является соя (Glycine max (L.) Merr.). Однако соя относится к несолеустойчивым культурам, и засоленность почв является одним из основных факторов, сдерживающих ее производство [4]. Засоленность почв отрицательно влияет на развитие растений сои из-за осмотических явлений, токсичности ионов солей и изменения физико-химических свойств почвы. Для повышения продуктивности сои на засоленных почвах применяют химические азотные и фосфорные удобрения. Эти удобрения дают положительный эффект, но при этом отрицательно влияют на окружающую среду [5]. Фосфор является одним из основных питательных элементов растений, он участвует в фотосинтезе, синтезе ферментов и образовании АТФ. Также фосфор необходим клубеньковым бактериям – симбионтам сои, которые при дефиците фосфора не могут образовывать клубеньки и фиксировать азот [6]. Доказано, что засоленность почв существенно снижает биодоступность фосфора [7]. Поэтому поиск недорогих и экологически чистых путей повышения доступности фосфора на засоленных почвах является актуальным. Альтернативой минеральным фосфорным удобрениям представляется использование фосфатмобилизующих бактерий, способных переводить нерастворимые фосфаты почвы в растворимую доступную растениям форму, улучшать их фосфорное питание и стимулировать рост [8]. Однако многие фосфатмобилизующие микроорганизмы не способны расти и мобилизовать фосфаты на засоленных почвах. Большинство из них обладают низкой устойчивостью к засолению и не подходят в качестве инокулянтов для применения на засоленной почве [9].
Целями данного исследования были выделение из ризосферы сои солетолерантных фосфатмобилизующих бактерий, их идентификация, изучение солеустойчивости, мобилизации фосфатов и способности влиять на рост сои в условиях солевого стресса.
Материалы и методы исследований
Объектами исследований служили изоляты фосфатмобилизующих бактерий, выделенные из почв ризосферы сои, растущей на засоленных полях в Алматинской области Казахстана в июне-июле 2021 года. Тип почвы серозем обыкновенный, основные агрохимические показатели: гумус – 1,1%, легкогидролизуемый азот – 56,8 мг/кг почвы, подвижный фосфор – 20,8 мг/кг почвы и подвижный калий – 457,1 мг/кг. Реакция водного раствора почвы рН 8,9.
Выделение фосфатмобилизующих бактерий проводили на агаризованной среде NBRIP с добавлением 10% NaCl. Среда NBRIP содержит нерастворимый трикальцийфосфат в виде мелкодисперсного осадка, придававшего среде равномерную мутность. При росте на этой среде фосфатмобилизующие бактерии образуют зоны растворения фосфатов (зоны гало). Изучение фосфатмобилизующей активности бактерий проводили по методике Сеги [10].
Солеустойчивость фосфатмобилизующих бактерий определяли в жидкой среде NBRIP, содержащей 100, 250 и 500 мМ NaCl. Рост бактерий определяли на спектрофотометре (PD-303, «Apel», Japan) при 540 нм. Оценку роста бактерий проводили по шкале, где «–» отсутствие роста, «+» наличие роста, добавление «+» указывает на интенсивность роста.
Ризобии идентифицировали молекулярно-генетическим методом Сенгера путем секвенирования гена 16S рРНК. Геномную ДНК выделяли из суточной культуры бактерий с помощью наборов PureLink® Genomic DNA Kits (Invitrogen, США). Бактерии идентифицировали путем изучения последовательности участка гена 16S rRNA с универсальными праймерами [11]. Секвенирование фрагментов гена 16S rRNA бактерий проводили на автоматическом секвенаторе 3500 DNA Analyzer (Applide Biosystems, США) с использованием набора Big Dye Terminator v3.1 Cycle Sequencing Kit (Applide Biosystems, США) по протоколу производителя (BigDye® Terminator v3.1 Cycle Sequencing Kit Protocol Applied Biosystems, USA). Для циклического секвенирования производства использовали набор от Protocol Applied Biosystems, США. Результаты секвенирования обрабатывали с помощью программы SeqA (Applide Biosystems). Поиск гомологичных нуклеотидных последовательностей генов 16S rRNA проводили с помощью программы BLAST в международной базе данных банка генов NCBI, США. Филогенетический анализ осуществляли с помощью программы MEGA6. Выравнивание нуклеотидных последовательностей проводили по алгоритму ClustalW. Для построения филогенетических деревьев использовали метод NJ (Neighbor-Joining).
Влияние фосфатмобилизующих бактерий на рост сои определяли в условиях засоления почвы. Стерильные семена сои инокулировали суспензией бактерий (1×108 КОЕ/мл) в течение 2 часов при 23oС. После этого высевали в сосуды на 5000 мл с засоленной почвой по 3 растений на сосуд (агрохимические параметры почвы приведены выше). Через 3 месяца растения собирали, высушивали корни, стебли и литья до постоянного веса и определяли их сухой вес.
Статистический анализ полученных результатов проводили с использованием пакета программ STATISTICA 10.0, var. 6.0 [12]. Различия считались значимыми при p<0,05, значения представлены как среднее значение (M) ± стандартное отклонение (±SEM).
Результаты исследований и их обсуждение
Из ризосферы здоровых растений сои, растущих на засоленных почвах, было собрано 56 образцов почв. На среде NBRIP с 10% NaCl были выделены 32 изолята бактерий, демонстрирующих четкие зоны мобилизации фосфатов (зоны гало). Проведен первичный скрининг изолятов и отобраны 12 бактерий, которые образовывали большую зону мобилизации фосфатов. Изучены их основные морфологические и биохимические признаки (табл. 1).
Установлено, что колонии изолятов были круглые с плоским или выпуклым профилем, ровным краем, диаметром 1,0–3,5 мм. Цвет колоний был белый, кремовый и желтый. При исследовании морфологии клеток установлено, что бактерии были как спорообразующими, так и неспорообразующими, имели палочковидную форму, были подвижными, грамположительными и грамотрицательными. Исследование биохимических свойств показало, что изоляты были аэробами, имели разную способность использовать соединения углерода, образовывать индол, сероводород и разжижать желатину. По основным морфологическим и биохимическим признакам выделенные изоляты были отнесены к родам Bacillus и Pseudomonas.
Изучение устойчивости изолятов к солевому стрессу проводили при равных концентрациях NaCl (100, 250 и 500 mМ) в среде культивирования. В таблице 2 приведены данные 12 наиболее солеустойчивых изолятов.
Выявлено, что изоляты обладали разной устойчивостью к солевому стрессу (табл. 2). При концентрации NaCl 100 mМ росли все изоляты, а при концентрации 500 mМ NaCl – только пять из них. Изоляты ФT2, ФT4, ФM9, ФM12 и ФC11 отобраны как наиболее солеустойчивые и были использованы в дальнейшей работе.
Важным показателем для применения фосфатмобилизующих бактерий на засоленных почвах является их способность к мобилизации фосфатов при солевом стрессе. В связи с этим были проведены эксперименты по изучению активности мобилизации фосфатов при различной степени засоленности. Полученные данные приведены в таблице 3.
Таблица 1
Морфологические признаки солетолерантных фосфатмобилизующих изолятов
|
Изоляты |
Характеристика колоний |
Характеристика клеток |
||||||
|
Форма |
Край |
Профиль |
Цвет |
Размер, мм |
Подвижность |
Форма |
Грамм +/– |
|
|
ФT1 |
круглая |
ровный |
плоский |
белый |
2–3 |
+ |
палочки |
+ |
|
ФT2 |
круглая |
ровный |
выпуклый |
желтый |
1–2 |
– |
палочки |
– |
|
ФT15 |
круглая |
ровный |
плоский |
желтый |
3–4 |
– |
палочки |
– |
|
ФT4 |
круглая |
ровный |
выпуклый |
белый |
1–3 |
+ |
палочки |
+ |
|
ФM9 |
круглая |
ровный |
выпуклый |
кремовый |
1–3 |
+ |
палочки |
+ |
|
ФM12 |
круглая |
ровный |
плоский |
белый |
2–3 |
+ |
палочки |
+ |
|
ФЛ27 |
круглая |
ровный |
плоский |
желтый |
2–3,5 |
– |
палочки |
+ |
|
ФУ36 |
круглая |
ровный |
плоский |
кремовый |
1–3 |
+ |
палочки |
– |
|
ФC11 |
круглая |
ровный |
выпуклый |
белый |
2–3,5 |
+ |
палочки |
+ |
|
ФT34 |
круглая |
ровный |
выпуклый |
кремовый |
2–3 |
– |
палочки |
+ |
|
ФM22 |
круглая |
ровный |
выпуклый |
желтый |
2–3 |
+ |
палочки |
– |
|
ФM19 |
круглая |
ровный |
выпуклый |
кремовый |
1–3 |
+ |
палочки |
– |
Таблица 2
Скрининг солеустойчивости изолятов бактерий
|
Изоляты |
Концентрация NaCl в среде, mM |
||
|
100 |
250 |
500 |
|
|
ФT1 |
++ |
+ |
– |
|
ФT2 |
++++ |
+++ |
++ |
|
ФT15 |
++ |
+ |
– |
|
ФT4 |
+++ |
+++ |
++ |
|
ФM9 |
++++ |
+++ |
++ |
|
ФM12 |
++++ |
+++ |
+++ |
|
ФЛ27 |
++ |
+ |
– |
|
ФУ36 |
+++ |
+ |
– |
|
ФC11 |
++++ |
+++ |
+++ |
|
ФT34 |
++ |
+ |
– |
|
ФM22 |
+++ |
+ |
– |
|
ФM19 |
+++ |
+ |
– |
Примечание: «–» отсутствие роста; «+» наличие роста; дополнительный «+» указывает на интенсивность роста изолятов.
Таблица 3
Фосфатмобилизующая активность изолятов при солевом стрессе
|
Изоляты |
Концентрация NaCl в среде, mM |
|||
|
0 |
100 |
250 |
500 |
|
|
Диаметр зоны мобилизации фосфатов, мм |
||||
|
ФT2 |
32,6±0,2 |
26,6±0,7 |
21,9±0,1 |
15,8±0,2 |
|
ФT4 |
37,4±0,1 |
33,4±0,2 |
28,4±0,3 |
26,9±0,3 |
|
ФM9 |
32,9±0,4 |
28,9±0,1 |
22,9±0,1 |
15,9±0,1 |
|
ФM12 |
36,2±0,2 |
30,2±0,4 |
26,8±0,2 |
24,8±0,1 |
|
ФC11 |
36,2±0,2 |
32,5±0,2 |
27,7±0,2 |
25,7±0,2 |
Примечание: р<0,05; n = 5.
Их данных таблицы 3 следует, что изоляты способны к мобилизации фосфатов в условиях солевого стресса. Однако с увеличением концентрации NaCl в среде активность мобилизации снижалась. Показано, что у двух изолятов (ФT2 и ФM9) при концентрации 500 mМ NaCl активность мобилизации снижалась на 52–53%, у изолятов ФT4, ФM12 и ФC11 – только на 28–30%. Эти данные показывают, что солевой стресс не оказывал сильного воздействия на мобилизацию фосфатов изолятами ФT4, ФM12 и ФC11 и они являются солеустойчивыми.
Молекулярно-генетическую идентификацию изолятов ФT2, ФT4, ФM9, ФM12 и ФC11 проводили методом Сенгера, путем секвенирования 16S rRNA гена и сравнения нуклеотидных последовательностей гена 16S rRNA со штаммами из базы данных GenBank NCBI. Показано, что в филогенетическом отношении штаммы ФT2, ФT4, ФM9 наиболее близки к роду Pseudomonas, видам Pseudomonas rhizosphaerae ФT2, Ps. koreensis ФT4 и Ps. sp. ФM9, штаммы ФM12 и ФC11 относятся к роду Bacillus и определены как виды Bacillus pumilus ФM12 и B. sp. ФC11.
При отборе штаммов бактерий для применения в сельском хозяйстве одним из важных показателей является способность стимулировать рост и развитие агрокультур. Изучение влияния солетолерантных фосфатмобилизующих бактерий на рост сои проводили на сильнозасоленной почве. В опытах использовали штаммы ФT4, ФM12 и ФC11, контролем служили семена без обработки. Полученные результаты представлены на рисунке.
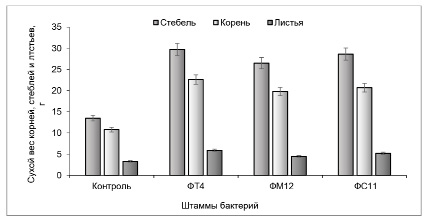
Влияние инокуляции солетолерантными фосфатмобилизующими бактериями на сухой вес растений сои
Установлено, что инокуляция семян солетолерантными фосфатмобилизующими бактериями существенно снижала негативное влияние солевого стресса на растения сои. По сравнению с контролем в вариантах с инокуляцией растений были более зелеными, высокими и крепкими. При этом сухой вес растений существенно увеличился: корней – в 1,9–2,1 раза, стеблей – в 2,0–2,2 раза, листьев – в 2,5–3,5 раза по сравнению с контролем (рисунок). Установлено, что штамм Ps. koreensis FT4 оказывал наиболее высокое стимулирующие влияние на рост и развитие растений сои.
Заключение
Из ризосферы растений сои, растущих на засоленных почвах, были выделены 32 изолята фосфатмобилизующих бактерий. Проведен первичный скрининг и отобраны 12 солеустойчивых и наиболее активных изолятов бактерий. Были изучены их основные морфологические и биохимические признаки. Изучена способность изолятов к росту при высоком солевом стрессе. Отобраны пять изолятов – ФT2, ФT4, ФM9, ФM12 и ФC11. Важным показателем для применения в сельском хозяйстве является способность бактерий к мобилизации фосфатов в условиях засоления. Установлено, что изоляты могут мобилизовать фосфаты при высоком солевом стрессе. Наиболее высокую мобилизацию фосфатов проявили три изолята – ФT4, ФM12 и ФC11, у которых активность мобилизации при солевом стрессе снижалась на 28–30%. Проведена идентификация солетолерантных фосфатмобилизующих изолятов бактерий молекулярно-генетическим методом Сенгера. Показано, что штаммы бактерий относятся к роду Pseudomonas (Ps. rhizosphaerae ФT2, Ps. koreensis ФT4 и Ps. sp. ФM9) и к роду Bacillus (Bacillus pumilus ФM12 и B. sp. ФC11). Исследование влияния солетолерантных фосфатмобилизующих бактерий на рост и развитие растений сои показало, что предпосевная инокуляция бактериями семян сои смягчала негативное влияние засоления: инокулированные растения имели более высокую длину стебля и корней и большее число листьев по сравнению с неинокулированными растениями. Так, сухой вес стеблей и корней увеличился в 2 и более раза, листьев – до 3,5 раза.
Таким образом, выделены и идентифицированы новые штаммы солетолерантных фосфатмобилизующих бактерий. Предпосевная инокуляция семян сои этими бактериями стимулирует рост и развитие растений сои в условиях высокого солевого стресса. Применение новых штаммов бактерий имеет большой потенциал при выращивании сои на засоленных почвах, так как их использование в качестве инокулянтов смягчает негативное влияние засоления и помогает растениям выживать в стрессовых условиях. Кроме того, применение солетолерантных фосфатмобилизующих бактерий в качестве биоудобрения позволит снизить дозы минеральных фосфорных удобрений.

